
1.3 Дослідження наноструктурованих композитних матеріалів на основі поліаніліну та поліпіролу як електрокаталізаторів окислення метанолу.
В останній час набули широкого розвитку дослідження зі створення наноструктурованих електропровідних полімерів (ЕПП), а також нанокомпозитів на їх основі, що обумовлено значними перспективами застосування таких матеріалів у сучасних та майбутніх технологіях. Серед таких матеріалів можна зазначити 1-D наноструктури ЕПП (нановолокна, нанотубули) [118-120] та гібридні нанокомпозити на основі ЕПП та оксидів перехідних металів [121-124], які, зокрема, можуть бути застосовані як молекулярні будівельні блоки в наноелектронних пристроях, транзисторах, сенсорах та актюаторах, енергоперетворюючих системах тощо.
Нещедавно в роботі [125] була показана можливість безтемплатного електросинтезу у фосфатному буферному розчині плівок поліпіролу (ППі), які уявляють собою нановолоконні сітки з діаметром нановолокон 50-220 нм. Ми припустили, що подальша модифікація таких плівок нанорозмірною платиною дозволить одержати 1-D гібридні наноструктури, які можуть бути використані в якості електрокаталізаторів різних процесів, зокрема, окислення спиртів.
Електрохімічний синтез плівок нановолоконного ППіfib відповідно до [125] здійснювали в потенціостатичному режимі (0,85 В) у водному розчині з рН 6,8, що містив 0,1 М піролу, 0,07 М LiClO4 та 0,2 М фосфатний буферний розчин (Na2HPO4 + NaH2PO4), використовуючи 3-х електродну неподілену комірку (робочий електрод – платиновий стрижень з видимою площею 0,32 см2, допоміжний електрод – платинова сітка, електрод порівняння – Ag/AgCl) на комп’ютеризованому електрохімічному комплексі, з використанням потенціостату ПІ-50-1. Оскільки, відповідно до [125], наявність фосфатного буферного розчину (ФБР) заданої концентрації критично впливає на морфологію плівок ППі, нами для порівняння також були одержані полімерні плівки нерегулярної структури з використанням в якості електроліту водного розчину, що містив 0,1 М піролу та 0,27 М LiClO4.
Як видно із наведеної на рис. 1.42а хроноамперограми, що відповідає електросинтезу за зазначених вище умов, на початковій стадії (нуклеація) відбувається утворення олігомерів ППі з подальшим досить повільним ростом ланцюгів до 1-D наноструктур ППіfib. Навпаки, за відсутності в електроліті ФБР відбувається стрімкий ріст плівки ППі нерегулярної морфології (рис. 1.42б).
Зазначена відмінність в перебігу процесу електрополімерізації піролу в різних електролітах очевидно обумовлена різним механізмом формування полімерних плівок в них. Відповідно до [126] олігомери піролу, що утворюють ся на початковій стадії електросинтезу, можуть в подальшому зазнавати нерегу-

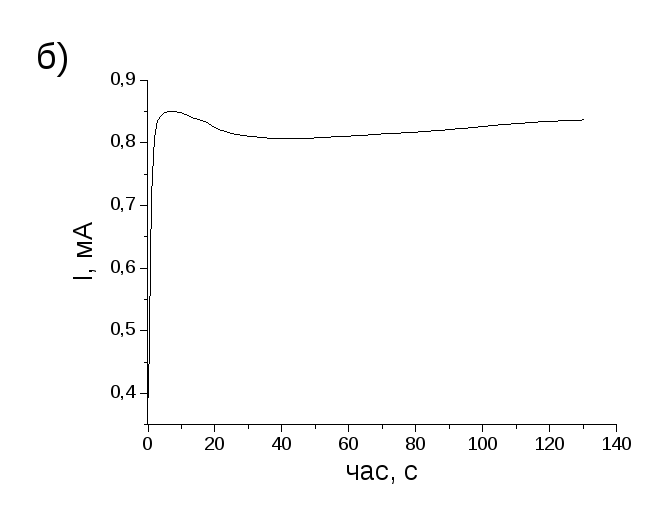
Рисунок 1.42 – Хроноамперограми електросинтезу плівок ППі (Е=0,85 В) у водних електролітах: 0,1 М піролу, 0,07 М LiClO4, 0,2 М ФБР (а) та 0,1 М піролу, 0,27 М LiClO4 (б).
лярної агломерації або впорядкованої самозбірки, причому коли в системі домінуючими є електростатичні взаємодії переважно відбувається випадкова агрегація, в той час як здатність олігомерів до утворення водневих зв’язків з аніонами електроліту (домінуючий фактор) промотує ріст впорядкованих структур [127]. В електроліті з ФБС, за досить висого значення рН під час процесу нуклеації, оточення в розчині сприяє утворенню комплексу мономера з атомами кисню аніонів HPO42-/H2PO4- через водневі зв’язки, що й забезпечує можливість самозбірки олігомерів до добре впорядкованих структур у формі пучків. Останні, в свою чергу, слугують затравкою для подальшого росту 1-D наноструктур ППіfib. За відсутності ФБР в електроліті та при високій концентрації аніонів ClO4- вирогідність утворення водневих звязків є значно меншою, в той час як слід очікувати значної електростатичної взаємодії – утворення іонних звязків між позитивно зарядженими олігомерами піролу та аніонами-допантами, що й призводить до швидкої агрегації та утворення плівки ППі нерегулярної структури.
Відомо, що ЕПП можуть виступати в якості електропровідної основи (підкладки) в якій можуть бути дисперговані нанорозмірні метали, зокрема платина, з утворенням гібридних композитів типу ЕПП/Pt [128]. Такі матеріали можуть бути перспективними електрокаталізаторами ряду важливих процесів, наприклад окислення метанолу, який реалізується в метанольних паливних елементах. З іншого боку відомо, що наноматеріали з високою площею поверхні та поруватістю мають значно покращені характеристики в якості електродних матеріалів для різних застосувань [128]. Ми припустили, що нановолоконний ППіfib може бути ефективним носієм для нанорозмірної платини, а одержані на його основі нанокомпозиційні плівки ППіfib/Pt – виявляти підвищену електрокаталітичну активність в реакції окислення спиртів, зокрема метанолу, порівняно з аналогічними нанокомпозиційними плівками на основі „звичайного” ППі (ППі/Pt). Для перевірки даного припущення нами було проведено модифікування нанорозмірною платиною плівок ППі, сформованих електрохімічно в присутності ФБР та за його відсутності, з одержанням нанокомпозиційних плівок ППіfib/Pt та ППі/Pt, відповідно. Наночастинки Pt були введені в полімерні плівки електрохімічно, з використанням електроліта складу 5мМ H2PtCl6 в 0,1 М H2SO4. Відновлення частинок платини проводили в потенціостатичному режимі при -0,2 В, пропускаючи заряд 0,03 Кл. Одержані електроди з плівками ППіfib/Pt та ППі/Pt промивали водою та висушували у сушильній шафі при 90С 5 хвилин.
Оцінку електрокаталітичної активності плівок ППі/Pt та ППіfib/Pt в реакції окислення метанолу проводили методом циклічної вольтамперометрії. Циклічні вольтамперограми (ЦВА) ППіfib/Pt (наведена на рис. 1.43а) та ППі/Pt в 0,5 М сірчаній кислоті є близькими між собою і не мають чітко виражених піків, що є характерним для ППі. Невеликий розширений пік (плече) в області -0,20,0 В відповідає адсорбції/десорбції водню, що утворюється при відновленні протонів електроліту за значних від’ємних потенціалів, на наночастинках Pt, які дисперговані в полімерній матриці [129].
Додавання в електроліт CH3OH призводить до суттєвих змін в ЦВА (рис. 1.42б та 1.43). У випадку плівки ППі/Pt окислення метанолу починається при потенціалах ~ 0,4 В і пік окислення досягається при потенціалі 0,62 В.

Рисунок 1.42 – Циклічні вольамперограми композиційної плівки ППіfib/Pt в електролітах: 0,5 М H2SO4 (а) та 0,5 М H2SO4 + 0,5 М СH3ОН (б). Швидкість розгортки потенціалу – 10 мВ/с.
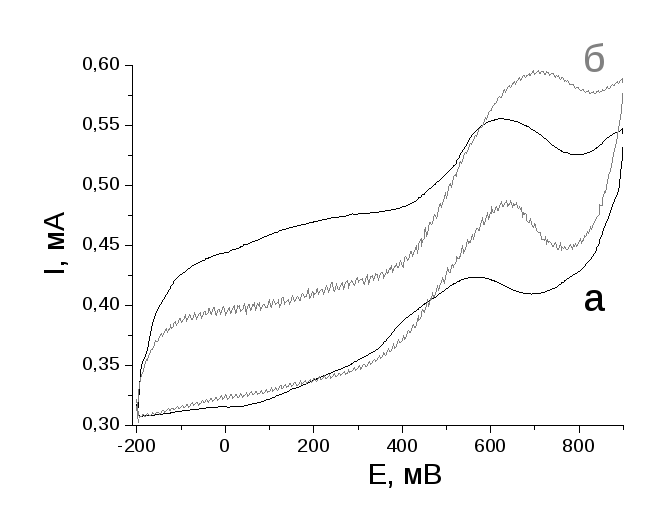
Рисунок 1.43 – Циклічні вольамперограми композиційних плівок ППі/Pt (а) та ППіfib/Pt (б) в 0,5 М H2SO4 + 0,5 М СH3ОН. Швидкість розгортки потенціалу – 10 мВ/с.
Використання в якості елетрокаталізатора ППіfib/Pt призводить до зміщення в від’ємний бік потенціалів початку окислення спирту (до ~ 0,3 В), але пік окислення спостерігається при потенціалі 0,70 В. При цьому у випадку ППіfib/Pt мають місце в 2-2,5 рази більші струми окислення метанолу (0,170,19 мА), ніж у випадку композитної плівки на основі ППі нерегулярної морфології (рис. 1.43). На катодних гілках ЦВА в електроліті 0,5 М H2SO4 + 0,5 М СH3ОН, наявні лише піки окислення метанолу при 0,63 (для ППіfib/Pt) та 0,56 В (ППіfib/Pt), в той час як хвилі відновлення відсутні. Причиною такої аномальної поведінкі відповідно до [130, 131] є адсорбція та взаємодія різних частинок інтермедіатів на поверхні електроду. Таким чином, нановолоконна морфологія полімеру в композиційному електрокаталізаторі ППіfib/Pt забезпечує більш високі значення струмів окислення метанолу та більш негативний потенціал їхньої появи, в порівнянні з аналогічним композитом на основі „звичайного” ППі.
Нещодавно було показано [132], що використання в якості електрокаталізаторів окислення метанолу композиційних плівок на основі ПАн, допованого полістролсульфонат-аніонами (ПСС) та нанорозмірної платини, дозволяє суттєво підвищити електрокаталітичну ефективність таких матеріалів, порівняно з системами на основі ПАн, допованих традиційними допантами, за рахунок однорідного розподілення частинок Pt в полімерній матриці та зростання щільності активних центрів, що забезпечує ПСС. Ми припустили, що введення невеликої кількості ПСС в електроліт при формуванні ППіfib дозволить ввести додатково полімерний допант в плівку, що може забезпечити подальшу більш ефективне розподілення наночастинок платини в полімерній матриці та вищу електрокаталітичну активність такого нанокомпозиційного матеріалу в реакції окислення метанолу.
Електрохімічний синтез ППіfibПСС по аналогії з синтезом плівок ППіfib проводили в потенціостатичному режимі (0,85 В) у водному розчині з рН 6,8, що містив 0,1 М піролу, 0,07 М LiClO4, 0,01 М полістіролсульфокислоти та 0,2 М фосфатний буферний розчин (Na2HPO4 + NaH2PO4). Форма хроноамперограми електросинтезу ППіfibПСС (рис. 1.44а) практично співпадає з наведеною на рис. 1.42а для електросинтезу ППіfib: невелике зниження струмів на самому початку електросинтезу за яким відбувається монотонне зростання струму (біля 30 с, з початку електролізу) – стадія нуклеації, з наступним його виходом на стаціонарний рівень (повільне утворення 1-D нано-


Рисунок 1.44 – (а) хроноамперограма електросинтезу плівки ППіfibПСС (Е=0,85 В) в електроліті 0,1 М піролу, 0,07 М LiClO4, 0,01 М ПССК, 0,2 М ФБР та (б) циклічна вольтамперограма ППіfibПСС в 0,5 М H2SO4; швидкість розгортки потенціалу – 10 мВ/с.
структур ППі). Тобто, наявність в електроліті невеликої кількості полістиролсульфокислоти суттєво не впливає на перебіг електросинтезу і можна очікувати, що в данному випадку утворююється плівка нановолоконної морфології. На рис. 1.44б наведено циклічну вольтамперограму плівки ППіfibПСС, з характерною для ППі відсутністю сильно виражених піків.
Наявність успішного інкорпоруваня в полімерну плівку ПСС-аніонів доведено нами за допомогою ІЧ-спектроскопії. В ІЧ-спектрі ППіfibПСС поряд з характерними смугами поглинання для ППі (при 1558 см-1 (С-С), 1471 см-1 (C-N), 1285-1330 см-1 (δC-Н та δC-N), 1193 см-1 (коливальна мода пірольного кільця) [61]) виявлено смуги в області 928 та 1070 см-1, що відповідають коливанням, які обумовлені наявністю аніонів ПСС, як допантів ППі [133].
Введення наночастинок платини в одержані плівки ППіfibПСС проводили по аналогії з розглянутою вище методикою для ППі та ППіfib. Як видно з наведеної на рис. 1.45а хроноамперограми, відновлення Pt4+ до металевих наночастинок характеризується швидким збільшеням струму (3-4 с) з наступним його виходом на стаціонарний рівень, після чого синтез продовжували приблизно 10 хвилин, до необхідної кількості пропущеного заряду (0,03 Кл). Наведена на рис. 1.45б ЦВА одержаної плівки ППіfibПСС/Pt є


Рисунок 1.45 – (а) хроноамперограма початку електросинтезу плівки ППіfibПСС/Pt (Е=-0,2 В) в електроліті 5мМ H2PtCl6 в 0,1 М H2SO4 та (б) циклічна вольтамперограма ППіfibПСС/Pt в 0,5 М H2SO4; швидкість розгортки потенціалу – 10 мВ/с.
близькою за формою з ЦВА ППіfibПСС (рис. 1.44б) і відрізняється від останньої наявністю явно вираженого широкого анодного піку в області -100 мВ, який може бути обумовлений адсорбцією/десорбцією водню, що утворюється при відновленні протонів електроліту за значних від’ємних потенціалів, на частинках платини, які розподілені в нанокомпозиті [129] і свідчить про ефективне інкорпорування металевих частинок в полімерну матрицю.
На рис. 1.46 наведені ЦВА ППіfibПСС/Pt в кислому електроліті в присутності CH3OH та за його відсутності, що свідчать про ефективний електрокаталіз спирту одержаним гібридним нанокомпозитом. Хоча початок окислення метанолу відбуваєься за тих же потенціалів, що й у випадку плівки ППіfib/Pt (приблизно 0,3 В), але електрокаталітичні струми є на порядок більшими (2,12,3 мА). Піки окислення метанолу мають максимуми при 0,88 В (анодна область) та 0,74 В (катодна область).
Авторами роботи [134] при одержанні плівок ППі/Pt було відзначено, що через кінетичні перешкоди відновлення [PtCl6]2- Pt0 у внутрішніх ділянках плівки полімеру, потенціал відновлення іонів платини зміщується в бік негативних потенціалів (до -0,25 В, відн. НКЕ), порівняно з фактичним потенці-

Рисунок 1.46 – Циклічні вольамперограми композиційної плівки ППіfibПСС/Pt в електролітах: 0,5 М H2SO4 (а) та 0,5 М H2SO4 + 0,5 М СH3ОН (б). Швидкість розгортки потенціалу – 10 мВ/с.
алом відновлення [PtCl6]2- в розчині, який складає приблизно 0,5 В [134]. За такого негативного потенціалу може відбуватися відновлення полімеру в результаті чого аніони-допанти швидко вилучаються з полімерної матриці та разом з аніонами [PtCl6]2- мігрують в бік границі розподілу електрод/електроліт, де й відбувається швидке відновленні комплексних аніонів до нанорозмірних металевих частинок. Тобто нуклеація частинок Pt відбувається переважно спонтанно на поверхні плівки.
Відновлення іонів платини у випадку використання в якості матриці-носія плівок ППіfibПСС, на наш погляд, може відбуватися іншим шляхом. Завдяки великому розміру та малій рухомості ПСС-аніонів, даний допант зберігається в полімерній плівці навіть при від’ємних потенціалах (відновленні полімеру). В цьому випадку, електронейтральність в системі забезпечується не виходом від’ємно зарядженого допанту з ЕПП, а компенсацією його рухливими катіонами електроліту. Тому навіть при від’ємних потенціалах ПСС-аніони можуть сприяти утримці іонів [PtCl6]2- в полімерній матриці за рахунок взаємодії між Pt4+ та -SO3- групами полімерного допанту [132]. В цьому випадку накладання негативного потенціалу може призводити до швидкої генерації частинок Pt довкола ПСС-аніонів та забезпечувати гомогенне розподілення металевих наночастинок в структурі ППіfibПСС/Pt, що, в свою чергу, може покращувати утілізацію платини для окислення метанолу.
Оскільки нанокомпозит ППіfibПСС/Pt виявився ефективним електрокаталізатором в реакції окислення метанолу, цікаво було дослідити його активність щодо іншого спирту, який є не менш перспективним для застосування у паливних елементах – етанолу. Як свідчить наведена на рис. 1.47 ЦВА ППіfibПСС/Pt, в електроліті 0,5 М H2SO4 + 0,5 М С2H5ОН, одержаний нами нанокомпозит виявляє електрокаталітичну активність не тільки в реакції окислення метанолу, а й етанолу, про що свідчать електрокаталітичні струми в анодній та катодній областях ЦВА з максимумами піків при 0,69 та 0,55 В, відповідно. Слід зазначити, що струми окислення етанолу при використанні ППіfibПСС/Pt (біля 0,2 мА) є на порядок нижчими, ніж ті, що зарєєстровані у випадку СH3ОН. В той же час, за однакових потенціалів початку окислення спиртів, ЦВА з електролітом на основі С2H5ОН характеризується піками окислення в більш негативній області потенціалів. Враховуючи дані факти, вивчення систем типу ППіfibПСС/Pt як електрокаталізаторів окислення етанолу можуть бути предметом подальших досліджень.
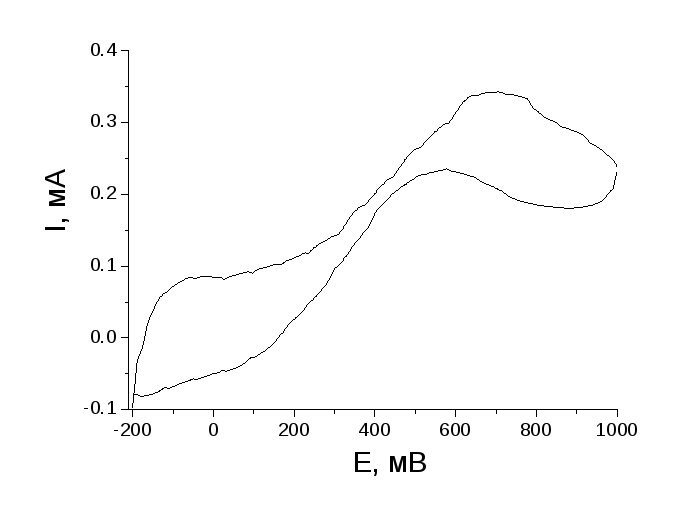
Рисунок 1.47 – ЦВА композиційної плівки ППіfibПСС/Pt в 0,5 М H2SO4 + 0,5 М С2H5ОН. Швидкість розгортки потенціалу – 10 мВ/с.
Таким чином, причинами високої електрокаталітичної активності в реакції відновлення метанолу за участю ППіfibПСС/Pt, на нашу думку, можуть бути нановолоконна морфологія плівки, що забезпечує високу площу поверхні електрокаталізатору; однорідне розподілення наночастинок платини на поверхні та всередині полімерної матриці; можливість стеричної та електростатичної стабілізації наночастинок Pt в композиті сульфогрупами полімерного допанту, що дозволяє запобігти агломерації частинок металу.
Раніш нами було показано [135-138], що гібридні нанокомпозити на основі ЕПП (ПАн, ППі), які доповані гетерополікислотами Кеггіна (ГПК), та оксидів перехідних металів (V2O5 , TiO2, Co3O4) – ЕПП×ГПК/MetxOy, а також їхні аналоги – ЕПП×ГПК/MetxOy/Pt, які містять до 5 мас. % нанорозмірного металу, здатні виступати як електрокаталізатори реакції відновлення кисню і проявляти більш високу електрокаталітичну активність в порівнянні з індивідуальними ЕПП, допованими ГПК. В той же час, нещодавно в науковій літературі з'явились публікації щодо можливості прояву електрокаталітичної активності в реакції окислення метанолу індивідуального ПАн [139], оксидів перехідних металів (TiO2 [140, 141], ZrO2 [142], MoO2 [143], V2O5 [144], SnO2 [140], CeO2 [140]), а також ГПК, зокрема H3PMo12O40 (ФМК) та H3PW12O40 (ФВК) [145], при їхньому використанні як співкаталізаторів з Pt або її сплавами.
Враховуючи викладене ми припустили, що гібридні нанокомпозити ЕПП×ГПК/MetxOy/Pt або ЕПП×ПСС/MetxOy/Pt за рахунок спільної каталітичної дії різних компонент композиту можуть виявляти активність в процесі окислення метанолу при незначному (до 5 мас. %) вмісті платини. Для перевірки даного припущення нами були отримані нанокомпозити на основі ПАн і ППі, нанорозмірного ТіO2, що містять як допант ГПК (ПАн×ФВК/ТіO2, ППі×ФМК/ТіO2) або ПСС (ПАн×ПСС/ТіO2), їхні аналоги, що містять додатково до 5 мас. % Pt (ПАн×ФВК/ТіO2/Pt, ППі×ФМК/ТіO2/Pt та ПАн×ПСС/ТіO2/Pt), а також проведено дослідження їх електрохімічних характеристик та електрокаталітичної активності в РВК.
Нанокомпозити ПАн×ФВК/ТіO2, ППі×ФМК/ТіO2 отримували шляхом окиснювальної полімеризації аніліну або піролу у водно-ацетонітрильному розчині ГПК (ФВК або ФМК), в якому був диспергований комерційно доступний нанорозмірний TiO2. З метою запобігання агломерації наночастинок оксиду на першій стадії синтезу нанокомпозитів проводили ульразвукове диспергування реакційної суміші (~ 1 год.), що містила відповідний мономер, допант та TiO2. Для нанокомпозиту на основі ПАн реакційна суміш – 0,4 мл (4,4 мМ) аніліну та 4,64 г (1,6 мМ) ФВК, 0,114 г (1,4 мМ) TiO2 в 40 мл CH3CN та 30 мл води; для нанокомпозитту на основі ППі – 0,516 мл (7,5 мМ) піролу та 2,73 г (1,5 мМ) ФМК, 0,194 г (2,4 мМ) TiO2 в 40 мл CH3CN та 30 мл води. На другій стадії проводили окислювальну полімеризацію мономера, додаючи при перемішуванні по краплям в реакційну суміш розчину (NH4)2S2O8 (0,79 г (3,5 мМ) в 5 мл води – при одержанні ПАн×ФВК/ТіO2; 3,9 г (17,1 мМ) в 10 мл води – при одержанні ППі×ФМК/ТіO2). За 1,5 (для нанокомпозиту на основі ППі) або 5 год. (для нанокомпозиту на основі ПАн) реакцію зупиняли шляхом виливання реакційної суміші в 120-150 мл етанолу, після чого відповідні композити відфільтровували, промивали водою та етанолом та висушували під динамічним вакуумом.
Нанокомпозит ПАн×ПСС/ТіO2 одержували за наступною методикою. Проводили ультразвукове диспергування реакційної суміші (~ 1 год.), що містила 0,4 мл (4,4 мМ) аніліну 0,114 г (1,4 мМ) TiO2 в 70 мл 1М HCl, після чого здійснювали окислювальну полімеризацію аніліну, додаючи при перемішуванні по краплям в реакційну суміш розчин 0,79 г (3,5 мМ) (NH4)2S2O8 в 5 мл води. Після 3 год. відфільтровували композит ПАн×HCl/ТіO2, промивали його водою та висушували при 90С. Далі проводили дедопування нанокомпозиту ПАн×HCl/ТіO2 до ПАн/ТіO2 перемішуванням його в надлишку 0,1 М NH4OH з подальшим редопуванням ПАн/ТіO2 до ПАн×ПСС/ТіO2 надлишком 0,1 М розчину полістиролсульфокислоти. За ~ 1 год. нанокомпозит ПАн×ПСС/ТіO2 відфільтровували, промивали водою та висушували під динамічним вакуумом.
Для одержання біфункціональних нанокомпозитів ПАн×ФВК/ТіO2/Pt, ППі×ФМК/ТіO2/Pt та ПАн×ПСС/ТіO2/Pt, синтезовані нанокомпозити ПАн×ФВК/ТіO2, ППі×ФМК/ТіO2 та ПАн×ПСС/ТіO2 просочували водним розчином H2PtCl6 (із розрахунку вмісту платини в кінцевому композиті 5 мас. %) з наступним висушуванням зразків при 90°С, після чого проводили відновлення іонів платини до нанорозмірного металу (по аналогії з методикою, що наведена в [144]) шляхом інтенсивного перемішування композиту в 50 мл 30% розчину формаліну. Перемішування проводили при температурі 80 °С протягом 1,5 год. Далі нанокомпозити з нанесеною платиною відфільтровували, промивали водою та етанолом, висушували на повітрі при 90°С та під динамічним вакуумом при кімнатній температурі.
Як видно з наведеної на рис. 1.48а мікрофотографії, що одержана за допомогою методу трансмісійної електронної мікроскопії (ТЕМ), вихідні наночастинки TiO2 є голкоподібними із середнім розміром (діаметр:довжина) ~10:40 нм. В одержаних нанокомпозитах електропровідні ПАн або ППі “обгортають” достатньо агреговані наночастинки оксидів, утворюючи гібридні агломерати (рис. 1.48б,в), причому у випадку біфункціональних нанокомпозитів, на мікрофотографії спостерігаються ізольовані наночастинки металу розміром 2-4 нм (рис. 1.48 в).
Рентгенівські дифрактограми порошкоподібних зразків нанокомпозитів були отримані на дифрактометрі D8 ADVANCE (Bruker) для 2 10 з використанням фільтрованого Cu-випромінювання ( = 0,154 нм), при цьому точність визначення міжплощинних відстаней складала 0,1 Å. Типові дифрактограми для нанорозмірного ТіО2 (рутил), та нанокомпозитів ПАнФВК/ТіО2 і ПАнФВК/ТіО2/Pt наведено на рис. 1.49. Дифрактограми всіх синтезованих нанокомпозитів включають піки, що обумовлені відбиваннями
