
- •Розділ 1 Наукова частина
- •1.1. Огляд літератури
- •1.1.1. Електрохімічне одержання електропровідних поліаніліну та поліпіролу та їх редокс-властивості
- •1.1.2. Метанол та його використання в паливних елементах.
- •1.1.3 Використання композитів на основі електропровідних полімерів та благородних металів як електрокаталізаторів окиснення спиртів
- •1.1.4 . Одержання графену то його композитів. Їх застосування як електрокаталізаторів в паливних елементах.
1.1.3 Використання композитів на основі електропровідних полімерів та благородних металів як електрокаталізаторів окиснення спиртів
Останнім часом все більший розвиток отримують низькотемпературні паливні елементи, в яких в якості палива застосовуються прості органічні сполуки (спирти, кислоти, ефіри). Вивчаються особливості окислення низькомолекулярних спиртів і диолів на Pt/C каталізаторах, синтезованих методом електрохімічного руйнування платини в лужних розчинах під дією змінного струму(далі АС). Ренгенофазовий аналіз, сканування і мікроскопія, що просвічує, показали, що платина в каталізаторі представлена в основному частками кубічної форми і, отже, переважаючою кристалографічною орієнтацією є Pt(100). Середній розмір часток складає 10-12 нм.[16]
Електрокаталітичні властивості АС досліджувалися методами ЦВА, хроновольт- і хроноамперометрії. Швидкості окислення усіх досліджених з'єднань близькі, тоді як на Pt/Pt- електроді метанол окислюється істотно(до 2-х разів) швидше, ніж етанол і эти-ленгликоль. Слід зазначити також нижчі в порівнянні з Pt/Pt потенціали початку окислення етилгліколя на АС, а також меншу отруюваність АС продуктами хемосорбції спиртів.
 Таким
чином, каталізатори, синтезовані методом
электрохімічного руйнування платини,
найбільш ефективні при оксидному
з'єднанні, що містять два атоми вуглецю
і можуть бути рекомендовані до використання
як аноди для низькотемпературних ТЕ.[17]
Таким
чином, каталізатори, синтезовані методом
электрохімічного руйнування платини,
найбільш ефективні при оксидному
з'єднанні, що містять два атоми вуглецю
і можуть бути рекомендовані до використання
як аноди для низькотемпературних ТЕ.[17]
Толерантність катодних каталізаторів по відношенню до метанолу може бути забезпечена в тому випадку, якщо протікання стадій адсорбції і дегідратації спирту ускладнено. Тому PtМ системи з базовими металами М навряд чи проявлятимуть помітну толерантність після формування coreshell структури і збагачення поверхні Pt. Як правило, позитивні результати, опубліковані в, отримані в складі ТЕ прямого окислення метанолу при використанні таких систем, обумовлені загальним підвищенням активності катода.
Великий інтерес представляють неплатинові катодні електрокаталізатори, призначені для використання в ТЕ прямого окислення метанолу.
Інтенсивні дослідження були проведені для систем Мо6-yМyХ8, де Х - S, Se і Ті. Подальші дослідження показали, що простіший і активною системою є RuxSey/С[18]. Швидкість відновлення молекулярного кисню на цьому електрокатализаторі в 7-8 разів нижче в порівнянні з Pt[19]. У присутності метанолу в концентрації 0,2-0,5 М швидкості кисневої реакції на моноплатиновому каталізаторі і RuSe- системі виявляються близькими.[20]
 Інший
підхід до поліпшення каталітичної
взаємодії
в прямих
паливних елементах
заснований
на електронній
провідності
полімерної підкладки. Численні
переваги
полімера
передбачають його використання як
носія.
Ось деякі з них: підвищення дисперсії
наночастинок, чудова фізико-хімічна
стабільність в порівнянні з вуглецем,
потенційно корисна електронна взаємодія
з каталізатором, і поверхневі властивості
полімеру сприяють кращому транспорту
і адсорбції активних форм.
Інший
підхід до поліпшення каталітичної
взаємодії
в прямих
паливних елементах
заснований
на електронній
провідності
полімерної підкладки. Численні
переваги
полімера
передбачають його використання як
носія.
Ось деякі з них: підвищення дисперсії
наночастинок, чудова фізико-хімічна
стабільність в порівнянні з вуглецем,
потенційно корисна електронна взаємодія
з каталізатором, і поверхневі властивості
полімеру сприяють кращому транспорту
і адсорбції активних форм.
В якості анода прямого паливного елемента, поліанілін (Пан) був першим дослідженим полімером, через його простий синтез електрополімеризації аніліну [314]. Hable і Wrighton вперше провели великі дослідження з електроокислення CH3OH C2H5OH на PtRu / ПАН і PtSn / ПАН електродах [315]. Частинки каталізатора (діаметром 300-500 нм і масою 0,25-1 мг см-2), були включені в полімерну матрицю методом циклічного осадження на Пан-GC. Електрокаталітична активність до електроокислення спиртів була виявлена тільки в межі електронної провідності Пан, тобто для потенціалів вище 0 ~ V відносно каломельного електроду порівняння, коли Пан знаходиться в стані емеральдіну. Інакше питомий опір полімерної плівки перешкоджає електрохімічному окисленню. PtSn був найактивнішим по відношенню до окислення етанолу, в той час як для метанолу - PtRu і PtSn дали ідентичні результати. Накопичення проміжних видів, таких як ацетальдегід і формальдегіду в матриці Пан, дає загрозу довгострокової електронної провідності Пан, що знижує його продуктивність [315].
В іншому
дослідженні показано, що при порівнянні
електроосадженої Pt безпосередньо на
склографіт та електроосадженої Pt на
Пан-модифікований склографіт, останній
дав незмінно більшу густину струму
окислення метанолу при 0,5 V відносно
каломельного електроду порівняння
[316, 317а]. Роль морфології Пан було також
досліджено. Доведено, що гранульована
форма полімеру, отримана електрополімеризацією
в H2SO4 або HNO3, є кращою, оскільки в той же
самій кількість каталізатор Pt дала
близько шести разів вищі поверхневі
густини струму окисленням метанолу в
порівнянні з волокнистими Пан, отриманими
в  HBF4
або HClO4 [317a]. Ці результати були віднесені
до площі поверхні електродів і зробленні
висновки щодо дисперсії каталізатора
в Пан. Однак інші дослідники повідомили,
що волокниста морфологія Пан (діаметр
70-100 нм), вироблена методом гальваностатичного
імпульсу є кращою в порівнянні з
гранульованою морфологією, яку отримують
шляхом звичайної гальваностатичної
електрополімеризації [317b].
HBF4
або HClO4 [317a]. Ці результати були віднесені
до площі поверхні електродів і зробленні
висновки щодо дисперсії каталізатора
в Пан. Однак інші дослідники повідомили,
що волокниста морфологія Пан (діаметр
70-100 нм), вироблена методом гальваностатичного
імпульсу є кращою в порівнянні з
гранульованою морфологією, яку отримують
шляхом звичайної гальваностатичної
електрополімеризації [317b].
Дослідниками було встановлено істинний каталітичний ефект Pt / Пан шляхом оцінки розміру часток і площі поверхні каталізатора і відповідної нормалізації поточного окисленням метанолу (званий специфічної або внутрішньої електрокаталітичної активності) [318]. Постійний потенціал (0,05 В відносно водневого електрода порівняння) електроосадження Pt на Пан на обертовому дисковому електроді в різний час осадження видає широкий діапазон розмірів часток (від 2 до 850 нм) і питомої поверхні. Наприклад, при навантаженні 750 мкг/см2 утворюються досить суцільні плівки Pt на поверхні Пан, що складається з великих агломератів ~ 150-850 нм в діаметрі. Відповідна питома площа поверхні (визначаються відповідно потенціалу адсорбції / десорбції водню) була тільки близько 10 м2/г [318]. З іншого боку, для більш низьких навантажень (нижче 60 мкг/см2) були отримані майже монодисперсні частинки 2-5 нм в діаметрі з питомою поверхнею до 24 м2/г.
Слід підкреслити, що аналогічні результати були отримані з диспергованою Pt у Nafion ® плівки [318], що вказує на те, що наночастинки Pt в полімерних матрицях, більш електролітично активні, ніж Pt / Pt.
Крім
того, внутрішня активність некаталітичного
Пан для окислення метанолу також повинна
бути розглянута. Несподівано було
повідомлено, що сам Пан нанесений на
підкладку Pt підвищив від 50% до 320% пік
густини струму окиснення метанолу в
порівнянні з чистим Pt при концентрації
метанолу від 2 до 10 М в 0,5 М H2SO4 [319]. Однак,
при концентрації нижче 1 М, Пан був
неактивним до окисленням метанолу. Інші
 дослідники
дослідники
 цей
цей
 ефект
заперечили і повідомили про неактивність
Пан до окисленням метанолу [320, 321].
Потрібні додаткові дослідження в цій
області, оскільки до цих пір не
запропоновано ніякого пояснення щодо
своєрідної властивості Пан до окислення
метанолу при високій концентрації
[319].
ефект
заперечили і повідомили про неактивність
Пан до окисленням метанолу [320, 321].
Потрібні додаткові дослідження в цій
області, оскільки до цих пір не
запропоновано ніякого пояснення щодо
своєрідної властивості Пан до окислення
метанолу при високій концентрації
[319].
Інші дослідження також підтвердили каталітичну активність Pt/Пан композитів для окислення невеликих органічних молекул, що мають відношення до паливних елементів. Раджеш і співавт. підготували цікавий шар каталізатора, що складався з Pt/Пан-V2O5 після чого полімер був підданий однорідній полімеризації [322]. V2O5 виступив в якості окислювально-відновного каталізатора для полімеризації, утворюючи V4 +, в якості хоста для інтеркаляції Пан у своїй шаруватій структурі. В стехіометрії композитний носій мав вигляд (C6H4NH) 0.41V2O5 • 0.5H2O.
Новий
композитний носій викликав значне
збільшення поверхневої густини струму
окислення метанолу при однаковій
кількість каталізатора Pt (рис. 1.2 (а)).
Крім того, було покращено довгострокову
каталітичну активність Pt з композитним
носієм Пан-V2O5 (рис. 1.2 (б)).
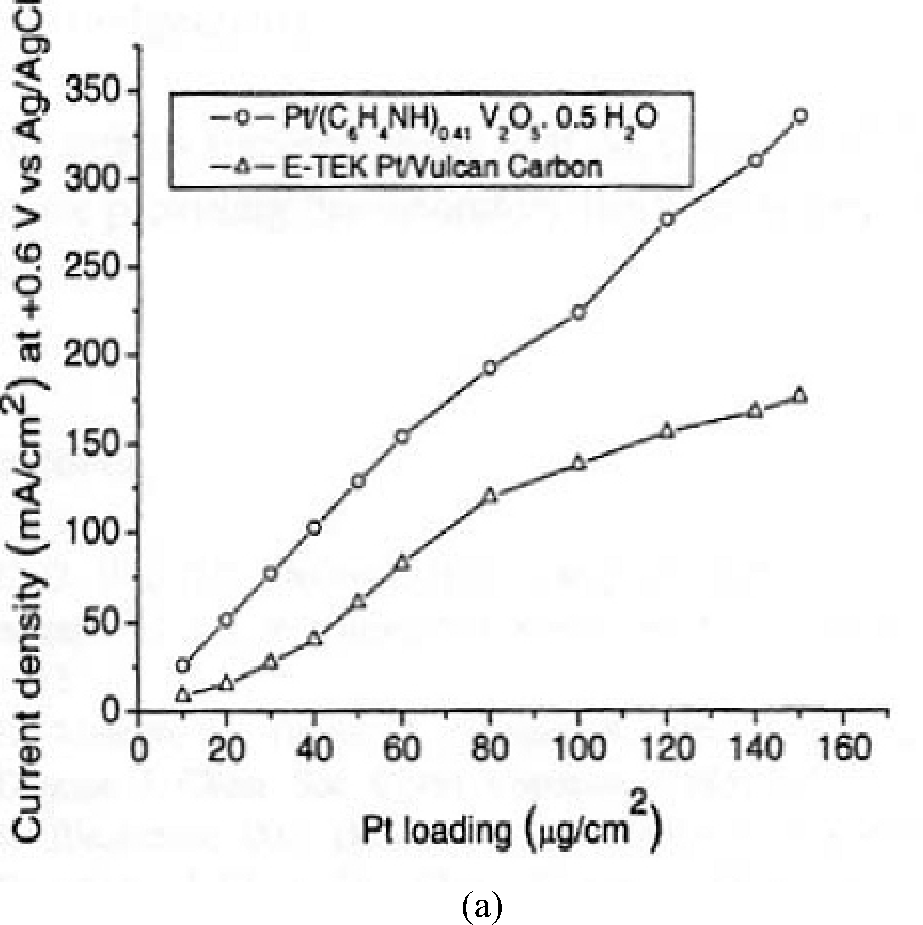

Рис1.2 Ефект каталізатора Пан-V2O5 і Вулкан на поверхневих густинах струму (тобто в геометричній площі електрода) для окислення метанолу на Pt. 1 М СН3ОН - 1 М H2SO4 [322]. (А) порівняння в залежності від концентрації Pt, (б) в залежності від часу при постійній концентрації Pt 120 мкг/см2.)
Науковцями був розглянутий вплив HxMoO3 на електрокаталітичні властивості композитів на основі Пан. Включення HxMoO3 в якості співкаталізатора Pt в матриці Пан відбувається шляхом електроосадження. Після чого композити досліджували на електроокислення метанолу, мурашиної кислоти і формальдегіду [323]. На додаток до підвищення площі поверхні пов'язаної зі збільшенням густини струму окислення для трьох молекул C1, для Pt/Пан і Pt-HxMoO3/Пан підтвердився каталітичний ефект. Рис 1.3 ілюструє випадок окислення мурашиної кислоти. У порівнянні з Pt / Pt, наявність Пан призвела до збільшення пікового струму в прямому скануванні в 0,3 і 0,6 В, з наступним вираженим розширенням хвилі окислення на зворотному скануванні. Наявність HxMoO3 в композиції каталізатора збільшило швидкість електроокислення мурашиної кислоти, особливо в області низьких потенціалів прямого сканування, між 0 і 0,5 В (рис. 1.3), в той час як на зворотному стрілоподібна хвиля окислення була близька до Pt/Пан.

Рис 1.3
Ефект Пан і HxMoO3 як співкаталізатора на
окислення мурашиної кислоти на Pt. 1) Pt /
Pt, 2) Pt / Пан, і 3) Pt-HxMoO3/Пан. 0,1 М HCOOH - 0,5 М
H2SO4, 100 мВ/с[323]
Поліпіррол
(PPY) в якості підкладки також привертає
значну увагу як каталізатор анода в
прямих рідких паливних елементах.
Описаний спосіб для отримання нанотрубок
PPY зовнішнього діаметру 200 нм за допомогою
електрополімеризації на мембрані-шаблоні
оксиду алюмінію нанесеного на вуглецеву
тканину [330]. Згодом Pt була гальваностатичного
електролітично введена всередину
нанотрубок PPY, і було показано за допомогою
вольтамперометрії, що нанотрубки PPY
такої морфології індукують до трьох
разів швидше і вища густина струму
окислення метанолу в порівнянні зі
звичайним PPY; останній був менш ефективним,
так як щільні агломерати кристалітів
Pt сформовані на її поверхні роблять
більш низькою електрохімічно доступну
площу поверхні. Також шаблонний метод
синтезу був застосований для отримання
полі-3-метілтіофен (ПМТ) з конусоподібною
морфологією [331]. Цікаво, що без шаблонів
, ПMT-ова основа дала гіршу активність,
ніж вуглецевий носій (див. GC/20% Pt / C від
E-ТЕК, Малюнок 1.4). Таким чином, спеціальна
морфологія основи є ключовим для
забезпечення високого коефіцієнта
використання каталізатора Pt.

Рис 1.4
Вплив ПMT на окисленням метанолу, при
сталій концентрації Pt 80 мкг/см2. (1М СН3ОН
- 1М H2SO4; 0,6 V, 298 К) [331]. Легенда: CC/Naf/ПMTtemp-Pt:
вуглецева тканина вкрита нафіоном з
ПMT отриманого  з
шаблона (тобто конусоподібна морфологія);
CC/Naf/PMT-Pt:
так само, але без морфології; GC/20% Pt/C:
комерційний (E-ТЕК) каталізатор.
з
шаблона (тобто конусоподібна морфологія);
CC/Naf/PMT-Pt:
так само, але без морфології; GC/20% Pt/C:
комерційний (E-ТЕК) каталізатор.
При In situ полімеризації піролу в присутності багатостінних вуглецевих нанотрубок (MWCNT) отримують PPY-MWCNT композитний носій з наночастиноками Pt і PtPd від 2 до 5 нм [332]. Отриману каталітичну систему оцінювали на активність по відношенню до електроокислення мурашиної кислоти. Наявність Pd в каталізаторі змістили початок окислювального потенціалу HCOOH до більш негативних значень, починалось окислення близько 0,2 V відносно водневого електроду. Було запропоновано, що Pd сприяє прямому окисленню мурашиної кислоти, і тому він менш схильний до отруєння СО [332]. Схожі композити з Pt і PtRu також були використані для каталізу окислення метанолу [333]. Кулеша та ін. показали, що PtRu також можуть бути включені в полі-N-метилпіролілові (Пмп) матриці у вигляді просторово дисперсних Pt і Ru (III, IV)-оксо структур [334]. Останні були введені на стадії електрополімеризації, коли позитивний заряд полімеру врівноважує аніонні домішки - Ru (III, IV) оксид/ціанорутенати. Pt структури були сформовані при електровідновленні H2PtCl6 (0,012 М в 0,5 М H2SO4) з потенціалом на циклуванні в діапазоні від 0,8 до -0,3 V відносно водневого електрода.
Також використовувався розклад етиленгліколю за допомогою мікрохвильової печі (при 436 К) для того, щоб синтезувати наночастинки PtRu і включити їх в полімерну матрицю поліпіролу-ді(2-етилгексил) сульфосукцинат (PPyDEHS). Рис. 1.5 показує відмінності дисперсії наночастинок на полімерній підкладці [335]. Крім того полімер служив в якості колоїдного стабілізатору під час синтезу наночасток. Попередні криві поляризації окиснення метанолу показали досить хорошу активність для таких каталітичних систем, даючи Pt питому масову густину струму 20 А/г на 0,4 V. Необхідні подальші дослідження, щоб перевірити довгострокову стабільність і можливість використання PtRu/PPyDEHS системи для DMFC анодів.

Рис. 1.5 Мікрофотографія наночастинок PtRu включених в полімер PPyDEHS
 Що
стосується поліпірролу, Юттнер і
співробітники порівнювали три різні
методи підготовки:
Що
стосується поліпірролу, Юттнер і
співробітники порівнювали три різні
методи підготовки:
I) Pt потенціостатично наносили на попередньо синтезовані PPY плівки;
II), Pt наносили на PPY плівку одночасно з електрополімеризацією плівки;
III) Одночасна процедура осадження Pt/PPY, але зразок піддавали після осадження, електрохімічній обробці, щоб видалити хлорид-іони з композиту, які залишились від платинової кислоти [336].
Розміри кристалітів Pt для всіх трьох видів осадження були досить великими, в діапазоні 0,1-0,4 мкм в залежності від концентрації. Цікаво, що при 298 К зразки II) і III) не показали електрокаталітичної активності до окислення метанолу, навіть якщо товщина плівки була зменшена до 0,1 мкм. Тільки зразок (I) (отриманий осадженням Pt на синтезований PPY) мав активність. Крім того, чим більший негативний потенціал осадження Pt тим вище густина струму окислення метанолу для Pt/PPY (I). Важливим результатом цієї роботи стала підвищена стабільність Pt на PPY (I) в порівнянні з GC [336]. Протягом ~ 10-20 хвилин окислення, така каталітична система дала більш високі густини струму окислення метанолу, ніж Pt/GC при 0,5 V, в 1 М СН3ОН - 0,5 М H2SO4. Оскільки частинки Pt, отримані на GC були більше, ніж на PPY (I), (1-2 мкм порівняно з 0,4 мкм). Отриманий довгостроковий ефект було пояснено на основі вищої електрохімічноактивної поверхні і, можливо, більш тонкого шару підтримки каталізатора, що покращило взаємодію електронних процесів.
Полі-3-метілтіофен (P3MT) отримували електрополімеризацією на графіті і використовували в якості опори Pt і PtRu каталізатора для окислення мурашиної кислоти [337]. У хроноамперометричному експерименті через 300 с при постійному потенціалі 0,8 В, каталізатор Pt на P3MT/графіт дала на порядок вищу густину струму окислення НСООН в порівнянні з голим полімером на графіті. При подальшому вдосконаленні окислення HCOOH було включено в невеликій кількості Pb на Pt/P3MT/графіт [337]. Співкаталітичний ефект Pb видав близько трьохкратне збільшення густини струму окислення HCOOH. Перспективні фундаментальні дослідження з використанням P3MT як основи, повинні бути проведені в експериментах з паливними елементами, в яких вдосконалення процесу масообміну, кінетики електрода, і електронної провідності буде відігравати важливу роль.
