
- •Федеральное агентство по образованию
- •1.Краткие теоретические сведения
- •1.1.Микросостояние. Вероятность. Средние значения
- •1.2. Распределение Максвелла
- •1.3.Распределение молекул по модулям скорости
- •1.6. Распределение молекул по энергиям
- •2. Описание экспериментальной установки и методики измерений
- •3. Порядок выполнения работы
- •4. Требования к оформлению отчета
- •5. Контрольные вопросы
- •6.Список литературы
1.2. Распределение Максвелла
 Закон
распределения по скоростям молекул
газа, находящегося в термодинамическом
равновесии, был найден Максвеллом
(1859).
Закон
распределения по скоростям молекул
газа, находящегося в термодинамическом
равновесии, был найден Максвеллом
(1859).
Представим
себе пространство скоростей с
прямоугольными координатными осями,
по которым будем откладывать значения
проекций
![]() отдельных
молекул. Тогда скорости каждой
молекулы будет соответствовать точка
в этом пространстве — конец вектора
отдельных
молекул. Тогда скорости каждой
молекулы будет соответствовать точка
в этом пространстве — конец вектора
![]() .
Из-за
столкновений молекул положения
точек будут стремительно меняться, но
их распределение в целом будет оставаться
неизменным, поскольку макросистема
находится в термодинамическом
равновесии.
.
Из-за
столкновений молекул положения
точек будут стремительно меняться, но
их распределение в целом будет оставаться
неизменным, поскольку макросистема
находится в термодинамическом
равновесии.
Вследствие
равноправности всех направлений
движения
расположение точек относительно
начала координат будет сферически
симметричным. Поэтому плотность точек
может зависеть
только от модуля скорости
![]() (но не от
(но не от![]() ).
).
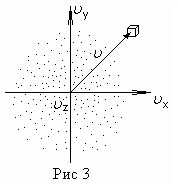
![]() —
малый объем
—
малый объем![]() (рис. 3, где ось
(рис. 3, где ось
![]() направлена
на нас). Относительное число точек
(молекул) в этом объеме, или другими
словами,
вероятность
dw
того, что скорость
молекулы,
т.е. конец
вектора
направлена
на нас). Относительное число точек
(молекул) в этом объеме, или другими
словами,
вероятность
dw
того, что скорость
молекулы,
т.е. конец
вектора
![]() ,
попадет в этот объем, можно
записать так:
,
попадет в этот объем, можно
записать так:
![]() ,
(2)
,
(2)
г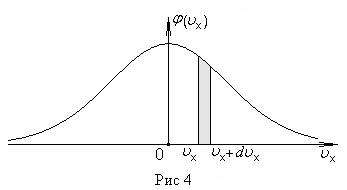 де
де![]() имеет
смысл объемной плотности вероятности.
Вероятность
же того, что молекула (точка) будет иметь
проекции скорости в
интервале
(
имеет
смысл объемной плотности вероятности.
Вероятность
же того, что молекула (точка) будет иметь
проекции скорости в
интервале
(![]() ),
равна
отношению
),
равна
отношению
![]() ,
(3)
,
(3)
где
![]() —
функция распределения по
—
функция распределения по![]() .
Выражение
(3) — это по существу интеграл (2) по
.
Выражение
(3) — это по существу интеграл (2) по
![]() и
и![]() ,
т.е. относительное
число молекул (точек) в тонком плоском
слое от
,
т.е. относительное
число молекул (точек) в тонком плоском
слое от
![]() до
до![]() +d
+d![]() .
Вероятности того,
что молекула имеет проекции скорости
в интервалах (
.
Вероятности того,
что молекула имеет проекции скорости
в интервалах (![]() ,
,![]() +d
+d![]() ),
(
),
(![]() и
(
и
(![]() )
являются независимыми, поэтому в
соответствии с теоремой об умножения
вероятностей независимых событий можно
записать
)
являются независимыми, поэтому в
соответствии с теоремой об умножения
вероятностей независимых событий можно
записать
![]() (4)
(4)
Из соображения
равноправия осей
![]() ,
,![]() и
и![]() ясно, что функцииφ
должны
одинаковым образом зависеть от
соответствующих проекций
скоростей. Сопоставив (4) с (2), находим
ясно, что функцииφ
должны
одинаковым образом зависеть от
соответствующих проекций
скоростей. Сопоставив (4) с (2), находим
![]() .
(5)
.
(5)
После преобразований (с учетом условия нормировки) получаем
![]() ,
,
аналогичный вид
имеют функции
![]() и
и![]() .
И тогда согласно (5)
.
И тогда согласно (5)![]()
(![]() . (6)
. (6)
График функции
![]() изображен
на рис. 4. Он совпадает с гауссовой
кривой погрешностей. Площадь
тонированной полоски на рис. 4 — это
вероятность того, что проекция скорости
молекулы лежит в интервале (
изображен
на рис. 4. Он совпадает с гауссовой
кривой погрешностей. Площадь
тонированной полоски на рис. 4 — это
вероятность того, что проекция скорости
молекулы лежит в интервале (![]() ,
,![]() +d
+d![]() ).
Функция (6) нормирована на единицу, т.е.
площадь под кривой
).
Функция (6) нормирована на единицу, т.е.
площадь под кривой![]() равна
равна![]()
Интегрирование в пределах от -∞ до +∞ не означает, что в газе есть молекулы с такими большими скоростями. Это следует рассматривать только как вычислительный прием. Молекул с весьма большими скоростями очень мало, и они практически не вносят никакого вклада в нормировочный интеграл. Это и позволяет записывать такие пределы.
1.3.Распределение молекул по модулям скорости
 Найдем вероятность
или относительное число молекул,
модуль скорости которых заключен в
интервале (
Найдем вероятность
или относительное число молекул,
модуль скорости которых заключен в
интервале (![]() ).
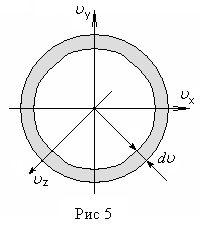
Таким молекулам соответствуют все
точки, попадающие в шаровой слой с
радиусами
).
Таким молекулам соответствуют все
точки, попадающие в шаровой слой с
радиусами
![]() и
и
![]() (рис. 5). Объем этого слоя равен произведению
поверхности слоя на его толщину, т.е.
(рис. 5). Объем этого слоя равен произведению
поверхности слоя на его толщину, т.е.![]() ,
объемная же плотность вероятности
,
объемная же плотность вероятности![]() во всех точках слоя одинакова.
Следовательно, согласно теореме сложения
вероятностей, вероятность попадания
в этот слой
во всех точках слоя одинакова.
Следовательно, согласно теореме сложения
вероятностей, вероятность попадания
в этот слой
![]() .
.
В еличина
еличина
![]() характеризует искомую вероятность,
т.е.
характеризует искомую вероятность,
т.е.![]() .
Учитывая (6), получим:
.
Учитывая (6), получим:
![]() .
(7)
.
(7)
Эта
формула представляет собой закон
распределения Максвелла по модулю
скорости. Вид функции
![]() показан на рис. 6. Эта функция
тоже нормирована на единицу,
показан на рис. 6. Эта функция
тоже нормирована на единицу,
![]() .
.
На рис.6
пунктиром представлена “конструкция”
(сомножители) функции
![]() ,
один из сомножителей
которой
,
один из сомножителей
которой
![]() .
Заметим, что в отличие от
.
Заметим, что в отличие от
![]() площадь под кривой
площадь под кривой
![]() физического смысла не имеет.
физического смысла не имеет.
Полученные Максвеллом распределения по скоростям не зависят ни от структуры молекул, ни от того, как они взаимодействуют друг с другом. Поэтому они применимы не только к газам, но и к другим агрегатным состояниям вещества.
Рассмотрим
характерные
скорости.
К ним относятся три скорости: наиболее
вероятная
![]() ,
средняя
,
средняя![]() и среднеквадратичная
и среднеквадратичная![]() .
.
Наиболее
вероятной скорости соответствует
максимум функции распределения
![]() .
Эта скорость определяется из условия
.
Эта скорость определяется из условия
![]() ,
откуда следует
,
откуда следует
![]() .
.
Средняя скорость
по определению равна
![]() .
.
Среднеквадратичная
скорость
![]() ;
она находится из условия
;
она находится из условия
![]()
![]() ,
,
откуда
![]() .
.
Средняя скорость
молекулы азота при Т=300К
равна 480 м/с. Эта величина имеет порядок
скорости звука в азоте,
![]() = 350 м/с. Приведенные характерные скорости
отличаются друг от друга в пропорции
= 350 м/с. Приведенные характерные скорости
отличаются друг от друга в пропорции
![]() = 1 : 1,13 : 1,22.
= 1 : 1,13 : 1,22.
Качественно это показано на рис. 6.
Рассмотрим
зависимость распределения от температуры.
Подставив значение
![]() в формулу (7), получим, что.
в формулу (7), получим, что.![]()
В соответствии
с этим результатом для разных температур
![]() кривые
распределения
кривые
распределения
![]() будут
иметь вид, показанный на рис. 7. Видно,
что с увеличением Т
максимум функции
будут
иметь вид, показанный на рис. 7. Видно,
что с увеличением Т
максимум функции
![]() смещается в сторону больших скоростей,
а его величина уменьшается. При этом
площадь под всеми тремя к
смещается в сторону больших скоростей,
а его величина уменьшается. При этом
площадь под всеми тремя к ривыми
остается равной единице. Кривые на рис.
7 можно рассматривать и иначе — как
соответствующие разным массам молекул
газа при одной и той же температуре,
причем
ривыми
остается равной единице. Кривые на рис.
7 можно рассматривать и иначе — как
соответствующие разным массам молекул
газа при одной и той же температуре,
причем![]() .
.
