
Лекции / organic_2011_4
.pdf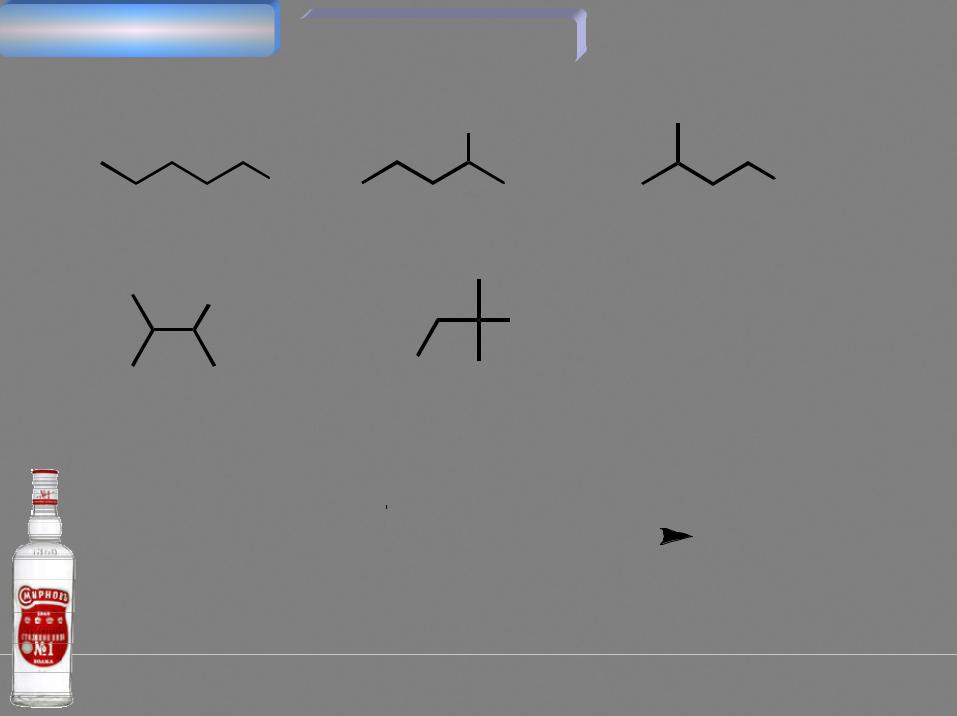
МОДУЛЬ 2 (Часть 2) |
Спирты (карбинолы) |
|
|
|
|
|
1 |
||||||||
|
|
|
|
|
|
||||||||||
Номенклатура – IUPAC (-ол, -гидрокси), карбинольная, тривиальная |
|||||||||||||||
|
|
OH |
|
|
|
OH |
|
|
|
|
|
OH |
|||
|
|
|
|
|
|
|
|
|
|||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
пентанол-2 |
|
|
|
|
|
||||||
пентанол-1 |
|
|
|
3-метилбутанол-1 |
|||||||||||
|
(вторичный амиловый спирт, |
||||||||||||||
(амиловый спирт) |
|
||||||||||||||
|
(изоамиловый спирт) |
||||||||||||||
|
|
|
|
|
метилпропилкапбинол) |
|
|||||||||
|
|
OH |
|
|
|
|
|
|
OH |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
3-метилбутанол-2 |
|
|
|
2-метилбутанол-2 |
|
|
|
|
|
||||||
|
|
(третичный амиловый спирт, |
|
|
|||||||||||
(вторичный изоамиловый спирт, |
|
|
|||||||||||||
диметилэтилкарбинол) |
|
|
|||||||||||||
метилизопропилкарбинол) |
|
|
|
||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
||||
метанол (древесный спирт) |
|
t |
|
|
|||||||||||
1. сухаяперегонка древесины 2. CO + H2 |
|
CH |
OH |
||||||||||||
|
|
|
|
||||||||||||
|
|
|
|
|
|
|
|
|
|
Cr2O3/ZnO |
3 |
|
|||
|
|
|
|
|
|
|
|
|
|
|
|
||||
этанол (этиловый, питьевой спирт)
1. гидратация этилена 2. ферментативные превращенияуглеводов
2
Спирт ректификат - азеотропная (неразделимая перегонкой смесь, имеющая минимальную температуру кипения в системе вода-спирт) 95,5% спирта.
Удаление воды (абсолютирование спирта)
EtOH/H2O |
CaO |
Ca(OH)2 + EtOH |
перегонка |
EtOH/H O |
|||
95,5% |
|
t |
|
|
|
99% |
2 |
|
|
|
|
|
|||
EtOH/H O |
Mg |
Mg(OEt) |
2 |
|
|
|
|
99% |
2 |
t |
|
перегонка |
|
||
|
H2O |
|
EtOH/H O |
||||
|
|
|
|
|
|
||
|
|
|
|
|
|
|
2 |
|
|
|
|
|
|
|
>99,9% |
|
|
|
Mg(OH)2 + EtOH |
|
|
|
|
|
|
перегонка |
тройная азеотропная смесь вода-спирт-бензол, |
||||
EtOH/H2O + C6H6 |
|
состав: 18,5-74,1-7,4, т. кип. 64,86 °С |
|||||
95,5% |
|
|
|
|
|
|
|
Общие методы получения спиртов |
|
|
|
||||
Из алкенов |
|
|
OH |
H3O+ |
1. B H |
|
OH |
|
|
|
|
|
|||
|
|
|
|
|
2 6 |
|
|
|
|
|
|
|
2. H2O2/HO- |
|
|
|
|
|
1. Hg(OAc)2 |
|
|
|
|
|
|
|
2. NaBH4 |
|
|
|
|

3
Из алкилгалогенидов
RX |
HO- |
процесс сопровождается дегидрогалоилированием |
ROH |
||
|
|
и/или перегруппировками (SN1) |
SN1 или SN2
NaOAc
|
H |
O+ |
ROAc |
3 |
ROH гидролиз сложного эфира - минимум побочных реакций |
(HO-, H2O)
С использованием металлоорганических (Mg, Li) соединений
|
|
|
|
ROH |
|
|
R" |
|
|
|
|||
|
O |
|
O2 |
|
|
O |
|
R" |
|||||
OH |
|
|
|
|
R' R |
||||||||
|
|
|
|||||||||||
|
|
|
|||||||||||
|
|
|
RMgX |
|
|
|
|
OH |
|||||
|
|
|
|
|
|
|
|||||||
|
|
|
|
|
|
|
|||||||
|
|
|
|
|
|
|
|
|
|
||||
R |
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
R' |
|||||
|
|
|
|
|
|
|
|
|
|
|
|||
Восстановление эпоксидов
[Al] |
|
|
OH |
O |
|
|
|
||
O |
|
|
|
1. LiAlH4 |
|
||||
|
1. LiAlH4 |
|
SN2 |
|
Ph |
||||
|
|
|
|
||||||
|
|
|
|
|
Ph |
|
|
2. H2O |
OH |
|
|
|
2. H2O |
|
|
|
|||
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
|||
|
|
[H-] |
|
|
|
|
|
|
|
4
4. Восстановление альдегидов и кетонов
комплексный гидриды металлов - NaBH4, LiAlH4
Al |
|
Al |
|
|
|
O |
LiAlH4 |
|
|
OH |
|
O |
H O |
|
|||
|
|
LiH, NaH - не являются |
|||
|
|
2 |
|
||
R' |
R" |
|
H |
R' |
R" восстановителями! |
H |
Al |
R' |
R" |
|
|
|
|
|
|
гидрирование (H2/катализатор, p, t)
реакция происходит в значительно более жестких условиях, чем гидрирование кратных связей углерод-углерод. Более активен, чем катализаторы гидрирования алкенов для гидрирования карбонильныхсоединений Cr2O3/CuO
Восстановление кетонов в спирты - Мейервейн-Пондорф-Верлей окисление спиртов в карбонильные соединени - Оппенауэр
O |
|
OH |
HO |
R' |
R" |
Al(OCH(CH3)2)3 R' |
R" |
CH3COCH3
Al(OCH(CH3)2)3
O |
|
OH |
HO |
R' |
R" |
Al(OCH(CH3)2)3 R' |
R" |
 OH -Al(OCH(CH3)2)3
OH -Al(OCH(CH3)2)3
i-Pr-O O-i-Pr |
|
|
O-i-Pr |
|||
|
O |
Al |
|
|
|
Al |
|
|
O |
|
O |
O-i-Pr |
|
R' |
|
|
_ |
|||
|
|
|
O |
|
||
R" |
|
H |
|
|
||
|
|
|
R" |
|||
|
|
|
R' |
|||
|
восстановление по Буво |
|
|
|||
|
O |
|
Na |
HO |
|
|
|
|
|
|
|
|
|
R' |
|
R" |
EtOH |
R' |
R" |
|
|
|
|
||||
Восстановление сложных эфиров
RCO2Et |
LiAlH4 |
RCH OH |
|
или Na/EtOH |
|||
|
2 |
5
реакция происходит через общее переходное состояние, обратима, положение равновесие определяется соотношением реагентов
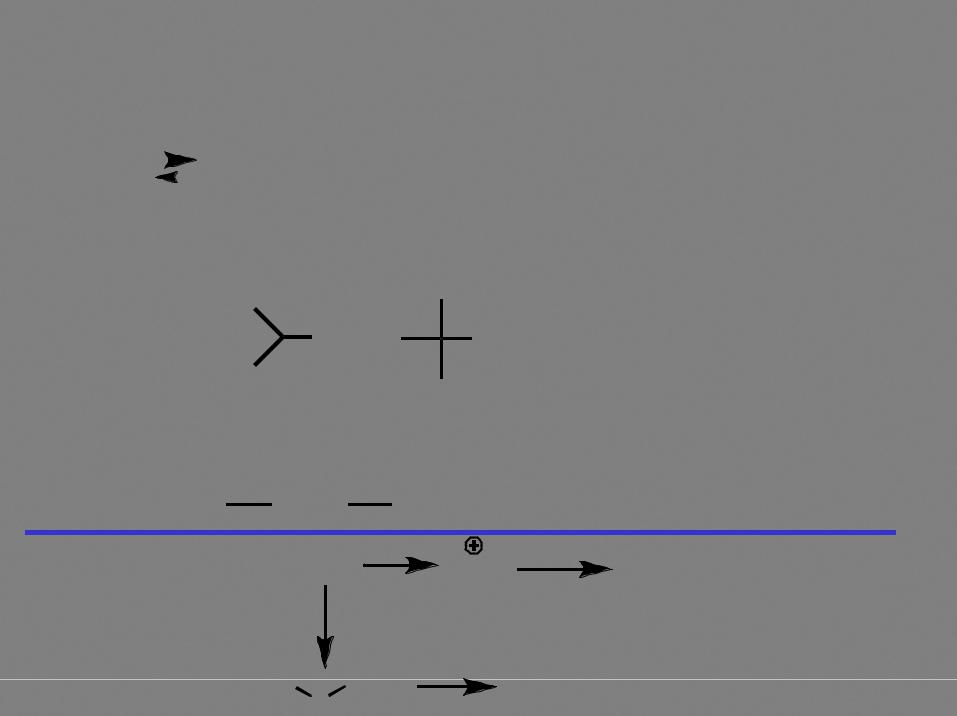
Свойства спиртов |
6 |
1.Наличие подвижного протона – относительно высокая температура кипения, растворимость в воде, кислотность.
|
|
|
|
|
Положение равновесия определяется устойчивостью аниона. |
|
|
|
|
|
Алкил - донор по сравнению с протоном, поэтому гидроксид- |
RO- + H2O |
|
|
|
ROH + HO- |
анион устойчивее алкоксид-аниона. Следовательно, вода - |
|
|||||
|
|
|
|
|
более сильная кислота, чем спирты, а алкоксид-анионы - |
|
|
|
|
|
|
|
|
|
|
|
более сильные основания, чем гидроксид-анион. |
основность изменяется в следующем ряду:
HO- < CH3O- < EtO- < |
|
O- |
< |
|
|
O- |
ИКспектр: |
1000-1200 см-1 (С-О) |
|
|
|
|
3400-3600 см-1 (О-Н) |
||||
|
|
|||||||
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|
В спектре ПМР в протонном растворителе сигнал протона О-Н не наблюдается (обмен этого протона с растворителем)
H2 + (RO)2Mg  Mg ROH Na
Mg ROH Na  RONa + H2
RONa + H2
Замещение группы ОН |
ROH |
HX |
|
X- |
|
RX SN1 или реже SN2 |
|
ROH2 - H |
O |
||||
SOCl2 |
|
|
2 |
|
||
|
|
|
|
|
||
R |
O |
SOCl |
Cl- |
RCl |
|
SNi или SN2 (без растворителя) |
|
|
|
|
|
|
|
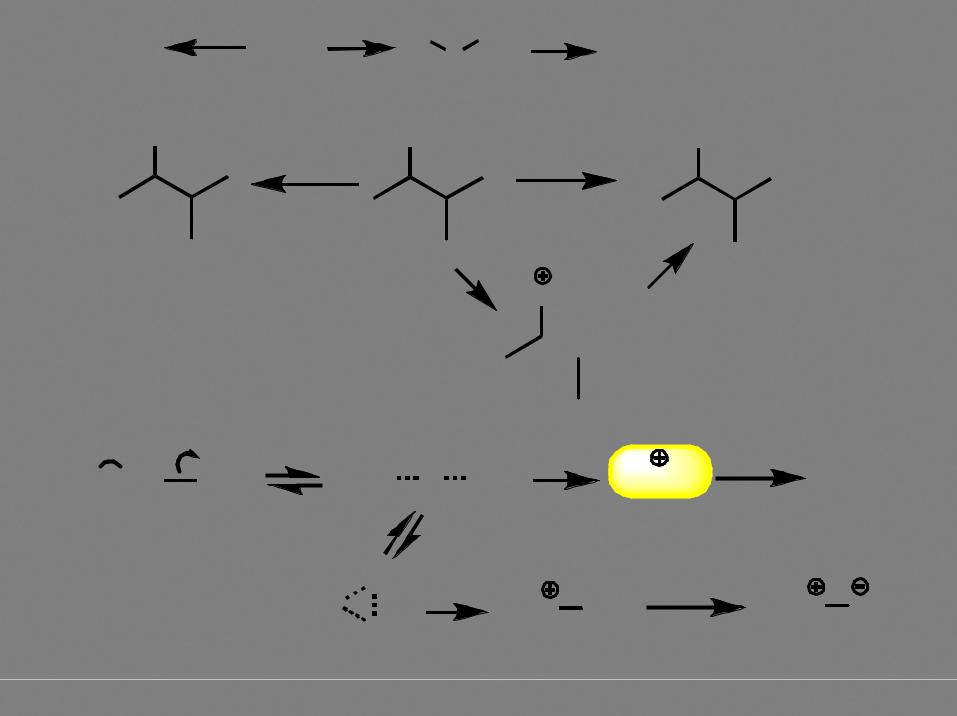
RX CX4
PPh3
Cl
Ph3P
 Cl CCl3
Cl CCl3
ROH |
PX3 R |
PX2 X- |
|
7 |
|
|
RX SN1 или SN2 |
||||
O |
|
|
|||
|
X = Cl, Br |
|
|
|
|
|
OH |
PPh |
.Br |
Br |
|
PPh /CCl |
2 |
||||
3 |
|
||||
3 |
4 |
|
|
|
|
OPPh3 - POPh3
 Br-
Br-
δ+ |
δ- |
|
Ph3POR |
- |
|
Ph P Cl |
CCl |
ROH |
Cl |
RCl |
|
3 |
3 |
- CHCl3 |
Cl- |
- POPh3 |
|
|
|
||||
|
|
- Cl- |
|
|
|
Cl |
|
|
Ph3P |
|
Ph3P CCl2 |
Ph3P |
Ph P CCl |
|
|||
CCl2 |
|
3 |
3 |
|
|
|
Cl- |
- Ph3PCl2 |
илид |
||
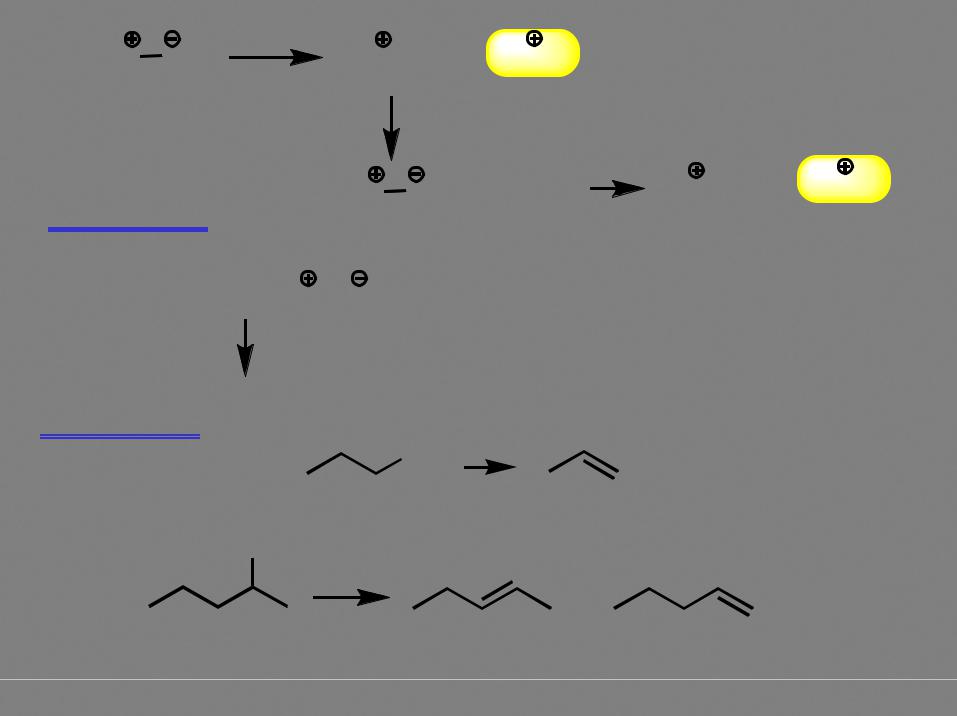
8
ROH |
Ph3PCHCl2 + |
Ph3POR |
Ph3P CCl2 |
||
Ph3PCl2 |
Cl- |
Cl- |
|
Ph3P |
|
TsCl
ROH 
NEt3
Дегидратация
Ph3P
ROTs + NHEtCl
Br-
RBr
OH
H2SO4
t
|
ROH |
Ph3POR |
CHCl + Ph3PCl2 |
Ph3PCH2Cl + |
|
|
Cl- |
Cl- |
 RCl
RCl
OH H+
t (Al2O3, t)
+
4 : 1
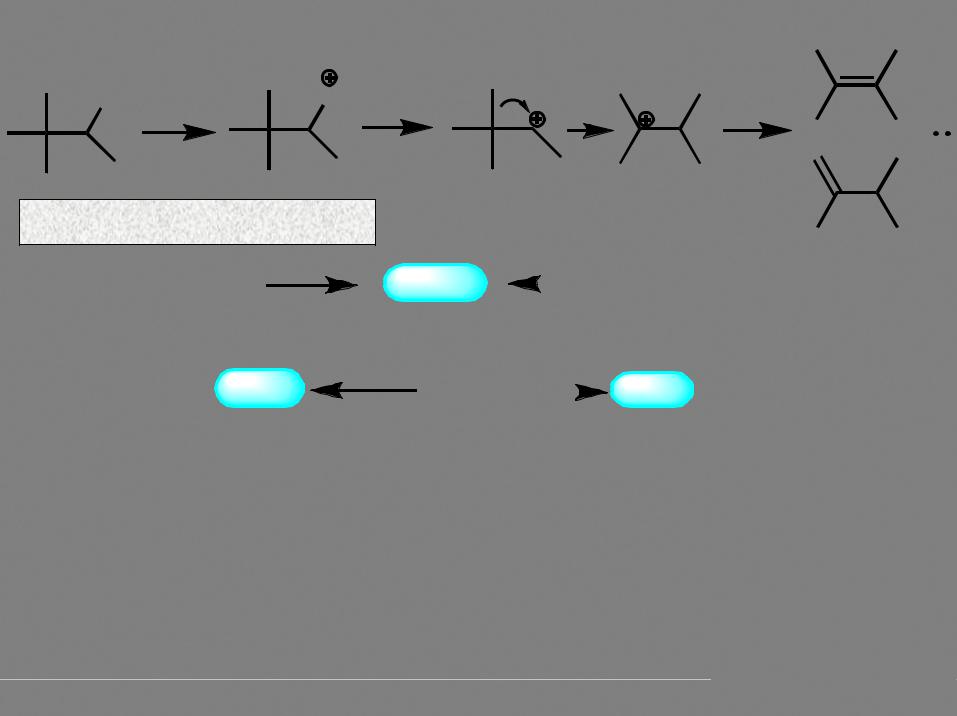
OH H PO |
OH2 |
|
|
|
|
|
3 |
4 |
|
|
|
|
|
t |
|
- H2O |
|
|
|
|
Образование сложных эфиров |
|
|
|
|
||
|
R'COCl |
R'COOR |
R'CO2H |
ROH |
||
ROH |
H+ |
|
||||
|
|
сложные эфиры |
|
|
||
|
|
карбоновых кислот |
|
|
||
эфиры азотной |
|
HNO3 |
ROH |
NaNO |
|
|
кислоты - нитраты |
RONO2 |
H2SO4 |
2 |
RONO |
||
H O+ |
||||||
взрывчатые в-ва |
|
|
|
3 |
|
|
|
|
|
|
|
|
|
Вазодилататоры - лекарственные средств, обладающих способностью расширять просвет сосудов за счет понижения тонуса мышц сосудистой стенки.
9
|
4 |
- H+ |
+ |
1 |
эфиры азотистой кислоты - нитриты
(RO)2SO2 |
SO2Cl2 ROH |
HSO3Cl |
H(RO)SO3 |
10 |
диалкилсульфат |
|
|
кислый сульфат |
|
(RO)2CO |
COCl2 |
TsCl |
ROTs тозилаты |
|
NEt3 |
NEt3 |
|
||
карбонаты |
|
|
||
|
|
|
|
(RO)3P
фосфиты
ROH CS2
HO-
PCl |
|
SiCl4 |
|
|
3 |
ROH |
|
Si(OR)4 + другие продукты |
|
NEt3 |
NEt3 |
|||
|
|
O |
S |
CH3I |
O |
S |
R |
|
|
R |
|
|
|
|
|
|
|
S- |
ксантогенаты |
S |
|
|
|
|
||
|
|
O |
N |
O |
|
P |
P |
||
|
|
|||
|
|
|
||
|
|
O |
|
|
|
O |
F |
CN |
|
|
|
|||
|
зарин |
табун |
|
|
|
|
|
||
|
O |
S |
|
|
|
O |
P |
CO2Et |
|
|
S |
|
||
|
|
|
|
|
|
|
|
CO2Et |
|
карбофос
