
Гістон н1
Одна молекула п’ятого гістону – лінкерного гістону Н1 – взаємодіє з кожною нуклеосомою у хроматині. Проте ця взаємодія, на відміну від корових гістонів, є динамічною: спостерігається швидкий обмін лінкерних гістонів між хроматином та їхнім пулом у ядрі.
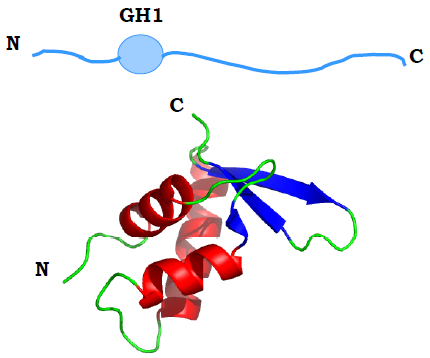
Рис. 14. Схема будови гістону Н1 і структура його глобулярного домену GH1 (1HST, аналог гістону Н1 з еритроцитів птахів, що позначається як Н5).
За своєю структурою гістон Н1 (мономерний білок) суттєво відрізняється від корових гістонів (рис. 14). Молекула Н1 містить N-кінцевий невпорядкований хвіст, глобулярний домен GH1 і довгий, збагачений позитивно зарядженими залишкам (насамперед Lys) С-кінцевий хвіст довжиною приблизно 100 амінокислотних залишків (приблизно половина молекули). Глобулярний домен (приблизно 80 амінокислот) належить до так званої родини спіральних із крильцем (winged helix) ДНК-зв’язувальних білків. На поверхні домену існують два можливі сайти взаємодії з ДНК, які формуються кластерами позитивно заряджених амінокислот і локалізовані на протилежних боках глобули. Відповідно, глобулярний домен взаємодіє з нуклеосомною ДНК на виході з нуклеосоми, імовірно, між двома сусідніми витками (рис. 15, а), додатково стабілізуючи нуклеосомну суперспіраль. С-кінцевий хвіст Н1 взаємодіє з обома лінкерами, що виходять з нуклеосоми. У результаті дві лінкерні ділянки (довжиною по 10 – 30 пар основ) утворюють стеблоподібну структуру на виході з нуклеосоми (рис. 15, б).

Рис. 15. Схема взаємодії глобулярного домену GH1 (а) та цілого гістону Н1 (б) із нуклеосомою.
Наднуклеосомна упаковка хроматинової фібрили
У хроматині нуклеосоми з’єднані лінкерами довжиною ~50 пар основ. Якщо лінкер (у полінуклеосомному ланцюзі без гістону Н1) просто продовжує хід нуклеосомної ДНК по прямій, нуклеосоми у складі полінуклеосомної нитки мають бути розташовані зиґзаґом (рис. 16, а). Саме такий вигляд має декомпактизована (якщо відсутній Н1 і занизької іонної сили) полінуклеосомна фібрила під мікроскопом (електронним чи атомносиловим). Товщина такого зиґзаґу дорівнює приблизно 30 нм. Полінуклеосомний зиґзаґ може конденсуватися (рис. 16, б). Умова конденсації (необхідна, але недостатня) – фізіологічна іонна сила (крім одновалентних мають бути присутніми двовалентні катіони) для зниження електростатичного розштовхування між нуклеосомами. Фактор конденсації (її рушійна сила) – невпорядковані хвости корових гістонів: лабільні позитивно заряджені хвости ефективно зшивають фібрилу, взаємодіючи з ДНК сусідніх нуклеосом.
У присутності гістону Н1 компактна хроматинова фібрила товщиною 30 нм стає значно стабільнішою. Ключова роль у цій стабілізації належить стеблу, що формується унаслідок взаємодії з гістоном Н1 двох лінкерних ділянок на виході з нуклеосоми: за рахунок стебла сусідні нуклеосоми значно зближуються, що сприяє конденсації (рис. 17). Отже, присутність Н1 наближає нуклеосоми одна до одної у складі фібрили, чим сприяє зшиванню цих нуклеосом хвостами корових гістонів. І навпаки, компактизація фібрили за участю хвостів корових гістонів сприяє зв’язуванню Н1 із наближеними у просторі ділянками лінкерів.
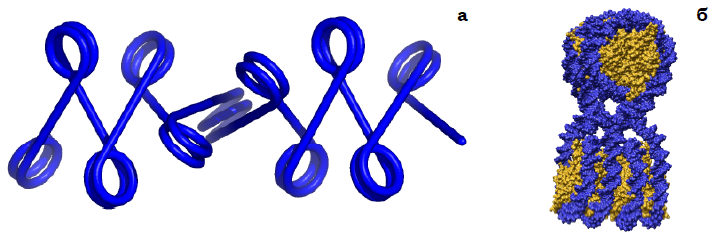
Рис. 16. Зиґзаґоподібна конфігурація полінуклеосомної нитки (а) і структура компактизованого елемента такої нитки у кристалах тетрануслеосом (б, 1ZBB).
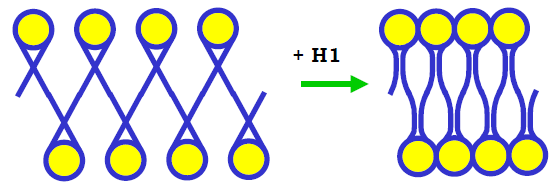
Рис. 17. Роль Н1-залежного стебла на виході з нуклеосоми у стабілізації компактного стану хроматинової фібрили.
Отже, суперструктура конденсованої фібрили товщиною 30 нм являє собою тривимірний зиґзаґ нуклеосом, з’єднаних практично прямими – без вигинів – лінкерами, які спрямовані всередину фібрили. Усередині містяться також і гістони Н1; сумісна дія Н1 і хвостів корових гістонів підтримує компактний стан фібрили.
Фібрила товщиною 30 нм – основна форма існування інтерфазного хроматину. Але у хроматині існує значна гетерогенність за ступенем конденсації. З одного боку, передумовою активації окремих ділянок хроматину є деконденсація фібрили. Факторами такої деконденсації є зниження спорідненості до ДНК хвостів корових гістонів унаслідок їхнього ацетилювання (зниження позитивного заряду) і тимчасова дисоціація Н1. Дисоціації Н1 сприяє ацетилювання хвостів корових гістонів, а також посттрансляційні модифікації самого Н1, зокрема фосфорилювання. Деконденсація фібрили та дисоціація Н1 створюють можливість взаємодії з ДНК різноманітних негістонових білків, що врешті решт і викликає активацію транскрипції.
З іншого боку, у репресованих ділянках хроматинова фібрила може бути як додатково стабілізованою в компактному стані, так і піддаватися компактизації вищого порядку. Частина хроматину, що зберігає стан підвищеної компактизації протягом інтерфази, називається гетерохроматином (решта хроматину, де в принципі може відбуватися активація транскрипції, позначається як еухроматин). Утворення гетерохроматину здійснюватися, головним чином, у ділянках, що містять повтори – у центромерах, теломерах, зонах концентрації мобільних елементів. Деталі структури гетерохроматину залишаються не з’ясованими, механізми встановлення та підтримання неактивного конденсованого стану гетерохроматину розглядаються далі.
