
МНХ (Шиян Н.І.) / лек № 10. Автор Шиян Н.І
..docЛекція № 10. ХІМІЧНИЙ ЗВ'ЯЗОК І БУДОВА РЕЧОВИНИ
Завдання вивчення теми. Залежність властивостей речовин від їх структури – основна ідея вивчення шкільного курсу. Відомо, що теорія будови речовини є центральним питанням сучасної хімії. Без неї неможливо зрозуміти причини багатогранності хімічних сполук, механізм їх утворення, будову і реакційну здатність. Тому у шкільному курсі ідея про залежність властивостей речовин від їх будови є провідною. Знанням про будову речовини керуються під час вивчення хімічних виробництв, коли мова йде про вибір способів керування хімічними процесами на основі закономірностей їх перебігу. Вивчення будови речовини має велике значення як для засвоєння основ сучасної хімії, так і для матеріалістичного світорозуміння. При вивченні цієї теми з урахуванням міжпредметної координації з відповідними розділами фізики учні переконуються у правильності вчення про переривчасту будову речовини, дізнаються про існування нових частинок, якісно відмінних від атомів і молекул, які в свою чергу є складними і подільними.
Людство вступило в еру атомної енергії, тому відомості про будову речовини і властивості найдрібніших структурних одиниць матерії є загальноосвітніми. Будова речовини – один з блоків у структурі понять про речовину, який настільки бурхливо розвивається, що перетворився у комплекс теорій. А тому вивчення будови речовини висуває перед вчителем ряд важливих завдань.
Освітні завдання. Поглибити знання учнів про періодичний закон і періодичну систему хімічних елементів Д.І. Менделєєва, розкрити залежність властивостей речовини від будови атомів елементів, з яких вони складаються, характеру хімічного зв'язку в молекулах та кристалах. Розкрити сутність утворення хімічних сполук, ознайомити учнів з типом хімічного зв'язку в різних сполуках на основі електронегативності атомів елементів; сформувати поняття про закономірності утворення хімічного зв'язку між атомами елементів; розвивати уміння і навички у написанні електронних формул речовин; розглянути суть окислювально-відновних процесів; сформувати уміння складати рівняння реакцій способом електронного балансу.
Виховні завдання. Продовжити формування елементів науково-матеріалістичного світогляду учнів у напрямах розуміння невичерпності електрона, як і атома, матеріальної сутності хімічного зв'язку, багатогранності і єдності всіх типів хімічного зв'язку, взаємозв'язку явищ у природі (будова атомів → електронегативність → типи хімічного зв'язку → властивості макротіл), розуміння єдності двох протилежних процесів – окиснення і відновлення. Звернути увагу на взаємний вплив частинок речовини, діалектику частини і цілого, на висновок про те, що речовина являє собою систему, в якій властивості цілого не є сумою властивостей окремих її елементів; взаємний вплив структурних частинок, що приводить до перерозподілу електронної густини, обумовлює нові властивості.
Розвиваючі завдання. Удосконалювати уміння учнів робити умовиводи щодо природи хімічного зв'язку; на основі аналізу складу речовин встановлювати причинно-наслідкову залежність властивостей речовин від характеру хімічного зв'язку та типу кристалічної решітки; передбачати тип кристалічної решітки на основі фізичних властивостей. Формувати в учнів уміння виявляти головне, суттєве, порівнювати, узагальнювати знання про будову речовини, здобуті на уроках фізики і хімії.
Для успішної реалізації цих взаємопов'язаних завдань потрібно глибоко проаналізувати структуру понять теми «Хімічний зв'язок. Будова речовини». Диференціація їх на міжпредметні, внутрішньопредметні, нові і перспективні поняття (табл.) забезпечить необхідну актуалізацію опорних знань, наступність у формуванні нових понять і подальший їх перспективний розвиток.
Учитель повинен пам'ятати, що теорії включаються до курсу не з інформаційною метою; вони повинні «діяти», бути для учнів знаряддям пізнання, постійно виявляти свою пояснювальну і прогнозуючу функції. Це вдається далеко не кожному, навіть досвідченому, вчителю. В аналізах результатів вступного екзамену з хімії до вузів країни серед інших недоліків щорічно зазначається саме цей недолік. Однією з причин такого становища є те, що вчителі не завжди чітко реалізують у навчанні структуру системи понять про будову речовини, визначену, зокрема, Г.М. Чернобельською, яку в узагальнюючому вигляді можна уявити, як показано на схемі.
Структура понять теми «Хімічний зв'язок. Будова речовини»
|
Опорні поняття |
Основні поняття і уявлення, що формуються |
||
|
Міжпредметні |
Внутрішньопредметні |
Нові |
Перспективні |
|
Поняття про іони, позитивні і негативні заряди. Взаємодія заряджених тіл, електричне поле. Кристалічні решітки. |
Прості речовини – неметали. Спарені електрони. Стійкі електронні конфігурації хімічних атомів. Прості і складні речовини. Будова атомів хімічних елементів. Валентність. |
Ковалентний зв'язок. Формула електронна, структурна. Електронегативність Полярний і неполярний ковалентний зв'язок. Іони. Іонний зв'язок. Іон на сполука. Кристалічні решітки: іонна, атомна, молекулярна. Ступінь окиснення. Окиснення. Відновлення. Окислювально-відновні реакції. |
Ковалентний зв'язок за донорноакцепторним механізмом. Металічний зв'язок Водневий зв'язок. Взаємний перехід різних типів зв'язків при зміні зовнішніх умов. Ковалентний зв'язок: s-s-зв'язок, р-р-зв'язок, sp3-, sp2-, sp-гібридизація. - і -зв'язок. Просторова будова молекул неорганічних та органічних сполук. Металічна кристалічна решітка. Залежність властивостей простих і складних речовин від типу хімічного зв'язку і кристалічної решітки. Речовини постійного і непостійного складу. Комплексні сполуки. |
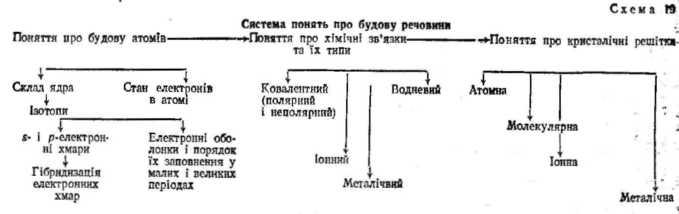
Як бачимо, ідеї будови речовини проходять через весь курс хімії. Аналіз структури понять показує, що фактично вивчення будови речовини починається з формування початкових понять про атоми і молекули у 8-му класі.
Зміст понять про будову речовини представлений у курсі двома основними теоріями: а) будови атома; б) хімічного зв'язку і будови речовини. Ці дві теорії пов'язані між собою: поняття про будову атомів є опорними для вивчення хімічного зв'язку. У 9-му класі під час вивчення теорії електролітичної дисоціації ці поняття збагачуються уявленнями про іони. Розглядається поведінка речовин у розчині. Утворення іонів пов'язано з поняттям «кристалічна решітка», оскільки йдеться про дисоціацію іонних кристалів; з поняттям «молекула» – при розгляді іонізації і дисоціації полярних молекул, а також поняттям «атом», бо деякі іони являють собою атоми, що несуть заряд. Раніше відомі поняття якісно змінюються, збагачуються за своїм змістом і обсягом.
У 10-му класі під час вивчення будови органічних речовин використовуються уже сформовані поняття про атоми і молекули. Але матеріал органічної хімії вносить багато нового у ці поняття: розширюються квантово-механічні уявлення про атоми, вводиться поняття про гібридизацію орбіталей, розглядається хімічна будова сполук за теорією О.М. Бутлерова.
Під час вивчення хімічного зв'язку формуються поняття про ковалентний полярний і неполярний зв'язки, іонний зв'язок і поведінку іонів у розчинах, далі – про металічний і водневий зв'язки, будову молекул органічних сполук. Особлива увага надається при цьому виявленню єдиної природи будь-якого хімічного зв'язку, про що особливо предметно розкривається у курсі загальної хімії при поглибленні уявлень про будову речовини на рівні, досягнутому на кінець навчання. Будова атома і питання хімічного зв'язку пов'язуватимуться там з енергетичними уявленнями.
Для кожної системи важлива не лише її структура, а й побудова, послідовність введення нових понять у шкільний курс. Подолати труднощі у засвоєнні цих понять можна лише при умові додержання принципу систематичності, встановлення міжпредметних зв'язків, чітких логічних побудов з використанням опорних понять і внутрішньопредметних зв'язків.
Відомо, що вивчення учнями теорії будови атома значною мірою відбувається в темі «Періодичний закон і періодична система хімічних елементів Д.І. Менделєєва. Будова атома». Тому зупинимося на деяких методичних аспектах вивчення матеріалу теми 8-го класу «Хімічний зв'язок. Будова речовини», а також розвитку понять про будову речовини у загальній хімії.
Формування понять про хімічний зв'язок і структуру твердих речовин
на основі електронних уявлень
Формування понять про типи хімічних зв'язків. На вивчення теми «Хімічний зв'язок. Будова речовини» за, програмою хіміко-біологічного профілю відводиться 12 год, з них 6 год на семінарські заняття, що дає можливість ретельно відпрацювати тему, ґрунтовніше засвоїти матеріал.
При початковому вивченні типів хімічного зв'язку можливі два методичні підходи. В одному з них розгляд починається з іонного зв'язку, при якому утворення заповнених електронних шарів відбувається за рахунок практично повного переходу електронів від одного атома до іншого. Потім розглядається ковалентний неполярний зв'язок, коли заповнені електронні шари утворюються за рахунок загальних електронних пар атомів, що поєднуються. Ковалентний полярний зв'язок розглядається як проміжний зв'язок між неполярним ковалентним і іонним.
Практика показала, що така послідовність у вивченні веде до того, що учні досить часто поширюють уявлення про іонний зв'язок на всі складні речовини і помилково вважають цей вид зв'язку домінуючим.
Методично більш виправданим є другий підхід, коли вивчення починається з ковалентного неполярного зв'язку, а іонний розглядається як крайній випадок ковалентного полярного зв'язку.
Перш ніж приступати до вивчення механізму утворення ковалентного неполярного зв'язку, учнів ознайомлюють з тим, як розв'язувалась в науці проблема утворення сполук елементів, які основні положення теорії хімічного зв'язку. Повідомляють, що вчення про хімічний зв'язок – одне з центральних сучасної хімії, розвиток якого відбувався від уявлень про існування у атомів «петельок» і «крючечків», з допомогою яких вони сполучаються, до знань про електронну природу хімічного зв'язку і моделей утворення різних його типів. Сучасні методи дослідження дають змогу експериментально визначати просторове розміщення атомних ядер у речовині, тобто виявляти відстань між ними (довжину зв'язку), визначати валентні кути, форму молекули або елементарну комірку кристала. Можна експериментально визначити енергію зв'язку, що стверджує реальне існування його. Учитель розповідає про те, що на основі експериментальних відомостей вчені створюють моделі, які відображають будову речовин, і висловлюють гіпотези про механізм утворення хімічного зв'язку, під час вивчення якого використовують моделі. Розкриваючи шляхи або механізм утворення хімічних зв'язків, учитель користується саме ідеалізованими моделями ковалентного та іонного зв'язків.
Починаючи розгляд ковалентного зв'язку, актуалізують знання учнів про будову атома, які вони здобули під час вивчення фізики та хімії. Учням пропонується відповісти на ряд запитань. З яких частинок побудований атом? Який заряд електрона? Які форми електронних хмар вам відомі? Чим відрізняється сферична електронна хмара від гантелеподібної? Які електрони називають спареними?
Після нього виконується лабораторна робота, що містить завдання диференційованого характеру. Одна група учнів визначає, моделі яких атомів хімічних елементів видані, обчислює кількість спарених і неспарених електронів у цих атомах. Друга група збирає моделі атомів літію, фтору, неону, використовуючи саморобні деталі до моделей, записує електронну схему будови атомів цих елементів. Наслідки обговорюються в процесі бесіди, під час якої зазначають, що електрони атомів усіх хімічних елементів виявляють схильність до утворення завершеного зовнішнього електронного шару.
За одним з варіантів вивчати природу хімічного зв'язку можна порівнянням відновних властивостей атомарного і молекулярного водню на основі результатів демонстраційного досліду. Учні повинні самі зробити висновок з досліду (взаємодія атомарного і молекулярного водню з заліза(III) хлоридом про різну хімічну активність атомарного і молекулярного водню; пояснити причини цього явища. Звертається увага на те, що у кожного атома водню на відміну від молекули є один неспарений електрон, який може брати участь в утворенні зв'язку з іншими атомами. Хімічний зв'язок утворюється за рахунок електростатичної взаємодії позитивно заряджених ядер і негативно заряджених електронів. Електронні хмари перекриваються, деформуються, утворюється загальна для двох атомних ядер електронна хмара, яку називають молекулярною. При цьому відбувається перерозподіл від'ємних зарядів, що призводить до більшої електронної густини між двома ядрами, які притягуються до неї (мал. 3).
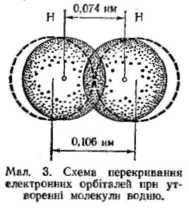
Таким чином, узагальнення електронів дає можливість атомам водню досягти стійкої електронної конфігурації інертного газу – гелію. Наголошують, що під час утворення хімічного зв'язку енергія завжди виділяється за рахунок зменшення потенціальної енергії взаємодіючих електронів і ядер. Тому потенціальна енергія частинки (молекули), що утворилася, завжди менша, ніж сумарна потенціальна енергія вихідних вільних атомів. Отже, умовою утворення хімічного зв'язку є зменшення потенціальної енергії системи взаємодіючих атомів.
Використовуючи кадр 12 діафільму «Хімічний зв'язок. Будова неорганічних сполук», схематично записують утворення молекули водню, електронну, структурну та молекулярну її формули. Працюючи з підручником, учні самостійно зображують утворення молекул хлору, кисню, азоту. На завершення дають характеристику ковалентного зв'язку.
Вивчення полярного ковалентного зв'язку починається із запитання до класу: Чи впливає природа атомів на їх взаємодію? Якщо так, то покажіть на прикладі розподілу загальної електронної густини в молекулах типу А2, АВ, до складу яких входять атоми елементів-неметалів. Далі з'ясовують, який тип хімічного зв'язку у молекулах типу АВ. Конкретно розглядають утворення молекули хлороводню (мал. 4).

Увага учнів звертається на різну природу взаємодіючих атомів, яка впливає на зміщення електронної густини в бік більш неметалічного елемента. Дається визначення полярного ковалентного зв'язку. Учитель запитує: Чим пояснюється асиметричний розподіл загальної густини в молекулі води? Атом якого елемента – водню чи кисню – більш енергійно відтягує електронну густину? Що з цього приводу можна сказати про молекулу хлороводню? Для відповіді на ці запитання вводиться поняття «електронегативність». Розглядають зміну електронегативності у головних підгрупах і періодах, ознайомлюють учнів з таблицею електронегативності деяких елементів (за підручником). Учні порівнюють полярність зв'язку в молекулах хлороводню, фтороводню, води і сірководню.
На завершення учитель підкреслює, що коли елементи значно відрізняються за своїми властивостями, то електронні хмари можуть повністю зміститися до атомів одного з елементів. Тоді ковалентний зв'язок переходить в інший тип зв'язку. Цей висновок робить логічним перехід до ознайомлення учнів з природою іонного зв'язку. Традиційно його розглядають на прикладі утворення «молекули» хлориду натрію. Демонструють дослід взаємодії натрію з хлором і записують на дошці схему і електронне рівняння утворення іонної сполуки, зокрема хлориду нагрію:
![]()
Дають визначення іонного зв'язку і підкреслюють, що це крайній випадок полярного ковалентного зв'язку. Іонна сполука – хлорид натрію – за звичайних умов – тверді кристали. У цьому стані вона перебуває не в молекулярній формі, а у вигляді позитивних і негативних іонів. Лише при високих температурах (1500°С) газоподібний хлорид натрію можна розглядати у вигляді окремих молекул.
Підкреслюють, що в реальних речовинах названі типи хімічного зв'язку у «чистому вигляді» зустрічаються рідко. У більшості випадків один тип зв'язку накладається на інший.
Але такий варіант вивчення хімічного зв'язку не можна визнати найкращим, хоч він дуже розповсюджений у шкільній практиці.
Кращим у методичному плані є інший варіант, коли вивченню хімічного зв'язку передує розгляд електронегативності хімічних елементів. Тоді учні починають усвідомлювати належність елементів до металів і неметалів, яка визначається здатністю їхніх атомів віддавати або приєднувати електрони під час хімічних реакцій. Звертається увага на те, що в атомів одних елементів яскравіше виявлена властивість відтягувати на себе електрони від атомів інших елементів у сполуках. Така властивість називається електронегативністю.
На основі поняття про електронегативність розглядаються три випадки утворення хімічного зв'язку:
-
Між атомами елементів, електронегативність яких однакова: при утворенні простих речовин – неметалів (Н2, F2, O2) і простих речовин – металів.
-
Між атомами елементів, електронегативність яких різна, але не дуже відрізняється (Н2О, НСl, NH3, СН4).
-
Між атомами елементів, електронегативність яких відрізняється дуже сильно (наприклад, між атомами лужних металів і атомами галогенів, тобто типових металів і типових неметалів).
Учні усвідомлюють, що електронегативність елементів впливає на розподіл електронів між атомами, які взаємодіють.
Звідси логічно випливає висновок про те, що залежно від характеру розподілу електронів у речовині розрізняють три типи хімічного зв'язку: ковалентний, іонний, металічний. Відомі ще й інші типи, які до основних не належать, а являють собою певні різновиди. Так, водневий зв'язок, наприклад, є різновидом ковалентного. З металічним і водневим зв'язками учні ознайомляться пізніше.
Розвиток уявлень про валентність та розміри атомів. На основі знань учнів про хімічний зв'язок легко перейти до з'ясування електронної суті валентності як властивості атомів утворювати хімічний зв'язок, а також до обчислення значення валентності, яке дорівнює кількості зв'язків, що утворює атом, або кількості електронів, що беруть участь в його утворенні. Користуючись поняттям електронегативності, учнів підводять до розуміння формального, але необхідного поняття, яким є ступінь окиснення. Учитель розмежовує поняття валентності і ступеня окислення, навчає учнів визначати ступінь окиснення елементів. Потім учні виконують вправи на складання формул бінарних сполук. На уроках у більшості випадків використовують групову форму навчання, здійснюючи під час організації самостійної роботи диференційований підхід з урахуванням ступеня підготовленості учнів.
Поглиблення знань про валентні можливості атомів, розкриття фізичного змісту валентності передбачає насамперед врахування раніше набутих знань про природу хімічного зв'язку. Нагадують, що валентність елемента належить до основних понять хімії. Учні пригадують відомі для них визначення валентності. Зокрема, з позиції вчення про хімічний зв'язок валентність визначається кількістю ковалентних зв'язків, за допомогою яких один атом сполучається з іншими атомами. Поглиблюючи знання про закономірності, що випливають з періодичної системи, наголошують, що в утворенні хімічних зв'язків в основному беруть участь електрони зовнішнього енергетичного рівня, а тому в більшості випадків максимальна валентність елемента визначається саме цією кількістю електронів.
Типи кристалічних решіток. Вивчення кристалічних решіток повинно спиратися на міжпредметні зв'язки. З'ясовують, що кристали – це макротіла, їх властивості (твердість, температура плавлення, кипіння та ін.) залежать від будови, що обумовлена особливостями частинок, з яких складається кристал. Повторюють матеріал про молекули й атоми і розглядають кристалічні й аморфні речовини. З'ясовують, як пояснити існування твердих речовин, чому вони виявляють надто різноманітні властивості. Розкривають поняття «кристалічна решітка», звертають увагу на закономірне розміщення частинок (атомів, молекул, іонів) у кристалах. Залежно від того, які частинки містяться у вузлах решітки, розрізняють іонні, атомні, молекулярні решітки (пізніше учні вивчатимуть металічні кристалічні решітки). На даному етапі з'ясовують структуру зазначених типів решіток на підставі демонстрації вчителем моделей просторових решіток хлориду натрію, алмазу, твердого оксиду вуглецю (IV). На конкретних прикладах показують залежність деяких фізичних властивостей речовин від типів кристалічних решіток. Важливо, щоб учні засвоїли таку закономірність: якщо відома будова речовини, то можна передбачати її властивості, а якщо відомі властивості речовини, то можна визначити її будову.
Щоб навчити учнів використовувати цю закономірність, корисно організувати самостійну роботу, під час якої вони змушені були б передбачати окремі властивості речовин (наприклад, орієнтовні температури плавлення NaF, F2, НF) і мотивувати свої погляди з цього приводу. Виконання системи тренувальних вправ сприятиме закріпленню знань, кращому їх засвоєнню.
Узагальнення і поглиблення знань про хімічний зв'язок і будову речовин. В 11-му класі при вивченні основ загальної хімії важливо розкрити валентні можливості атомів хімічних елементів. Під час розгляду саме цього питання повторюються, поглиблюються, набувають дальшого розвитку знання про періодичний закон і періодичну систему елементів, електронну будову їх атомів, валентність, хімічний зв'язок тощо.
Починають з доведення, що валентні можливості атомів визначаються їх електронною будовою.
Цікава проблемна ситуація створюється під час розгляду за періодичною таблицею таких хімічних елементів, як азот, кисень, фтор, на зовнішньому шарі яких міститься відповідно 5, 6 і 7 електронів. Проте учням відомо, що такої валентності вони не виявляють. При цьому знання, які засвоїли учні, суперечать виявленому факту. Адже найвища валентність азоту, кисню, фтору не відповідає кількості валентних електронів у їх атомах.
Щоб розв'язати проблему, вчитель спочатку розбирає з учнями для прикладу хімічний елемент сірку, валентність якої дорівнює 2, 4, 6. Як це пояснити з позиції будови атома? Записують електронну формулу сірки: 1s22s22р63s23р43d0. Вчитель пропонує показати, як саме електрони зовнішнього рівня розміщуються за енергетичними комірками. Виникає такий запис:

На підставі обговорення даного прикладу учні приходять до висновку, що валентність елемента визначається кількістю неспарених електронів, які містить атом, або кількістю електронів, які утворилися внаслідок розпарювання електронних пар, і тепер можуть брати участь в утворенні хімічного зв'язку.
За аналогією складають, електронну формулу азоту; 1s22s22р3 і показують, як електрони розміщуються за енергетичними комірками:
![]()
Аналізуючи таке графічне зображення, вони помічають, що в атома азоту на зовнішньому рівні електрони розпаровуватися не можуть, бо немає вільної орбіталі. Тому азот, як правило, тривалентний. Учитель доповнює, що найвища валентність азоту може дорівнювати 4. Спільними зусиллями пригадують утворення іона амонію за донорно-акцепторним механізмом ковалентного зв'язку.
![]() записують
таку схему
записують
таку схему![]()
Учні переконуються, що за рахунок неподіленої . електронної пари утворився четвертий хімічний зв'язок. Всі хімічні зв'язки азоту з воднем рівноцінні, але походження їх різне. Отже, вища валентність азоту може бути лише чотири.
Аналогічно учні самостійно розглядають електронну будову атомів кисню і фтору і доходять висновку, що вільної орбіталі немає, спарені електрони роз'єднуватися не можуть. Отже, валентність кисню і фтору також не відповідає кількості валентних електронів.
Робиться загальний висновок: валентні можливості атомів хімічних елементів визначаються електронною будовою атомів, а саме: кількістю рухомих електронів, що містяться на зовнішніх енергетичних рівнях, точніше – кількістю неспарених електронів і неподільних електронних пар, які здатні розпаровуватися з переходом електронів на вільні орбіталі атомів інших елементів (певний вплив має також співвідношення між розмірами реагуючих атомів і утворюваних іонів, а також тип хімічного зв'язку, що розглядатиметься далі).
Важливо обговорити з учнями і той випадок, коли в утворенні хімічних зв'язків можуть брати участь також електрони передостаннього рівня. Наводиться приклад зі скандієм, у якого в утворенні зв'язків беруть участь не лише два зовнішні електрони, але й один з передостаннього рівня, тобто d-підрівня. Тому елемент скандій у відповідних сполуках тривалентний. Це стосується й інших d-елементів.
Учитель пояснює учням, що оскільки під час руху електрони утворюють електронні хмари-орбіталі, а загальну електронну пару слід розуміти як перекривання двох електронних орбіталей, то в узагальненому вигляді валентності можна дати таке визначення: валентність елемента дорівнює кількості орбіталей його атома, які беруть участь в утворенні хімічного зв'язку. Підкреслюють, що таке визначення стосується лише сполук з ковалентним зв'язком.
Валентні ж можливості атомів у випадку іонного зв'язку визначаються кількістю валентних електронів у металу і вільних орбіталей (не заповнених електронами) у неметалу. Наприклад, утворення фториду літію можна зобразити у вигляді такої схеми:
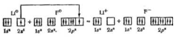
Учням відомі причини періодичної зміни валентностей елементів, а відповідно і їх властивостей. Зазначають, що в періодичній послідовності зростають і атомні радіуси хімічних елементів. Пояснюють це на прикладі елементів 2-го періоду і підводять учнів до висновку про те, що розміри атомів впливають на їх здатність віддавати чи приєднувати електрони і разом з будовою зовнішнього електронного шару визначають хімічні властивості атомів елементів. Учні спроможні пояснити, чому елементи літій, натрій, калій, у яких розмір атомів найбільший порівняно з атомами інших елементів тих самих періодів, є донорами електронів, а при переході від лужних металів до галогенів відновні властивості атомів зменшуються, а окислювальні – зростають.
