
- •ТРАНСЛЯЦИЯ БЕЛКОВ
- •ТРАНСЛЯЦИЯ БЕЛКОВ
- •ТРАНСЛЯЦИЯ БЕЛКОВ
- •ТРАНСЛЯЦИЯ БЕЛКОВ
- •ПОСТТРАНСЛЯЦИОННАЯ МОДИФИКАЦИЯ ФУНКЦИОНАЛЬНЫХ ГРУПП БЕЛКОВ
- •правильность положения дисульфидных мостиков контролируется протеиндисульфид-изомеразой
- •При прохождении белков по секреторным путям эукариотической клетки происходит уменьшение уровня глутатиона и
- •ДВЕ ГРУППЫ ПРОЦЕССОВ ПОСТРАНСЛЯЦИОННОЙ МОДИФИКАЦИИ
- •ДВЕ ГРУППЫ ПРОЦЕССОВ ПОСТРАНСЛЯЦИОННОЙ МОДИФИКАЦИИ
- •ДВЕ ГРУППЫ ПРОЦЕССОВ ПОСТРАНСЛЯЦИОННОЙ МОДИФИКАЦИИ
- •ЧЕТЫРЕ ОСНОВНЫЕ ГРУППЫ ФУНКЦИЙ БЕЛКОВ, ТРЕБУЮЩИХ ПОСТТРАНСЛЯЦИОННОЙ МОДИФИКАЦИИ БОКОВЫХ РАДИКАЛОВ
- •ЧЕТЫРЕ ОСНОВНЫЕ ГРУППЫ ФУНКЦИЙ БЕЛКОВ, ТРЕБУЮЩИХ ПОСТТРАНСЛЯЦИОННОЙ МОДИФИКАЦИИ БОКОВЫХ РАДИКАЛОВ
- •МОДИФИКАЦИЯ БЕЛКОВ ПУТЕМ ПРИСОЕДИНЕНИЯ ПРОСТЕТИЧЕСКИХ ГРУПП
- •КАРБОКСИЛАЗЫ – перенос одноуглеродного фрагмента в виде СО2 на ацетилСоА, пропионилСоА
- •АЦИЛТРАНСФЕРАЗЫ – перенос углеродных фрагментов на СоА через восстановительное ацилирование липоамида в процессах
- •АЦИЛТРАНСФЕРАЗЫ – перенос ацильного фрагмента от одного фермента мультиферментного комплекса к другому
- •Тиоэфиры - серные аналоги сложных эфиров - находят весьма ограниченное применение в классической
- •ЦИТОХРОМ С ОКСИДАЗА – Перенос электронов в мембране митохондрий при окислительном фосфорилировании
- •АМИНОТРАНСФЕРАЗЫ – трансаминирование аминокислот
- •АСПАРТАТ АМИНОТРАНСФЕРАЗЫ – катализирует реакцию переаминирования между оксалоацетатом
- •АСПАРТАТ АМИНОТРАНСФЕРАЗЫ – катализирует реакцию переаминирования между оксалоацетатом
- •ГИСТОНОВЫЙ КОД
- •Модификаций много, а память и время ограничены
- •Реакции нуклеофильного замещения
- •Факторы, влияющие на скорости реакций замещения
- •Факторы, влияющие на скорости реакций замещения
- •Факторы, влияющие на скорости реакций замещения
- •ФОСФОРИЛИРОВАНИЕ БЕЛКОВ
- •Главную роль в осуществлении реакций, отвечающих за перестройку всех процессов внутри клетки, приводящих,
- •ФОСФОРИЛИРОВАНИЕ БЕЛКОВ
- •ФОСФОРИЛИРОВАНИЕ БЕЛКОВ
- ••Основные этапы передачи сигналов с помощью фосфорилирования
- •Сигнальная
- •Схема передачи сигнала через мембранные рецепторы, ассоциированные с JAK
- •РЕАКЦИИ НУКЛЕОФИЛЬНОГО ПРИСОЕДИНЕНИЯ-ОТЩЕПЛЕНИЯ
- •Тетраэдрический механизм нуклеофильного замещения
- •Тетраэдрический механизм нуклеофильного замещения
- •Тиоэфиры - серные аналоги сложных эфиров - находят весьма ограниченное применение в классической
- •Ацилирование белков (ацетилирование белков)
- ••По ацилирующей способности все ацилкоферменты А и в том числе ацетилкофермент А, будучи
- •АЦИЛИРОВАНИЕ БЕЛКОВ
- ••Кроме ацетилирования в природе довольно широко распространено посттрансляционное ацилирование
- •АЦЕТИЛИРОВАНИЕ БЕЛКОВ
- •N-Homocysteinylation of proteins
- •РЕАКЦИИ НУКЛЕОФИЛЬНОГО ПРИСОЕДИНЕНИЯ-ОТЩЕПЛЕНИЯ
- •Антибиотики пенициллинового ряда
- •МОДИФИКАЦИЯ БОКОВОГО РАДИКАЛА ЛИЗИНА
- •Убиквитинилирование белков
- •Шапероны – кофакторы убиквитинилированных белков
- •ПОЛИУБИКВИТИНИЛИРОВАНИЕ БЕЛКОВ
- ••При полиубиквитилировании субстрата фрагмент убиквитин, непосредственно связанный с белком-мишенью, ацилируется по остаткам Lys-29,
- •Схема введения остатка (остатков) убиквитина в белок-субстрат. Е1-SH - убиквитин- активирующий фермент, Е2-SH
- ••В зависимости от природы используемого реагента модификация остатков лизина может быть как обратимой,
- •ОБРАТИМОЕ АЦЕТИЛИРОВАНИЕ
- •В зависимости от рН при взаимодействии соединений, содержащих карбонильную группу, реакция может остановиться
- •Сериновые протеазы. Механизм ковалентного катализа.
- •РЕАКЦИИ НУКЛЕОФИЛЬНОГО ПРИСОЕДИНЕНИЯ-ОТЩЕПЛЕНИЯ
- •ХИМИЧЕСКАЯ И ПОСТТРАНСЛЯЦИОННАЯ МОДИФИКАЦИЯ -АМИНОГРУППЫ ЛИЗИНА
- •Что необходимо знать после лекции
- •Что необходимо знать после лекции
ТРАНСЛЯЦИЯ БЕЛКОВ
•Рибосома является существенно важным аппаратом в биосинтезе белка. Она представляет собой рибонуклеопротеидный комплекс. Эукариотические рибосомы состоят из 40S (малой) и 60S (большой) субъединиц. Каждая субъединица включает рРНК и белки. В 40S субъединицу входит рРНК с константой седиментации 18S и около 30-40 белков. В 60S субъединице обнаружено 3 вида рРНК: 5S, 5,8S и 28S и около 50 белков.
•Белки входят в состав субъединиц рибосомы в количестве одной копии и выполняют структурную функцию, обеспечивая взаимодействие между мРНК и тРНК, связанными с аминокислотой и пептидом.
•В присутствии мРНК 40S и 60S субъединицы объединяются с образованием полной рибосомы.
ТРАНСЛЯЦИЯ БЕЛКОВ
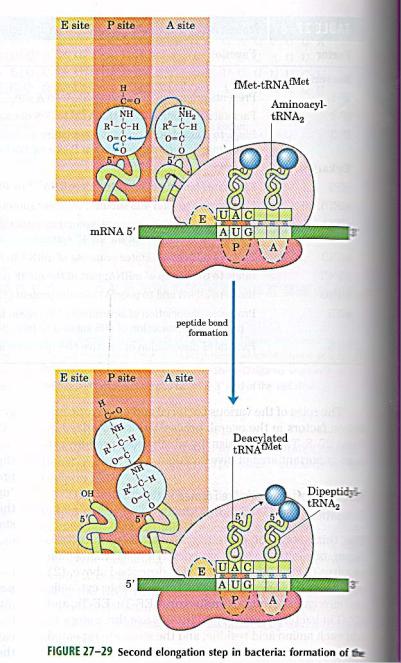
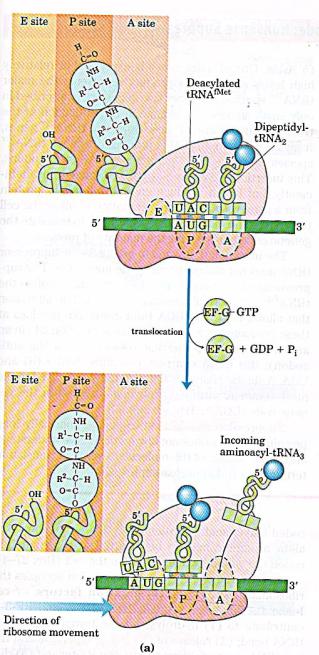
•В рибосоме есть два центра для присоединения молекул тРНК: аминоацильный (А) и пептидильный (Р) центры, в образовании которых участвуют обе субъединицы. Вместе центры А и Р включают участок мРНК, равный 2 кодонам. В ходе трансляции центр А связывает аа-тРНК, строение которой определяет кодон, находящийся в области этого центра. В структуре этого кодона зашифрована природа аминокислоты, которая будет включена в растущую полипептидную цепь. Центр Р занимает пептидил-тРНК, т.е. тРНК, связанная с пептидой цепочкой, которая уже синтезирована.
ТРАНСЛЯЦИЯ БЕЛКОВ
•В каждой стадии белкового синтеза на рибосоме: инициации, элонгации и терминации участвует разный набор внерибосомных белковых факторов. Эти белки связываются с рибосомой или ее субъединицами на определенных стадиях процесса и стабилизируют или облегчают функционирование белоксинтезирующей машины.
ТРАНСЛЯЦИЯ БЕЛКОВ
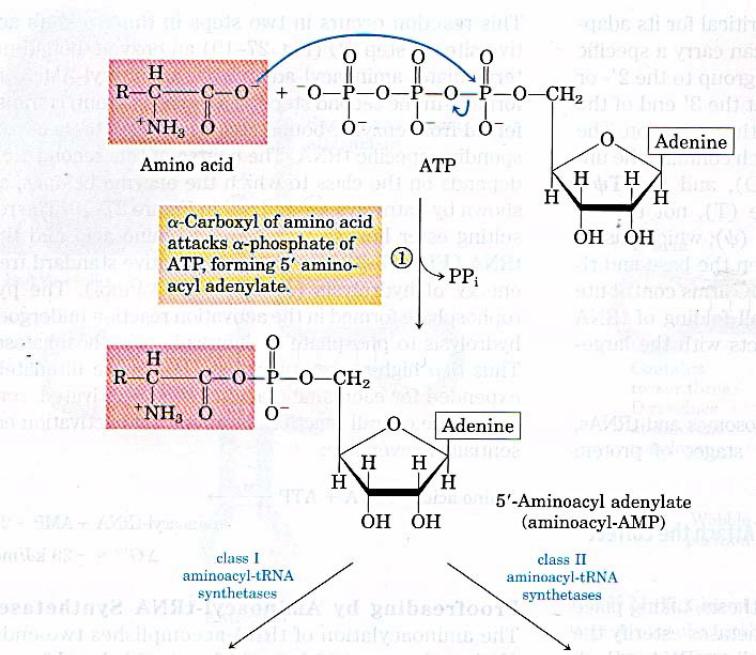
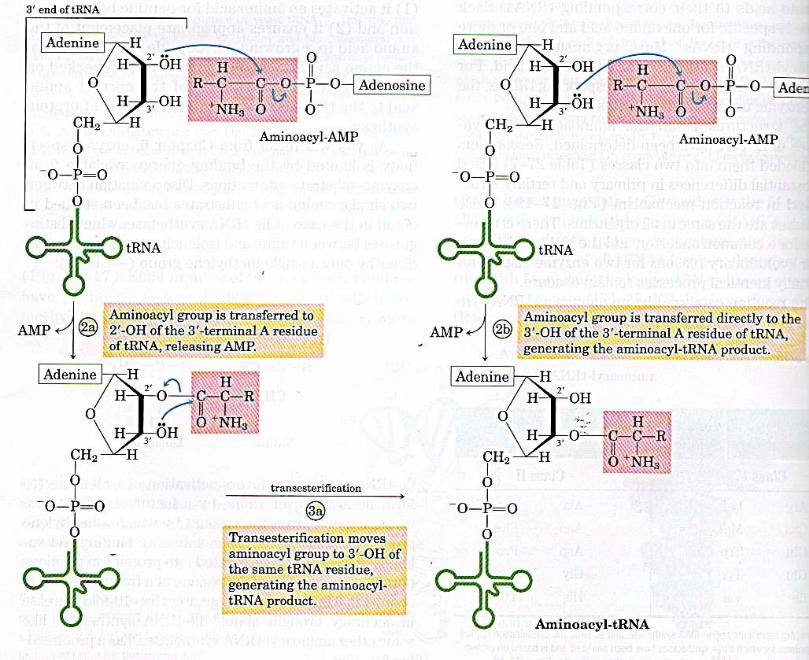
•На включение одной аминокислоты в растущую полипептидную цепь клетка затрачивает 4 макроэргические связи: 2 из АТР в ходе реакции, катализируемой аа-тРНК синтетазой (в процессе активации аминокислот) и 2 молекулы GTP: одна используется на связывание аа-тРНК в А-центре рибосомы, а вторая затрачивается на стадию транслокации.
•К этому надо добавить использование еще двух макроэргических связей АТР и GTP на инициацию и терминацию синтеза полипептидной цепи.
ПОСТТРАНСЛЯЦИОННАЯ МОДИФИКАЦИЯ ФУНКЦИОНАЛЬНЫХ ГРУПП БЕЛКОВ
•Матричный биосинтез полипептидных цепей на рибосомах в большинстве случаев не приводит непосредственно к функционально значимому белку. Образовавшаяся полипептидная цепь должна претерпеть некоторые дополнительные химические превращения, в подавляющем большинстве случаев ферментативные, уже вне рибосомы. Так как эти превращения происходят после того, как считана информация, привнесенная мРНК, то эти дополнительные процессы получили название посттрансляционной модификации.
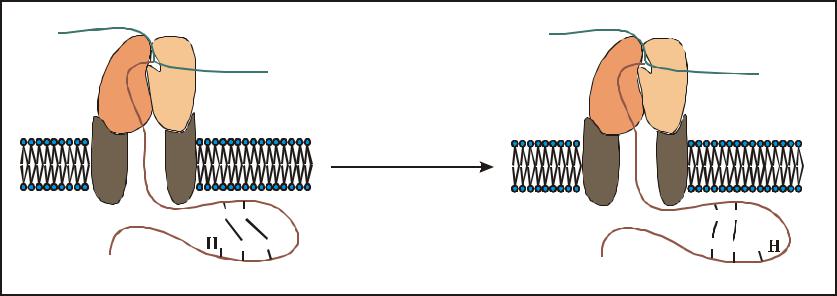
правильность положения дисульфидных мостиков контролируется протеиндисульфид-изомеразой
•образование происходит в ходе посттрансляционной модификации белков в эндоплазматическом ретикулуме.
|
|
П р о т е и н д и с у л ь ф и д - |
|
|
|
|
|
и з о м |
е р а з а |
|
|
S |
S |
|
S |
S |
|
S |
S |
S |
S |
S |
S |
