
- •В.И. Гребенькова, н.Г. Осипенкова, Голубская и.Э., Козлова е.Е. Методические указания к лабораторному практикуму по курсу «Химия»
- •Работа № 1 свойства неорганических соединений различных классов
- •Названия кислотных остатков различных кислот
- •Опыт 1. Изучение окраски индикаторов в различных средах
- •Опыт 2. Оксиды и гидроксиды активных металлов
- •Опыт 3. Оксиды и гидроксиды неметаллов
- •Опыт 3. Изучение свойств оксидов и гидроксидов металлов
- •Опыт 3а). Изучение свойств оксида меди.
- •Опыт 3б. Получение и разложение гидроксида меди
- •Опыт 4. Изучение свойств гидроксидов металлов
- •Опыт 5. Изучение химической активности кислот
- •Опыт 6. Получение малорастворимых кислот и оснований
- •Опыт 7. Получение слабодиссоциирующих оснований и кислот
- •Примеры сильных и слабых оснований
- •Опыт 8. Реакция нейтрализации
- •Опыт 9. Свойства солей
- •Опыт 9а) Взаимодействие солей с кислотами
- •Опыт 10а). Получение солей методом нейтрализации и их взаимодействия
- •Опыт 10б). Получение малорастворимых солей
- •Опыт 11. Качественные реакции на хлорид-, сульфат- и фосфат-ионы
- •Опыт 12. Исследование окраски некоторых катионов и анионов
- •Работа № 2 скорость химических реакций.
- •Опыт 1. Зависимость скорости реакции от концентрации реагирующих веществ
- •Опыт 2. Влияние температуры на скорость химической реакции
- •Опыт 3. Влияние катализатора на скорость химической реакции
- •Работа № 3 Химическое равновесие
- •Опыт 1. Равновесие в растворе хлорида меди
- •Смещение химического равновесия
- •Опыт 2. Влияние концентрации веществ на смещение равновесия обратимой реакции
- •Опыт 3. Влияние температуры на химическое равновесие
- •Опыт 4. Влияние реакции среды на смещение химического равновесия.
- •Бихромат-ион (оранжевый)
- •Работа № 4 Процессы, протекающие при образовании растворов
- •Опыт 1. Изменение температуры при растворении
- •Опыт 2. Изменение объема при растворении
- •Опыт 3. Изменение окраски при растворении
- •Опыт 4.Влияние типа растворителя на процесс растворения.
- •Опыт 5. Зависимость растворимости солей от температуры. Получение пересыщенных растворов
- •При сдаче лабораторной работы ответьте на следующие вопросы
- •Работа № 5 Приготовление растворов заданной концентрации
- •Опыт 1. Приготовление раствора бихромата калия k2Cr2o7 с определенной массовой долей
- •Опыт 2. Приготовление растворов серной кислоты заданной молярной и нормальной концентраций
- •Опыт 3. Определение концентрации кислоты методом титрования
- •Работа № 6 Свойства растворов электролитов
- •Опыт 1. Исследование электропроводности растворов различных веществ
- •Опыт 2. Изучение зависимости степени диссоциации веществ в растворах от их концентрации
- •При сдаче лабораторной работы ответить на следующие вопросы
- •Работа №7 гидролиз
- •Опыт 1. Гидролиз солей, образованных различными по силе основанием и кислотой
- •Опыт 2. Ступенчатый гидролиз солей, образованных различными по силе основанием и кислотой
- •Опыт 3. Гидролиз солей, образованных слабым основанием и слабой летучей кислотой. Полный необратимый гидролиз
- •Количественные характеристики процесса гидролиза
- •Факторы, влияющие на степень гидролиза
- •Работа № 8 окислительно–восстановительные процессы
- •Опыт 1. Сравнительная характеристика окислительных свойств галогенов и восстановительной способности галогенидов
- •Опыт 2. Окислительно–восстановительные свойства соединений, содержащих элементы в различных степенях окисления.
- •Опыт 3. Окислительно–восстановительные свойства пероксида водорода.
- •Опыт 4б. Влияние концентрации кислоты на процесс окисления цинка серной кислотой
- •Опыт 5. Окисление меди разбавленной и концентрированной азотной кислотой
- •Опыт 6. Влияние среды на протекание окислительно–восстановительных реакций.
- •Типы овр
- •Опыт 8. Каталитическое диспропорционирование пероксида водорода.
- •Опыт 9. Реакция внутримолекулярного окисления–восстановления перманганата калия.
- •Опыт 10. Реакция межмолекулярного окисления восстановления между иодидом и иодатом калия.
- •Контрольные задания
- •Работа № 9 электрохимические процессы Химические источники тока. Опыт 1. Изготовление гальванического элемента и расчет его эдс.
- •Коррозия металлов.
- •Опыт 2. Влияние образования гальванических пар на течение химических процессов.
- •Опыт 3. Коррозия оцинкованного и луженого железа.
- •Электролиз водных растворов солей
- •Опыт 4. Электролиз раствора сульфата натрия.
- •Опыт 5. Электролиз раствора иодида калия.
- •Опыт 6. Электролиз раствора хлорида олова.
- •Опыт 7. Электролиз раствора сульфата меди.
- •Опыт 8. Электролиз раствора сульфата меди с активным (медным) анодом.
- •Работа № 10 получение комплексных соединений, изучение их свойств и методов разрушения
- •Опыт 1. Зависимость окраски аквакомплексов от типа комплексообразователя
- •Опыт 2. Зависимость окраски комплексов кобальта от типа лигандов
- •Опыт з. Ступенчатая диссоциация бромидных комплексов меди(II)
- •Получение комплексных соединений. Написание уравнений комплексообразования. Названия.
- •Опыт 4. Получение аммиаката никеля
- •Опыт 6. Получение соединения, содержащего комплексные катион и анион
- •Опыт 7. Влияние природы d–элемента на комплексообразование
- •Устойчивость комплексных соединений
- •Константы нестойкости некоторых комплексных ионов
- •Опыт 8. Влияние концентрации раствора на устойчивость комплексных соединений
- •Опыт 9. Сравнительная устойчивость хлоридных комплексов цинка и кобальта
- •Опыт 10. Сравнительная устойчивость роданидного и фторидного комплексов железа
- •Опыт 11. Разрушение комплексов
- •При сдаче лабораторной работы ответить на следующие вопросы
- •Плотность водных растворов k2Cr2o7
- •Константы диссоциации воды и некоторых слабых кислот и оснований в водных растворах при 18 c
- •Области перехода некоторых индикаторов
- •Степень гидролиза солей (в 0,1 м растворах при 25c)
- •Константы нестойкости некоторых комплексных ионов
- •Растворимость некоторых солей и оснований в воде
- •Приборы и реактивы
- •Содержание
Работа № 2 скорость химических реакций.
Химическая кинетика изучает факторы, влияющие на скорость химических реакций и механизм их протекания.
Скорость реакции в гомогенных системах определяется изменением концентрации реагирующих веществ в единицу времени. В химической кинетике концентрация измеряется в молях на литр (моль/л), а скорость - в молях на литр в секунду (моль/л·с). Скорость реакции в гетерогенных системах определяется изменением количества вещества на единице поверхности в единицу времени.
Зависимость скорости химических реакций от различных факторов
К основным факторам, влияющим на скорость химической реакции, относятся: природа реагирующих веществ, их концентрация, температура, поверхность раздела (для гетерогенных систем), катализаторы.
Опыт 1. Зависимость скорости реакции от концентрации реагирующих веществ
Скорость химической реакции (V) прямо пропорциональна произведению молярных концентраций (С) реагирующих веществ в степенях, соответствующих их стехиометрическим коэффициентам (закон действия масс).
Для гомогенной реакции вида mA + nB = pC + qD
V = kс · CAm · CBn,
где kс – константа скорости. kс зависит от природы реагирующих веществ и температуры и не зависит от концентрации. V= kс при единичных концентрациях взаимодействующих веществ.
Для газовой системы
![]() скорость прямой реакции можно записать
двояко:
скорость прямой реакции можно записать
двояко:![]() и
и![]() ,
где рН2
и рN2
– парциальные давления водорода и
азота.
,
где рН2
и рN2
– парциальные давления водорода и
азота.
Выполнение опыта. В пробирку поместить 3 - 5 капель 1 н. раствора тиосульфата натрия Na2S2O3 и добавить 2 - 3 капли 2 н. раствора серной кислоты H2SO4.
Через некоторое время наблюдать помутнение раствора, вызванное выделением свободной серы. Реакция идет по уравнению:
Na2S2O3 + H2SO4 = Na2SO4 + SO2 + H2O + S.
Время, которое проходит от момента сливания растворов до появления заметного помутнения, характеризует скорость реакции.
Повторить опыт, используя большие количества реагентов. Для этого в три большие пробирки налить разбавленный (1200) раствор Na2S2O3: в первую – 5 мл, во вторую – 10 мл, в третью – 15 мл. В первую пробирку добавить 10 мл воды, во вторую – 5 мл воды.
В три другие пробирки налить по 5 мл разбавленной (1200) серной кислоты.
В пробирки с Na2S2O3 прилить при помешивании по 5 мл приготовленной H2SO4 и точно отметить (по секундной стрелке часов или секундомеру), через сколько секунд после приливания кислоты наблюдается образование мути в каждой пробирке.
Результаты записать в форме таблицы:
|
Номер пробирки |
Объем раствора Na2S2O3, мл |
Объем раствора H2SO4, мл |
Объем H2O, мл |
Время появления мути , с |
v= 1/t |
Результаты опыта представить графически, отложив скорость реакции V = 1/t на оси ординат, а концентрации растворов – на оси абсцисс.
Опыт 2. Влияние температуры на скорость химической реакции
Зависимость скорости большинства химических реакций от температуры описывается эмпирическим правилом Вант-Гоффа: при увеличении температуры на каждые 10 скорость реакции возрастает в 2 – 4 раза. Эта величина называется температурным коэффициентом реакции, или коэффициентом Вант-Гоффа и обозначается γ:
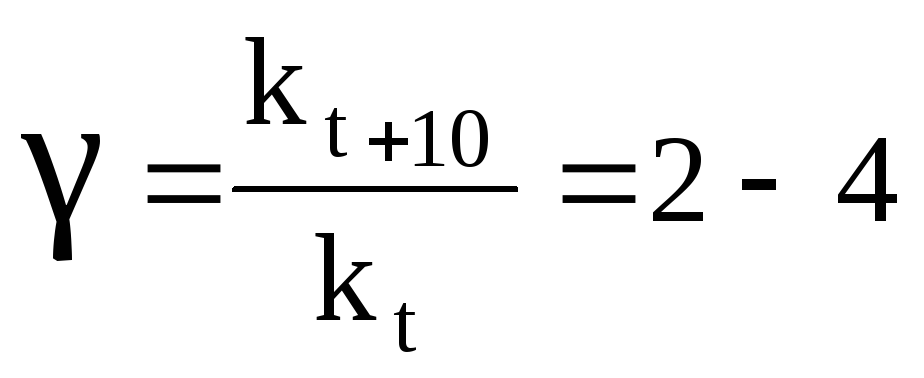 .
.
Закон Вант-Гоффа:
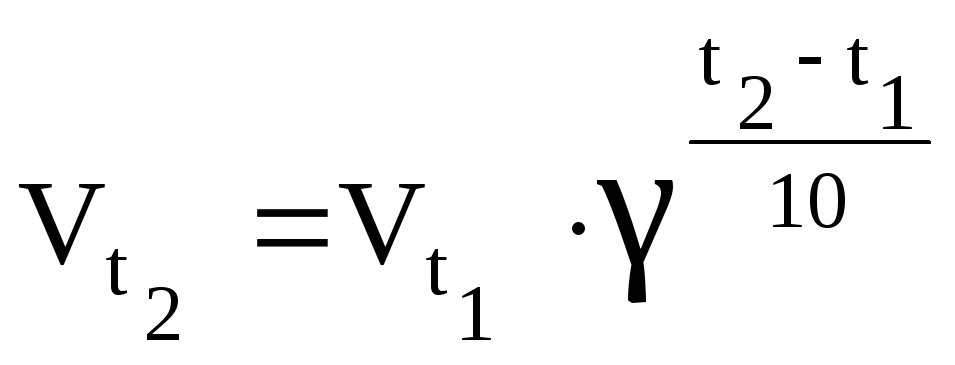 .
.
Рассчитаем для примера, во сколько раз увеличится скорость реакции при повышении температуры на 100, если = 2. Подставим исходные данные в уравнение Вант-Гоффа:
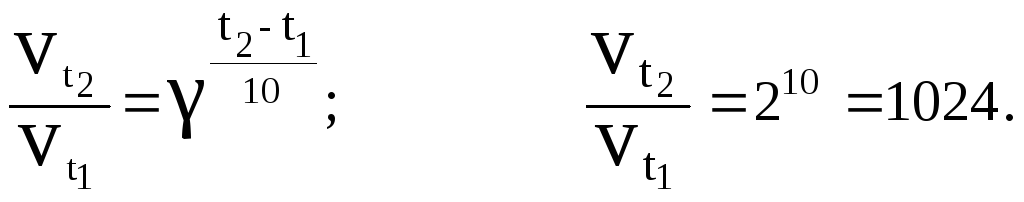
Правило Вант-Гоффа выполняется только для реакций, энергия активации которых лежит в пределах 84 – 170 кДж/моль. Оно было сформулировано на основе экспериментального изучения таких реакций при относительно низких температурах ( = 2 – 4).
Выполнение опыта. Приготовить три термостата, для чего три стаканчика объемом 200 - 250 мл наполнить на 2/3 водой и каждый стаканчик накрыть картонной крышкой с тремя отверстиями:
В одно отверстие каждого термостата поместить термометр, в другое – коническую пробирку с 2 н. раствором серной кислоты и опущенной в нее пипеткой, в третье – пробирку с 10 каплями 1 н. раствора тиосульфата натрия.
Первый стаканчик оставить на столе при комнатной температуре; второй и третий стаканчики поочередно поместить в водяную баню и нагреть второй стаканчик - до температуры на 10C выше, чем в первый, а третий - на 10C выше, чем второй.
Не вынимая пробирки с тиосульфатом натрия из термостатов, добавить в них по 1 капле 2 н. серной кислоты из того же термостата.
Отметить время от момента добавления кислоты до появления заметного помутнения раствора в каждом из термостатов. Время протекания реакций определять секундомером или метрономом.
Результаты записать в форме таблицы:
|
Номер пробирки |
Температура |
Время появления мути , с |
V = 1/t |
|
|
|
|
|
Результаты опыта представить графически, отложив скорость реакции V = 1/t на оси ординат, а температуру проведения опыта – на оси абсцисс.
Сформулировать вывод о зависимости скорости реакции от температуры для данного опыта. Определить температурный коэффициент скорости для данной реакции.
