
- •В.И. Гребенькова, н.Г. Осипенкова, Голубская и.Э., Козлова е.Е. Методические указания к лабораторному практикуму по курсу «Химия»
- •Работа № 1 свойства неорганических соединений различных классов
- •Названия кислотных остатков различных кислот
- •Опыт 1. Изучение окраски индикаторов в различных средах
- •Опыт 2. Оксиды и гидроксиды активных металлов
- •Опыт 3. Оксиды и гидроксиды неметаллов
- •Опыт 3. Изучение свойств оксидов и гидроксидов металлов
- •Опыт 3а). Изучение свойств оксида меди.
- •Опыт 3б. Получение и разложение гидроксида меди
- •Опыт 4. Изучение свойств гидроксидов металлов
- •Опыт 5. Изучение химической активности кислот
- •Опыт 6. Получение малорастворимых кислот и оснований
- •Опыт 7. Получение слабодиссоциирующих оснований и кислот
- •Примеры сильных и слабых оснований
- •Опыт 8. Реакция нейтрализации
- •Опыт 9. Свойства солей
- •Опыт 9а) Взаимодействие солей с кислотами
- •Опыт 10а). Получение солей методом нейтрализации и их взаимодействия
- •Опыт 10б). Получение малорастворимых солей
- •Опыт 11. Качественные реакции на хлорид-, сульфат- и фосфат-ионы
- •Опыт 12. Исследование окраски некоторых катионов и анионов
- •Работа № 2 скорость химических реакций.
- •Опыт 1. Зависимость скорости реакции от концентрации реагирующих веществ
- •Опыт 2. Влияние температуры на скорость химической реакции
- •Опыт 3. Влияние катализатора на скорость химической реакции
- •Работа № 3 Химическое равновесие
- •Опыт 1. Равновесие в растворе хлорида меди
- •Смещение химического равновесия
- •Опыт 2. Влияние концентрации веществ на смещение равновесия обратимой реакции
- •Опыт 3. Влияние температуры на химическое равновесие
- •Опыт 4. Влияние реакции среды на смещение химического равновесия.
- •Бихромат-ион (оранжевый)
- •Работа № 4 Процессы, протекающие при образовании растворов
- •Опыт 1. Изменение температуры при растворении
- •Опыт 2. Изменение объема при растворении
- •Опыт 3. Изменение окраски при растворении
- •Опыт 4.Влияние типа растворителя на процесс растворения.
- •Опыт 5. Зависимость растворимости солей от температуры. Получение пересыщенных растворов
- •При сдаче лабораторной работы ответьте на следующие вопросы
- •Работа № 5 Приготовление растворов заданной концентрации
- •Опыт 1. Приготовление раствора бихромата калия k2Cr2o7 с определенной массовой долей
- •Опыт 2. Приготовление растворов серной кислоты заданной молярной и нормальной концентраций
- •Опыт 3. Определение концентрации кислоты методом титрования
- •Работа № 6 Свойства растворов электролитов
- •Опыт 1. Исследование электропроводности растворов различных веществ
- •Опыт 2. Изучение зависимости степени диссоциации веществ в растворах от их концентрации
- •При сдаче лабораторной работы ответить на следующие вопросы
- •Работа №7 гидролиз
- •Опыт 1. Гидролиз солей, образованных различными по силе основанием и кислотой
- •Опыт 2. Ступенчатый гидролиз солей, образованных различными по силе основанием и кислотой
- •Опыт 3. Гидролиз солей, образованных слабым основанием и слабой летучей кислотой. Полный необратимый гидролиз
- •Количественные характеристики процесса гидролиза
- •Факторы, влияющие на степень гидролиза
- •Работа № 8 окислительно–восстановительные процессы
- •Опыт 1. Сравнительная характеристика окислительных свойств галогенов и восстановительной способности галогенидов
- •Опыт 2. Окислительно–восстановительные свойства соединений, содержащих элементы в различных степенях окисления.
- •Опыт 3. Окислительно–восстановительные свойства пероксида водорода.
- •Опыт 4б. Влияние концентрации кислоты на процесс окисления цинка серной кислотой
- •Опыт 5. Окисление меди разбавленной и концентрированной азотной кислотой
- •Опыт 6. Влияние среды на протекание окислительно–восстановительных реакций.
- •Типы овр
- •Опыт 8. Каталитическое диспропорционирование пероксида водорода.
- •Опыт 9. Реакция внутримолекулярного окисления–восстановления перманганата калия.
- •Опыт 10. Реакция межмолекулярного окисления восстановления между иодидом и иодатом калия.
- •Контрольные задания
- •Работа № 9 электрохимические процессы Химические источники тока. Опыт 1. Изготовление гальванического элемента и расчет его эдс.
- •Коррозия металлов.
- •Опыт 2. Влияние образования гальванических пар на течение химических процессов.
- •Опыт 3. Коррозия оцинкованного и луженого железа.
- •Электролиз водных растворов солей
- •Опыт 4. Электролиз раствора сульфата натрия.
- •Опыт 5. Электролиз раствора иодида калия.
- •Опыт 6. Электролиз раствора хлорида олова.
- •Опыт 7. Электролиз раствора сульфата меди.
- •Опыт 8. Электролиз раствора сульфата меди с активным (медным) анодом.
- •Работа № 10 получение комплексных соединений, изучение их свойств и методов разрушения
- •Опыт 1. Зависимость окраски аквакомплексов от типа комплексообразователя
- •Опыт 2. Зависимость окраски комплексов кобальта от типа лигандов
- •Опыт з. Ступенчатая диссоциация бромидных комплексов меди(II)
- •Получение комплексных соединений. Написание уравнений комплексообразования. Названия.
- •Опыт 4. Получение аммиаката никеля
- •Опыт 6. Получение соединения, содержащего комплексные катион и анион
- •Опыт 7. Влияние природы d–элемента на комплексообразование
- •Устойчивость комплексных соединений
- •Константы нестойкости некоторых комплексных ионов
- •Опыт 8. Влияние концентрации раствора на устойчивость комплексных соединений
- •Опыт 9. Сравнительная устойчивость хлоридных комплексов цинка и кобальта
- •Опыт 10. Сравнительная устойчивость роданидного и фторидного комплексов железа
- •Опыт 11. Разрушение комплексов
- •При сдаче лабораторной работы ответить на следующие вопросы
- •Плотность водных растворов k2Cr2o7
- •Константы диссоциации воды и некоторых слабых кислот и оснований в водных растворах при 18 c
- •Области перехода некоторых индикаторов
- •Степень гидролиза солей (в 0,1 м растворах при 25c)
- •Константы нестойкости некоторых комплексных ионов
- •Растворимость некоторых солей и оснований в воде
- •Приборы и реактивы
- •Содержание
Работа № 9 электрохимические процессы Химические источники тока. Опыт 1. Изготовление гальванического элемента и расчет его эдс.
Гальванические элементы – это химические источники тока. Они состоят из двух электродов первого рода (металлов, опущенных в растворы собственных солей), соединенных во внешней и внутренней цепях. Рассмотрим элемент, состоящий из металлического цинка, погруженного в 0,1 М раствор нитрата цинка, и металлического свинца, погруженного в 0,02 М раствор нитрата свинца. Схема рассматриваемого гальванического элемента :
( –)ZnZn(NO3)2(0,1M)Pb(NO3)2(0,02M)Pb
(+)
–)ZnZn(NO3)2(0,1M)Pb(NO3)2(0,02M)Pb
(+)
анод катод
Поскольку цинк стоит левее в ряду напряжений и является более активным металлом, он окисляется
Zn – 2e = Zn2+, т.е. этот электрод он является анодом.
На свинцовом электроде ( Pb Zn) происходит восстановление ионов Pb2+ + 2e = Pb, т.е. он служит катодом. За счет протекания окислительно-восстановительной реакции возникает электрический ток. Если во внешнюю цепь включить вольтметр, то он покажет определенную разность потенциалов.
ЭДС гальванического элемента рассчитывается как разность электродных потенциалов катода и анода:
Εг.э. = катода – анода
Чтобы определить ЭДС гальванического элемента, необходимо вычислить электродные потенциалы катода и анода. Для этого в табл. П3.7 находим значения стандартных электродных потенциалов систем: φ0Zn2+/Zn = – 0,76 B и φ0Pb2+/Pb = –0,13 В, затем рассчитываем значения по уравнению Нернста:
![]()
![]()
![]()
![]()
Находим ЭДС элемента:
![]()
Выполнение опыта. Собрать гальванический элемент в соответствии со схемой
Zn ZnSO4 CuSO4 Cu
Для этого налить в два стаканчика (рис.) 1М растворы солей: в один сульфата цинка, в другой – сульфата меди, опустить пластинки Zn в ZnSO4 и Cu в CuSO4.
Растворы соединить электролитическим мостиком, наполненным раствором NaCl в агар-агаре. Обе пластины соединить тонким проводником с гальванометром. Наблюдать отклонение стрелки гальванометра.
Записать схемы протекающих процессов, данные гальванометра и нарисовать гальванический элемент. Что произойдет, если убрать электролитический мостик? Объяснить происходящие явления.
Рассчитать ЭДС гальванических элементов:
1) Zn 1M ZnSO4 0,01M АgNO3 Ag;
2) Zn 0,1M ZnSO4 1M CuSO4 Cu;
3) Zn 1M ZnSO4 0,01M ZnSO4 Zn.
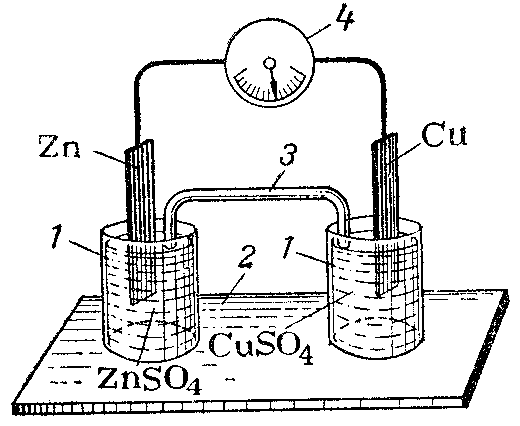
Рис 8. Гальванический элемент:
1 – стаканчики с растворами ZnSO4 и CuSO4;
2 – подставка под прибор;
3 – гальванический (электролитический) мостик;
4 – гальванометр.
Коррозия металлов.
Если в месте контакта двух металлов появляется электролит, возникает гальваническая пара, являющаяся причиной коррозии. Рассмотрим коррозию оцинкованного железа в кислой среде. Схема возникающей пары: Fe / HCl /Zn .Цинк, как более активный металл, окисляется и является анодом, а железо – катодом. Следовательно, тип покрытия – анодное. Происходящие процессы на аноде: Zn – 2e = Zn2+
на железном катоде: 2H++2e = H2
Если покрытие выполнено из менее активного металла – покрытие катодное и при его нарушении происходит разрушение покрываемого металла. Рассмотрим коррозию в нейтральной среде никеля в контакте с серебром. Возникает гальваническая пара Ni / H2O /Ag. Никель, как более активный металл окисляется Ni – 2e = Ni 2+ и является анодом. На серебряном катоде происходит процесс восстановления воды с выделением водорода: 2Н2О + 2e = Н2 + 2ОН– .
Суммарный процесс: Ni + 2 Н2О = Ni(ОН)2 + Н2 ↑
