
- •В.И. Гребенькова, н.Г. Осипенкова, Голубская и.Э., Козлова е.Е. Методические указания к лабораторному практикуму по курсу «Химия»
- •Работа № 1 свойства неорганических соединений различных классов
- •Названия кислотных остатков различных кислот
- •Опыт 1. Изучение окраски индикаторов в различных средах
- •Опыт 2. Оксиды и гидроксиды активных металлов
- •Опыт 3. Оксиды и гидроксиды неметаллов
- •Опыт 3. Изучение свойств оксидов и гидроксидов металлов
- •Опыт 3а). Изучение свойств оксида меди.
- •Опыт 3б. Получение и разложение гидроксида меди
- •Опыт 4. Изучение свойств гидроксидов металлов
- •Опыт 5. Изучение химической активности кислот
- •Опыт 6. Получение малорастворимых кислот и оснований
- •Опыт 7. Получение слабодиссоциирующих оснований и кислот
- •Примеры сильных и слабых оснований
- •Опыт 8. Реакция нейтрализации
- •Опыт 9. Свойства солей
- •Опыт 9а) Взаимодействие солей с кислотами
- •Опыт 10а). Получение солей методом нейтрализации и их взаимодействия
- •Опыт 10б). Получение малорастворимых солей
- •Опыт 11. Качественные реакции на хлорид-, сульфат- и фосфат-ионы
- •Опыт 12. Исследование окраски некоторых катионов и анионов
- •Работа № 2 скорость химических реакций.
- •Опыт 1. Зависимость скорости реакции от концентрации реагирующих веществ
- •Опыт 2. Влияние температуры на скорость химической реакции
- •Опыт 3. Влияние катализатора на скорость химической реакции
- •Работа № 3 Химическое равновесие
- •Опыт 1. Равновесие в растворе хлорида меди
- •Смещение химического равновесия
- •Опыт 2. Влияние концентрации веществ на смещение равновесия обратимой реакции
- •Опыт 3. Влияние температуры на химическое равновесие
- •Опыт 4. Влияние реакции среды на смещение химического равновесия.
- •Бихромат-ион (оранжевый)
- •Работа № 4 Процессы, протекающие при образовании растворов
- •Опыт 1. Изменение температуры при растворении
- •Опыт 2. Изменение объема при растворении
- •Опыт 3. Изменение окраски при растворении
- •Опыт 4.Влияние типа растворителя на процесс растворения.
- •Опыт 5. Зависимость растворимости солей от температуры. Получение пересыщенных растворов
- •При сдаче лабораторной работы ответьте на следующие вопросы
- •Работа № 5 Приготовление растворов заданной концентрации
- •Опыт 1. Приготовление раствора бихромата калия k2Cr2o7 с определенной массовой долей
- •Опыт 2. Приготовление растворов серной кислоты заданной молярной и нормальной концентраций
- •Опыт 3. Определение концентрации кислоты методом титрования
- •Работа № 6 Свойства растворов электролитов
- •Опыт 1. Исследование электропроводности растворов различных веществ
- •Опыт 2. Изучение зависимости степени диссоциации веществ в растворах от их концентрации
- •При сдаче лабораторной работы ответить на следующие вопросы
- •Работа №7 гидролиз
- •Опыт 1. Гидролиз солей, образованных различными по силе основанием и кислотой
- •Опыт 2. Ступенчатый гидролиз солей, образованных различными по силе основанием и кислотой
- •Опыт 3. Гидролиз солей, образованных слабым основанием и слабой летучей кислотой. Полный необратимый гидролиз
- •Количественные характеристики процесса гидролиза
- •Факторы, влияющие на степень гидролиза
- •Работа № 8 окислительно–восстановительные процессы
- •Опыт 1. Сравнительная характеристика окислительных свойств галогенов и восстановительной способности галогенидов
- •Опыт 2. Окислительно–восстановительные свойства соединений, содержащих элементы в различных степенях окисления.
- •Опыт 3. Окислительно–восстановительные свойства пероксида водорода.
- •Опыт 4б. Влияние концентрации кислоты на процесс окисления цинка серной кислотой
- •Опыт 5. Окисление меди разбавленной и концентрированной азотной кислотой
- •Опыт 6. Влияние среды на протекание окислительно–восстановительных реакций.
- •Типы овр
- •Опыт 8. Каталитическое диспропорционирование пероксида водорода.
- •Опыт 9. Реакция внутримолекулярного окисления–восстановления перманганата калия.
- •Опыт 10. Реакция межмолекулярного окисления восстановления между иодидом и иодатом калия.
- •Контрольные задания
- •Работа № 9 электрохимические процессы Химические источники тока. Опыт 1. Изготовление гальванического элемента и расчет его эдс.
- •Коррозия металлов.
- •Опыт 2. Влияние образования гальванических пар на течение химических процессов.
- •Опыт 3. Коррозия оцинкованного и луженого железа.
- •Электролиз водных растворов солей
- •Опыт 4. Электролиз раствора сульфата натрия.
- •Опыт 5. Электролиз раствора иодида калия.
- •Опыт 6. Электролиз раствора хлорида олова.
- •Опыт 7. Электролиз раствора сульфата меди.
- •Опыт 8. Электролиз раствора сульфата меди с активным (медным) анодом.
- •Работа № 10 получение комплексных соединений, изучение их свойств и методов разрушения
- •Опыт 1. Зависимость окраски аквакомплексов от типа комплексообразователя
- •Опыт 2. Зависимость окраски комплексов кобальта от типа лигандов
- •Опыт з. Ступенчатая диссоциация бромидных комплексов меди(II)
- •Получение комплексных соединений. Написание уравнений комплексообразования. Названия.
- •Опыт 4. Получение аммиаката никеля
- •Опыт 6. Получение соединения, содержащего комплексные катион и анион
- •Опыт 7. Влияние природы d–элемента на комплексообразование
- •Устойчивость комплексных соединений
- •Константы нестойкости некоторых комплексных ионов
- •Опыт 8. Влияние концентрации раствора на устойчивость комплексных соединений
- •Опыт 9. Сравнительная устойчивость хлоридных комплексов цинка и кобальта
- •Опыт 10. Сравнительная устойчивость роданидного и фторидного комплексов железа
- •Опыт 11. Разрушение комплексов
- •При сдаче лабораторной работы ответить на следующие вопросы
- •Плотность водных растворов k2Cr2o7
- •Константы диссоциации воды и некоторых слабых кислот и оснований в водных растворах при 18 c
- •Области перехода некоторых индикаторов
- •Степень гидролиза солей (в 0,1 м растворах при 25c)
- •Константы нестойкости некоторых комплексных ионов
- •Растворимость некоторых солей и оснований в воде
- •Приборы и реактивы
- •Содержание
Опыт 4. Электролиз раствора сульфата натрия.
Выполнение опыта. U-образную трубку электролизера (рис. ), закрепленную на штативе заполнить 2 н. раствором Na2SO4, добавить в оба отверстия электролизера по 3 – 4 капли нейтрального раствора лакмуса, опустить чистые графитовые электроды и подключить их через выпрямитель к сети. Установить напряжение 5 – 15В. Электрический ток пропускать в течение 5 – 6 мин. Наблюдать выделение газов и изменение окраски индикатора в катодном и анодном пространствах.
Очевидно, что при электролизе водного раствора соли, например Na2SO4, на катоде разряжаются не ионы Na+ , а ионы водорода образуя молекулы Н2 поскольку потенциал системы Na+ + ē = Na составляет –2,7 В, а потенциал системы H+ + ē = H в нейтральной среде составляет –0,41 В. На аноде происходит выделение кислорода ( 0 = 0,82 В). Потенциал разряда иона SO42– ( 0 = +2,01 В) имеет большое положительное значение, поэтому сульфат-ионы из водных растворов не разряжаются. Процесс сводится, таким образом, к электролизу воды; ионы Na+ и SO42- наряду с остальными ионами раствора принимают участие только в переносе электрического тока в растворе. Количество Na2SO4 при электролизе остается неизменным.
Составить уравнения катодного и анодного процессов. Нарисовать установку для электролиза растворов.
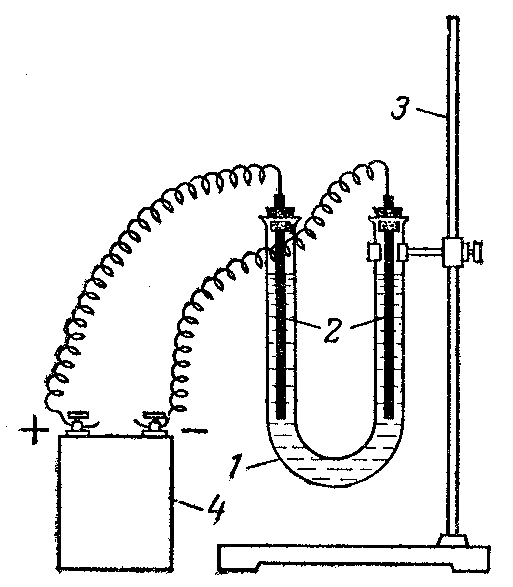
Рис. 9. Установка для электролиза растворов:
1 – электролизер;
2 – графитовые электроды;
3 – штатив;
4 – источник тока или выпрямитель.
Опыт 5. Электролиз раствора иодида калия.
Выполнение опыта. Заполнить электролизер 2 н. раствором KI, вставить графитовые электроды и через выпрямитель подключить их к сети. Пропускать электрический ток при напряжении 5 – 15 В в течение нескольких минут. Отметить изменения на электродах. Затем отключить электроды и добавить в катодное пространство 2 – 3 капли фенолфталеина, а в анодное пространство около 1 мл крахмального клейстера. Подключить электроды к сети и еще несколько минут пропускать электрический ток. Отметить изменения. Объяснить появление малиновой окраски раствора в катодном и синей – в анодном пространствах.
Составить уравнения катодного и анодного процессов.
Опыт 6. Электролиз раствора хлорида олова.
Электролизер заполнить 2 н. раствором хлорида олова, вставить графитовые электроды, через выпрямитель подключить их к сети и пропускать ток в течение 10 мин. На катоде наблюдать появление кристаллов олова, на аноде – выделение хлора. Отключить электроды от сети. Выделение хлора доказать следующим образом: смоченную водой йод-крахмальную бумажку поднести к отверстию анодного пространства электролизера и наблюдать появление синей окраски. Написать уравнение реакции, объясняющее появление синего окрашивания.
Записать уравнения катодного и анодного процессов.
Опыт 7. Электролиз раствора сульфата меди.
Выполнение опыта. Электролизер заполнить 2 н. раствором сульфата меди, вставить графитовые электроды, через выпрямитель подключить их к сети и пропускать ток в течение 10 мин. На катоде наблюдать появление налета меди, на аноде – выделение кислорода. Отключить электроды от сети и в анодное пространство добавить несколько капель нейтрального лакмуса. Чем объяснить появление красного окрашивания?
Записать уравнения катодного и анодного процессов. Омедненный электрод оставить для опыта 8.
