
- •В.И. Гребенькова, н.Г. Осипенкова, Голубская и.Э., Козлова е.Е. Методические указания к лабораторному практикуму по курсу «Химия»
- •Работа № 1 свойства неорганических соединений различных классов
- •Названия кислотных остатков различных кислот
- •Опыт 1. Изучение окраски индикаторов в различных средах
- •Опыт 2. Оксиды и гидроксиды активных металлов
- •Опыт 3. Оксиды и гидроксиды неметаллов
- •Опыт 3. Изучение свойств оксидов и гидроксидов металлов
- •Опыт 3а). Изучение свойств оксида меди.
- •Опыт 3б. Получение и разложение гидроксида меди
- •Опыт 4. Изучение свойств гидроксидов металлов
- •Опыт 5. Изучение химической активности кислот
- •Опыт 6. Получение малорастворимых кислот и оснований
- •Опыт 7. Получение слабодиссоциирующих оснований и кислот
- •Примеры сильных и слабых оснований
- •Опыт 8. Реакция нейтрализации
- •Опыт 9. Свойства солей
- •Опыт 9а) Взаимодействие солей с кислотами
- •Опыт 10а). Получение солей методом нейтрализации и их взаимодействия
- •Опыт 10б). Получение малорастворимых солей
- •Опыт 11. Качественные реакции на хлорид-, сульфат- и фосфат-ионы
- •Опыт 12. Исследование окраски некоторых катионов и анионов
- •Работа № 2 скорость химических реакций.
- •Опыт 1. Зависимость скорости реакции от концентрации реагирующих веществ
- •Опыт 2. Влияние температуры на скорость химической реакции
- •Опыт 3. Влияние катализатора на скорость химической реакции
- •Работа № 3 Химическое равновесие
- •Опыт 1. Равновесие в растворе хлорида меди
- •Смещение химического равновесия
- •Опыт 2. Влияние концентрации веществ на смещение равновесия обратимой реакции
- •Опыт 3. Влияние температуры на химическое равновесие
- •Опыт 4. Влияние реакции среды на смещение химического равновесия.
- •Бихромат-ион (оранжевый)
- •Работа № 4 Процессы, протекающие при образовании растворов
- •Опыт 1. Изменение температуры при растворении
- •Опыт 2. Изменение объема при растворении
- •Опыт 3. Изменение окраски при растворении
- •Опыт 4.Влияние типа растворителя на процесс растворения.
- •Опыт 5. Зависимость растворимости солей от температуры. Получение пересыщенных растворов
- •При сдаче лабораторной работы ответьте на следующие вопросы
- •Работа № 5 Приготовление растворов заданной концентрации
- •Опыт 1. Приготовление раствора бихромата калия k2Cr2o7 с определенной массовой долей
- •Опыт 2. Приготовление растворов серной кислоты заданной молярной и нормальной концентраций
- •Опыт 3. Определение концентрации кислоты методом титрования
- •Работа № 6 Свойства растворов электролитов
- •Опыт 1. Исследование электропроводности растворов различных веществ
- •Опыт 2. Изучение зависимости степени диссоциации веществ в растворах от их концентрации
- •При сдаче лабораторной работы ответить на следующие вопросы
- •Работа №7 гидролиз
- •Опыт 1. Гидролиз солей, образованных различными по силе основанием и кислотой
- •Опыт 2. Ступенчатый гидролиз солей, образованных различными по силе основанием и кислотой
- •Опыт 3. Гидролиз солей, образованных слабым основанием и слабой летучей кислотой. Полный необратимый гидролиз
- •Количественные характеристики процесса гидролиза
- •Факторы, влияющие на степень гидролиза
- •Работа № 8 окислительно–восстановительные процессы
- •Опыт 1. Сравнительная характеристика окислительных свойств галогенов и восстановительной способности галогенидов
- •Опыт 2. Окислительно–восстановительные свойства соединений, содержащих элементы в различных степенях окисления.
- •Опыт 3. Окислительно–восстановительные свойства пероксида водорода.
- •Опыт 4б. Влияние концентрации кислоты на процесс окисления цинка серной кислотой
- •Опыт 5. Окисление меди разбавленной и концентрированной азотной кислотой
- •Опыт 6. Влияние среды на протекание окислительно–восстановительных реакций.
- •Типы овр
- •Опыт 8. Каталитическое диспропорционирование пероксида водорода.
- •Опыт 9. Реакция внутримолекулярного окисления–восстановления перманганата калия.
- •Опыт 10. Реакция межмолекулярного окисления восстановления между иодидом и иодатом калия.
- •Контрольные задания
- •Работа № 9 электрохимические процессы Химические источники тока. Опыт 1. Изготовление гальванического элемента и расчет его эдс.
- •Коррозия металлов.
- •Опыт 2. Влияние образования гальванических пар на течение химических процессов.
- •Опыт 3. Коррозия оцинкованного и луженого железа.
- •Электролиз водных растворов солей
- •Опыт 4. Электролиз раствора сульфата натрия.
- •Опыт 5. Электролиз раствора иодида калия.
- •Опыт 6. Электролиз раствора хлорида олова.
- •Опыт 7. Электролиз раствора сульфата меди.
- •Опыт 8. Электролиз раствора сульфата меди с активным (медным) анодом.
- •Работа № 10 получение комплексных соединений, изучение их свойств и методов разрушения
- •Опыт 1. Зависимость окраски аквакомплексов от типа комплексообразователя
- •Опыт 2. Зависимость окраски комплексов кобальта от типа лигандов
- •Опыт з. Ступенчатая диссоциация бромидных комплексов меди(II)
- •Получение комплексных соединений. Написание уравнений комплексообразования. Названия.
- •Опыт 4. Получение аммиаката никеля
- •Опыт 6. Получение соединения, содержащего комплексные катион и анион
- •Опыт 7. Влияние природы d–элемента на комплексообразование
- •Устойчивость комплексных соединений
- •Константы нестойкости некоторых комплексных ионов
- •Опыт 8. Влияние концентрации раствора на устойчивость комплексных соединений
- •Опыт 9. Сравнительная устойчивость хлоридных комплексов цинка и кобальта
- •Опыт 10. Сравнительная устойчивость роданидного и фторидного комплексов железа
- •Опыт 11. Разрушение комплексов
- •При сдаче лабораторной работы ответить на следующие вопросы
- •Плотность водных растворов k2Cr2o7
- •Константы диссоциации воды и некоторых слабых кислот и оснований в водных растворах при 18 c
- •Области перехода некоторых индикаторов
- •Степень гидролиза солей (в 0,1 м растворах при 25c)
- •Константы нестойкости некоторых комплексных ионов
- •Растворимость некоторых солей и оснований в воде
- •Приборы и реактивы
- •Содержание
Опыт 1. Сравнительная характеристика окислительных свойств галогенов и восстановительной способности галогенидов
Галогены в свободном
состоянии являются типичными окислителями.
Снизу вверх по группе в соответствии с
электроотрицательностью их окислительная
активность усиливается
![]()
Однако, каждый из них, за исключением фтора, может быть окислен более сильным окислителем: йод можно окислить бромом и хлором, бром можно окислить хлором, но нельзя – йодом.
Галогенид - ионы содержат элементы в низшей степени окисления и в ОВР могут быть только восстановителями. Их восстановительная активность повышается сверху вниз по группе.
|
|
Окисление
галогенид-ионов
![]() происходит в разных средах в соответствии
со схемой:
происходит в разных средах в соответствии
со схемой:

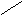 H+,
H2O
Г
2
H+,
H2O
Г
2
 Г-
Г-
O H-
ГO3-
H-
ГO3-
Галогены лучше растворяются в неполярных органических растворителях (бензоле, четыреххлористом углероде), поэтому реакции, сопровождающиеся выделением свободных галогенов, проводят в присутствии органических растворителей.
Опыт 1а). Взаимодействие хлора с бромидами и иодидами.
Выполнение опыта. В две пробирки поместить по 3 – 4 капли растворов: в одну – бромида калия, в другую – иодида калия. В обе пробирки добавить по 5 – 7 капель хлорной воды. Отметить признаки течения реакции (изменение окраски растворов, выпадение осадка). К содержимому пробирок добавить по 3 – 4 капли бензола или четыреххлористого углерода и тщательно перемешать. Отметить распределение окрашенного вещества между водным слоем и слоем органического растворителя.
Написать уравнения соответствующих реакций взаимодействия хлора с бромидом и иодидом калия. Выделение каких веществ обусловливает изменение окраски растворов? Сравнить растворимость свободных галогенов в воде и органическом растворителе и соответствие правилу: «подобное растворяется в подобном». Какую функцию выполняют хлор, бромид – и иодид–ионы в окислительно–восстановительных процессах?
Опыт 1б). Взаимодействие брома с хлоридами и иодидами.
Выполнение опыта. В две пробирки поместить по 3 – 4 капли растворов: в одну – хлорида натрия, в другую – иодида калия. В обе пробирки добавить по 3 – 4 капли бромной воды (избегать избытка бромной воды) и такое же количество бензола или четыреххлористого углерода. Содержимое пробирок встряхнуть. Отметить признаки течения реакций. Почему не происходит обесцвечивание брома в первой пробирке? Написать уравнение реакции, протекающей во второй пробирке. Указать роль брома в окислительно–восстановительном процессе. Будут ли протекать реакции при действии на йод хлоридов, бромидов? Объяснить взаимное поведение галогенов путем сравнения энергий сродства к электрону и значений их электроотрицательностей.
Выписать галогены в порядке возрастания их окислительной активности.
Опыт 1в). Взаимодействие йода с сероводородной и хлорной водой.
Выполнение опыта. В две пробирки внести по 2 капли йодной воды. В одну пробирку добавить 3 капли хлорной воды, в другую – 3 капли сероводородной воды. Наблюдать в обоих случаях обесцвечивание йода, а во второй пробирке – одновременное выпадение осадка серы.
Написать уравнения соответствующих реакций, учитывая, что в результате реакции йода с хлором в присутствии воды образуется HIO3. Какую роль выполняет йод в обеих реакциях?
