
- •Министерство образования и науки
- •Общие правила работы в лаборатории
- •Структура отчёта о лабораторных работах
- •Лабораторная работа №1 определение молярной массы эквивалента (эквивалентной массы) металла по объему вытесненного водорода
- •Методика выполнения работы
- •Контрольные вопросы
- •Лабораторная работа №2 зависимость свойств элементов от их положения в периодической системе д.И. Менделеева
- •Методика выполнения работы
- •Контрольные вопросы
- •Лабораторная работа №3 определение тепловых эффектов химических процессов
- •Методика выполнения работы
- •Результаты измерений
- •Результаты измерений
- •Контрольные вопросы
- •Лабораторная работа №4 приготовление растворов
- •Методика выполнения работы
- •Соотношения массовых долей и плотностей раствора hCl (20єС)
- •Результаты расчетов
- •Плотность водного раствора сульфата никеля при температуре 18 °с
- •Результаты расчетов
- •Контрольные вопросы
- •Лабораторная работа №5 определение молекулярной массы вещества криоскопическим методом
- •Методика выполнения работы
- •Результаты опыта
- •Контрольные вопросы
- •Лабораторная работа №6 скорость химических реакций и химическое равновесие
- •Методика выполнения работы
- •Результаты опыта
- •1/3 2/3 1,0 С, моль/л
- •Результаты опыта
- •Результаты опыта
- •Результаты опыта
- •Контрольные вопросы
- •Лабораторная работа №7 водородный показатель среды. Гидролиз солей
- •Методика выполнения
- •Результаты опыта
- •Контрольные вопросы
- •Контрольные вопросы
- •Лабораторная работа № 9 получение и изучение свойств комплексных соединений
- •Методика выполнения работы
- •Контрольные вопросы
- •Лабораторная работа № 10 окислительно-восстановительные реакции
- •Методика выполнения Окислители и восстановители, окислительно-восстановительная двойственность
- •Типы окислительно-восстановительных реакций
- •Направление окислительно-восстановительных реакций
- •Контрольные вопросы
- •Лабораторная работа № 11 гальванический элемент
- •Методика выполнения
- •Результаты опытов
- •Контрольные вопросы
- •Лабораторная работа № 12 коррозия металлов и защита от неё
- •Методика выполнения
- •Контрольные вопросы
- •Лабораторная работа № 13 электролиз растворов электролитов
- •Методика выполнения работы
- •Контрольные вопросы
- •Лабораторная работа №14 способы водоподготовки
- •Методика выполнения Умягчение воды
- •Контрольные вопросы
- •Лабораторная работа №15 органические вещества и полимеры
- •Методика выполнения Получение и свойства алифатических углеводородов
- •Характерные реакции кислородсодержащих органических соединений
- •Получение полимеров
- •Контрольные вопросы
- •Содержание
Контрольные вопросы
1. Что называется электролизом?
2. В чём различие процесса электролиза с растворимым и нерастворимым анодом?
3. Какой металл будет выделяться последним при электролизе раствора, содержащего К2SO4, СгС13, Fе2(SO4)3, Hg2(NO3)2, РЬ(NО3)2, если напряжение является достаточным?
4. Какой из металлов не будет выделятся из водных растворов: NiCl, CuCl2, CdCl2, CaCl2, СoCl2?
5. Какой из металлов в первую очередь будет выделяться из раствора его соли, если напряжение является достаточным для выделения этих металлов:
Fe, Си, Ag, Ni, Mn?
6. Приведите пример, когда при электролизе расплава электролита на аноде выделяется водород.
7. Какие законы количественно описывают процессы, протекающие при электролизе?
Лабораторная работа №14 способы водоподготовки
Ц е л ь р а б о т ы: познакомиться с методами умягчения и обессоливания воды, получить практические навыки определения жёсткости воды, познакомиться с методами комплексoно-метрического титрования и кондуктометрического определения солесодержания.
О б о р у д о в а н и е и м а т е р и а л ы: бюретка для титрования, конические колбы, штатив, титрованный раствор трилона Б, аммиачно-буферный раствор, проба жёсткой воды, титрованный раствор соляной кислоты, индикаторы (метилоранж, эриохром чёрный Т), колонка с катионитом КУ-1 в Na-форме, колонка с катионитом КУ-1 в Н-форме, колонка с анионитом АН-1 в ОН-форме, кондуктометр.
Методика выполнения Умягчение воды
Опыт №1. Определение временной жёсткости
Временная жёсткость определяется путём титрования пробы воды раствором соляной кислоты. Для этого необходимо отмерить мерным цилиндром в две конические колбы по 50 см3 воды и, прибавив к каждой по 2 капли индикатора (метилоранжа), оставить одну для контроля, а во вторую приливать по каплям из бюретки 0,1 М раствор НС1 до тех пор, пока окраска метилоранжа из жёлтой резко перейдёт в оранжевую. Расчёт временной жёсткости Жвр, моль/дм3, производится по формуле
 Жвр.=
Жвр.=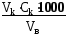 ,
,
где Vк – объём кислоты, пошедший на титрование, см3 ;
Ск – молярная концентрация раствора кислоты, моль/дм3;
Vв– объём пробы воды, см3.
Опыт №2. Определение общей жёсткости
Общую жёсткость определяют титрованием пробы воды раствором трилона Б в присутствии индикатора – эриохром чёрного Т. Наиболее точный результат получается при рН=8ч11, поэтому для создания такой среды прибавляют в пробирку аммиачно-буферную смесь (NH4ОH+NH4C1).
Для этого взять 50 см3 воды, прибавить 5 см3 буферной смеси, 5–6 капель индикатора и титровать раствором трилона Б известной концентрации до перехода окраски из розово-красной в зеленовато-синюю.
Расчёт общей жёсткости ведут по формуле
Жобщ.=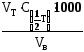 ,
ммоль/дм3
,
ммоль/дм3
где VT – объём раствора трилона Б, пошедший на титрование пробы, см3 ;
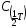 –молярная
концентрация эквивалента раствора
трилона Б, моль/дм3;
–молярная
концентрация эквивалента раствора
трилона Б, моль/дм3;
VВ – объём пробы воды, см3.
Постоянную жёсткость Жпост, ммоль/дм3, определяют по разности:
Жпост=Жобщ - Жвр .
Опыт №3. Уменьшение жёсткости с помощью катионитной обработки воды
Пробу воды, для которой определена временная и постоянная жёсткости, пропустить через колонку с катионитом КУ-1 4–5 раз. После катионитной обработки воды определить её временную и постоянную жёсткости. Делают вывод относительно эффективности этого процесса.
Опыт №4. Обессоливание воды с помощью ионитной обработки воды
Через катионит КУ-1 в Н-форме пропустить 100 мл водопроводной воды, предварительно замерив кондуктометром ее электропроводность л0. Замерить электропроводность фильтрата 1 с помощью кондуктометра л1. После того, как вся вода стечет с катионита, отфильтровать ее через слой анионита, собирая фильтрат 2 в другую колбу с последующим замером его электропроводности л2. Повторить цикл из последовательного прохождения обессоливаемого образца воды еще раз. Сделать вывод относительно эффективности процесса обессоливания.
