
- •Оглавление
- •3. Химическая кинетика и равновесие
- •3.1 Скорость химических процессов
- •2.2 Химическое равновесие
- •4 Растворы электролитов
- •4.1 Концентрация растворов
- •4.2. Электролитическая диссоциация.
- •4.3. Гидролиз солей
- •5. Окислительно-восстановительные процессы.
- •5.1 Окислительно-восстановительные реакции
- •5.2 Гальванические элементы
- •5.3 Электрохимическая коррозия металлов
- •5.4 Электролиз растворов
- •6. Варианты заданий
- •620144, Г.Екатеринбург,ул.Куйбышева,30
5.2 Гальванические элементы
Гальваническими элементами называют устройства, в которых энергия окислительно-восстановительных реакций преобразуется в электрическую энергию. В медно-цинковом гальваническом элементе электродвижущая сила (ЭДС) возникает за счёт разности потенциалов меди и цинка, опущенных в растворы своих солей: соответственно CuSO4 и ZnSO4. Если концентрации растворов составляют 1 моль/л, то расчет эдс производят следующим образом. Составляют схему гальванического элемента:
Zn │ZnSO4 ││ CuSO4 │Cu
Затем выписывают из таблицы стандартных электродных потенциалов значения потенциалов меди и цинка, соответственно
EoZn2+/Zn = -0,76 B ()
EoCu2+/Cu = +0,34 B ()
ЭДС можно рассчитать как разность потенциалов медного и цинкового электродов: ЭДС = Еox - Еred. Определяют окислитель и восстановитель, сравнивая значения потенциалов. Потенциал у цинка отрицательнее, следовательно, цинковый электрод будет играть роль восстановителя:
(-) Zn0 -2ē Zn2+ процесс окисления
и цинк будет отрицательным полюсом (анодом) в данном гальваническом элементе. Потенциал меди положительнее, поэтому медный электрод будет положительным полюсом (катодом), а процесс будет таким:
(+) Cu2+ + 2ē Cu0 процесс восстановления.
Направление движения электронов будет от цинка к меди (показано мостиком со стрелкой на электрохимической схеме гальванического элемента. ЭДС = +0,34 – (-0,78) = 1,1 В
Концентрационный гальванический элемент.
В таком элементе оба электрода из одного металла, но растворы солей, в которые погружены электроды, различной концентрации. Поэтому необходимо рассчитать потенциалы по уравнению Нернста:
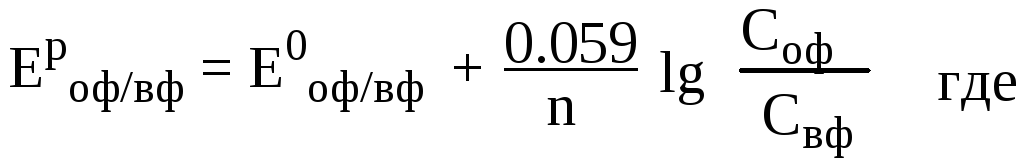
оф – окисленная форма элемента в потенциалопределяющей реакции,
вф – восстановленная форма элемента в этой реакции,
С – молярные концентрации соответствующих веществ,
n – количество электронов, перешедших от восстановителя к окислителю.
Пример 1. Рассчитать эдс гальванического элемента, состоящего из никелевых электродов, опущенных в растворы сульфата никеля с концентрацией 10-4 моль/л и 1 моль/л соответственно.
Решение:
Схема гальванического элемента:
Ni NiSO4, 0,0001 M NiSO4 1 MNi
Eo 2H+/H2 = -0,25 B
Определяем потенциал никеля по уравнению Нернста:
E Ni2+/Ni = Eo Ni2+/Ni + 0,059/2 lgCNi2+ = - 0,25 + 0,059/2lg10-4 = - 0,309 B
Направление движения электронов во внешней цепи от электрода с Е = -0,25 В к электроду с Е = -0,309В.
(-) Ni NiSO4, 0,0001 M NiSO4,1 MNi (+)
Уравнения электродных процессов:
(-) Ni0 -2ē → Ni2+ (процесс окисления)
(+) Ni2+ + 2ē → Ni0 (процесс восстановления)
Значение эдс составляет:
эдс = Еox - Еred = -0,25 – (-0,309) = 0,059 В.
Задания к подразделу 5.2
Для предложенных гальванических элементов рассчитайте электродные потенциалы и ЭДС. Если концентрация раствора не указана, потенциал считается стандартным из таблицы 1. Напишите уравнения анодного и катодного процессов, молекулярное уравнение токообразующей реакции, составьте схему и укажите направления движения электронов и ионов.
|
181 |
Al Al2(SO4)3, 0,005 M NiSO4, 0,01 M Ni |
|
182 |
Ni NiSO4, 0,1 M H2SO4 H2(Pt) |
|
183 |
Sn SnSO4 Cr2(SO4)3, 0,05 M Cr |
|
184 |
(Pt) H2 H2SO4 Al2(SO4)3, 0,005 MAl |
|
185 |
Cu CuSO4, 0,1 M H2SO4H2(Pt) |
|
186 |
Ag AgNO3, 0,01 M H2SO4H2(Pt) |
|
187 |
Co CoSO4, 0,01 M CoSO4Co |
|
188 |
Zn ZnSO4, 0,1 M FeSO4, 0,01 MFe |
|
189 |
Ag AgNO3, 0,01 M Zn(NO3)2Zn |
|
190 |
(Pt) H2 H2SO4 ZnSO4, 0,01 MZn |
|
191 |
Cd Cd(NO3)2, 0,1 M Cd(NO3)2, 0,001 MCd |
|
192 |
Ni NiSO4, 0,001 M NiSO4Ni |
|
193 |
Fe FeSO4 FeSO4, 0,01 MFe |
|
194 |
Cr Cr2(SO4)3, 0,005 M ZnSO4 Zn |
|
195 |
Zn Zn(NO3)2, 0,001 M Zn(NO3)2 Zn |
|
196 |
Ag AgNO3 Cr(NO3)3, 0,005 M Cr |
|
197 |
Cd CdCl2, 0,1 M CuCl2, 0,1 M Cu |
|
198 |
Ti Ti2(SO4)3, 0,5 M CuSO4Cu |
|
199 |
Sn SnSO4, 0,01 M Fe2(SO4)3Fe |
|
200 |
Ag AgNO3, 0,0001 M Pb(NO3)2, 0,1 M Pb |
