
- •Оглавление
- •3. Химическая кинетика и равновесие
- •3.1 Скорость химических процессов
- •2.2 Химическое равновесие
- •4 Растворы электролитов
- •4.1 Концентрация растворов
- •4.2. Электролитическая диссоциация.
- •4.3. Гидролиз солей
- •5. Окислительно-восстановительные процессы.
- •5.1 Окислительно-восстановительные реакции
- •5.2 Гальванические элементы
- •5.3 Электрохимическая коррозия металлов
- •5.4 Электролиз растворов
- •6. Варианты заданий
- •620144, Г.Екатеринбург,ул.Куйбышева,30
3. Химическая кинетика и равновесие
3.1 Скорость химических процессов
В зависимости от характера реакции скорость определяется следующим образом. Для гомогенных систем (однородным по составу и свойствам) скорость измеряется:
V
=
![]()
где V – скорость химической реакции, моль/л∙сек.
ΔC – изменение концентрации вещества за время Δτ = τ2 – τ1
τ1 – исходный момент времени, с,
τ2 – текущий момент времени, с (τ2 > τ1)
В гетерогенных системах (состоящих из 2х или более однородных частей, находящихся в разном фазовом состоянии) при определении скорости концентрации твердых веществ не учитываются. Скорость реакции зависит от природы реагирующих веществ, концентрации, температуры, давления и присутствия катализаторов.
Скорость химической реакции прямо пропорциональна произведению молярных концентраций реагирующих веществ.
Пример 1. H2 + Cl2 = 2HCl
V = k СH2СCl2
где k – константа скорости прямой реакции
СH2- концентрация водорода, моль/л
СCl2- концентрация хлора, моль/л
Концентрация веществ может обозначаться квадратными скобками, заключенными вокруг формулы вещества. Например, для этой реакции скорость прямой реакции можно записать так:
V = k [H2][Cl2]
Зависимость скорости реакции от температуры определяется правилом Вант-Гоффа: при повышении температуры на каждые 100 скорость большинства реакций увеличивается в 2-4 раза
![]()
где γ – температурный коэффициент скорости реакции, значения которого для большинства реакций лежит в интервале от 2 до 4.
ν2 - скорость реакции при температуре t2, oC
ν1 - скорость реакции при температуре t1, oC
Пример 2. Температурный коэффициент скорости реакции равен 2,8. Во сколько раз возрастёт скорость реакции при повышении температуры от 200 до 75 0С ?
Решение. t2 - t1 = 75 – 20 = 55 оС. Обозначив скорость реакции при 20о и 75о соответственно ν1 и ν2 получаем: ν2/ ν1 =2,855/10=2,85,5=287.
Скорость реакции увеличится в 287 раз.
2.2 Химическое равновесие
Состояние системы, при котором скорости прямой и обратной реакции равны, называют химическим равновесием. Состояние равновесия характеризуется константой равновесия Кс.
Гомогенная система:
2СО (г) + О2 = 2СО2 (г)
Кс=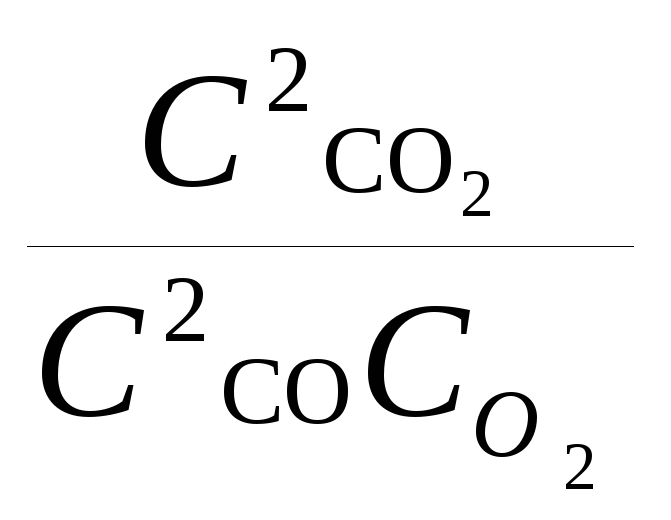
где Ссо; СО2; ССО2 – равновесные концентрации веществ, моль/л.
Гетерогенная система:
Fe2O3 (т) + 3Н2 (г) = 3Fe (т)+3Н2О (г)
Кс=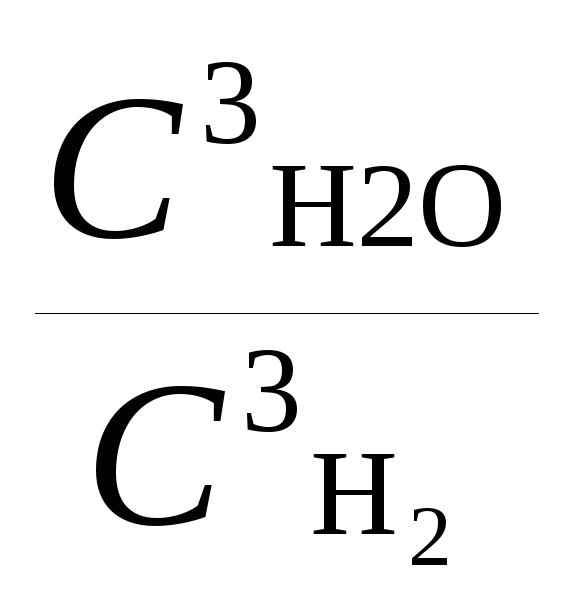
В выражении константы равновесия концентрация твердой фазы не входит, так как она является практически постоянной величиной.
На состояние равновесия системы влияют давление, концентрация реагирующих веществ и температура. Система может находиться в состоянии равновесия бесконечно долго. Если изменить условия его существования, равновесие будет нарушено. Переход из одного равновесного состояния в другое называют смещением равновесия. Определить направление смещения равновесия позволяет принцип Ле Шателье: если находящаяся в равновесии система подвергается внешнему воздействию, равновесие смещается в направлении, которое способствует ослаблению этого воздействия.
Пример. 1 Для реакции N2 (г)+ 3H2 (г) = 2NH3 (г) в какую сторону смещается равновесие если увеличить концентрацию аммиака и давление?
Решение: С увеличением концентрации аммиака равновесие смещается влево. С увеличением давления в этой системе равновесие смещается вправо.
Пример 2. В системе А(г)+2В(г)=С(г) равновесные концентрации равны Сра =0,06 моль/л, Срв =0,12 моль/л , Срс =0,216 моль/л . Найти константу равновесия реакции и исходные концентрации веществ А и В.
Решение: Константа равновесия выражается уравнением:
Кс=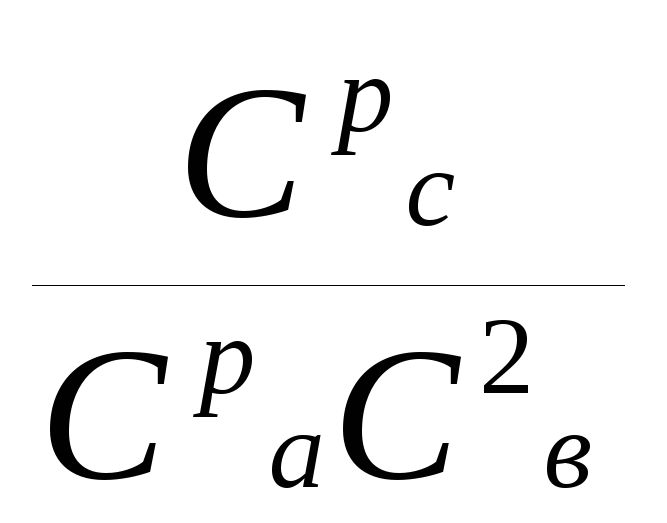 =
=![]() =
250
=
250
Для нахождения исходных концентраций веществ А и В следует учесть, что согласно уравнению реакции, из 1 моль А и 2 моль В образуется 1 моль С. Поскольку по условию задачи в каждом литре системы образовалось 0, 216 моль вещества С, то при этом было израсходовано 0,216 моль вещества А и 0,216*2 = 0,432 моль вещества В. Таким образом, искомые исходные концентрации равны:
Соа = 0,06+0,216=0,276 моль/л,
Сов = 0,12+0,432=0,552 моль/л.
Задания к разделу 2.
21. Напишите выражение для константы равновесия реакции:
Si + 2Н2О ↔ SiO2+2H2
22. Рассчитайте исходную концентрацию СО для реакции, если равновесные концентрации [CO]=0,01, [СОS] = 0,03 моль/л.
Sb2S3+3CO=2Sb+3COS
23. Температурный коэффициент скорости реакции равен 2,5. Во сколько раз увеличится скорость, если температуру повысить на 40°?
24. В какую сторону сдвинется равновесие системы C+2N2O ↔ CO2+2N2 если увеличить объём системы?
25. Как повлияет на равновесие реакции СаCO3 ↔ CaO+CO2 -179 кДж, понижение температуры?
26. Напишите выражение для константы равновесия реакции:
Fе2О3 +3CO ↔2Fe + ЗСО2
27. Чему равна начальная концентрация NО2, если в момент равновесия
концентрация NO была 0,3 моль/л , О2 – 0,15 моль/л, NO2 - 0,2 моль/л.
28. Во сколько раз изменится скорость химической реакции, если температуру понизили с 25° до -15о при температурном коэффициенте скорости 2?
29. Куда сдвинется равновесие реакции Н2 +J2 ↔ 2HJ при уменьшении объёма системы в 3 раза?
30. Куда сдвинете я равновесие реакции N2О4 ↔ 2NO2 -Q, если повысить температуру в системе?
31. Напишите выражение для константы равновесия реакции:
2N2O ↔ 2N2 + O2
32. Чему равна скорость реакции СuO + 2HNO3 = Сu(NО3)2 + Н2О при
концентрации 3 моль/л и константе скорости реакции К = 0,4 ?
33. Во сколько раз уменьшится скорость химической реакции при снижении температуры с 50 до 20 С°, если температурный коэффициент равен 3 ?
34. В какую сторону сдвинется равновесие реакции CO + Н2О ↔ СО2 + Н2 при увеличении давления?
35. В какую сторону сдвинется равновесие реакции 2С + О2 ↔ 2СО; ΔН0 = - 105 кДж при понижении температуры ?
36. Написать выражение для константы равновесия реакции:
2C2H4 (г) + 5O2 ↔ 4CO2 + 2H2O (пар)
37. Рассчитать начальную концентрацию кислорода для реакции, если равновесные концентрации кислорода равна 0,34 моль/л, а диоксида азота равна 0,72 моль/л.
2NO + O2 ↔ 2NO2
38. Температурный коэффициент скорости реакции равен 5. Во сколько раз увеличится скорость реакции, если температуру повысить с 800 до 1100С.
39. В какую сторону сдвинется равновесие реакции при уменьшении объёма системы: 2CO + O2 ↔ 2CO2
40. В системе: N2 + O2 ↔ 2NO ΔH0=180 кДж. Произошло повышение температуры. В какую сторону сдвинулось равновесие?
Задания 41-60 . Напишите математическое выражение Кс (константы химического равновесия) для обратимых реакций и укажите направление смещения равновесия при изменении условий:
А) уменьшении парциального давления одного из исходных газообразных веществ;
Б) понижении давления;
В) повышении температуры.
|
Номер задания |
Уравнение реакции |
ΔНо, кДж/моль |
|
41 |
2N2O (г) + O2 (г) = 4NO (г) |
196 |
|
42 |
4NH3 (г) + 5O2 (г) = 4NO (г) + 6H2O (г) |
908 |
|
43 |
2H2S (г) + 3O2 (г) = 2SO2 (г) + 2H2O (г) |
1038 |
|
44 |
CO2 (г) + H2 (г) = CO (г) + H2O (г) |
41 |
|
45 |
2H2 (г) + O2 (г) = 2H2O (г) |
-484 |
|
46 |
2SO2 (г) + O2 (г) = 2SO3 (г) |
-196 |
|
47 |
2NO (г) + O2 (г) = 2NO2 (г) |
-112 |
|
48 |
Fe3O4 + H2 (г) = 3FeO + H2O (г) |
62 |
|
49 |
FeO + H2 (г) = Fe + H2O (г) |
-272 |
|
50 |
C + H2O (г) = CO (г) + H2 (г) |
131 |
|
51 |
CO (г) + H2O (г) = CO2 (г) + H2 (г) |
-41 |
|
52 |
SO3 (г) + H2 (г) = SO2 (г) + H2O (г) |
-144 |
|
53 |
H2 (г) + Cl2 (г) = 2HCl (г) |
-184 |
|
54 |
FeO + CO (г) = Fe + CO2 (г) |
-11 |
|
55 |
2ZnS + 3O2 (г) = 2ZnO + 2SO2 (г) |
-878 |
|
56 |
N2 (г) + 3H2 (г) = 2NH3 (г) |
-92 |
|
57 |
CaCO3 = CaO + CO2 (г) |
175 |
|
58 |
2MgCl2 + 2O2 (г) = 2MgO + 2Cl2 (г) |
82 |
|
59 |
Ca(OH)2 (т) = CaO (т) + H2O (г) |
48 |
|
60 |
H2O (г) +CO (г) = CO2 (г) + H2 (г) |
-41 |
