- •I. Физические основы поглощения света и фотолюминесценции
- •II. Техника измерения электронных спектров поглощения и люминесценции
- •III. Современные методы обработки спектроскопических данных
- •En-ushakov@mail.Ru
- •IV. Примеры применения электронной спектроскопии для исследования свойств супрамолекулярных систем
Электронная спектроскопия
в супрамолекулярной химии
Основные разделы:
Физические основы поглощения света и фотолюминесценции
Техника измерения электронных спектров поглощения и люминесценции
Современные методы обработки спектроскопических данных
Примеры применения электронной спектроскопии для исследования свойств супрамолекулярных систем
Рекомендованная литература:
Экспериментальные методы химии высоких энергий: Учебное пособие / Под общ. ред. М. Я. Мельникова. – М.: Изд-во МГУ, 2009. – 824 с
(ISBN 978-5-211-05561-2).
Е.Н. Ушаков / Самосборка и фотохимия супрамолекулярных систем на основе краунсодержащих непредельных соединений // дисс. док. хим. наук, ИПХФ РАН, Черноголовка, 2006. – 263 с.
(имеется в электронном виде, PDF-файл, en-ushakov@mail.ru)
Дополнительная литература:
E.N. Ushakov et al, Sandwich-type complexes of alkaline-earth metal cations with a bisstyryl dye containing two crown ether units, J. Phys. Chem. A, 1999, vol. 103, p. 11188-11193.
(имеется в электронном виде, PDF-файл, en-ushakov@mail.ru)
I. Физические основы поглощения света и фотолюминесценции
Взаимодействие света с веществом
Свет, как известно, характеризуется длиной волны и частотой , которые связаны соотношением

где с – скорость света в вакууме, n – показатель преломления среды.
Волновую теорию света используют для интерпретации таких явлений как отражение, преломление, дифракция света, т.е. явлений, при которых свет не поглощается средой.
Однако для описания поглощения и испускания света веществом необходимо использовать квантовую теорию, согласно которой световая энергия может поглощаться только определенными порциями, или квантами. Энергия, переносимая одним квантом света, или, другими словами, фотоном, определяется уравнением Планка:

где h – постоянная Планка. То есть, монохроматический свет характеризуется не только длиной волны, но также и энергией фотона.
Поглощение монохроматического света гомогенной средой, содержащей поглощающее свет вещество, подчиняется закону ЛамбертаБера:

где I0 – энергия монохроматического света, падающего за единицу времени на поверхность слоя вещества; I – энергия, прошедшая через слой вещества за единицу времени; l – толщина слоя, см; C – концентрация поглощающего свет вещества, моль/л; – молярный коэффициент поглощения (экстинкция), л/(мольсм), который зависит от природы вещества, длины волны света и температуры.
В фотохимии для характеристики поглощения обычно используют понятие оптическая плотность раствора (D, безразмерная величина)

Закон ЛамбертаБера не выполняется в тех случаях, когда значительная доля молекул переходит в возбужденное состояние (например, при очень высокой интенсивности падающего света). Отклонения от закона ЛамбертаБера иногда наблюдаются и при низких интенсивностях света. Однако эти отклонения являются кажущимися; как правило, они связаны либо с недостаточной разрешающей способностью спектрометра, либо с такими явлениями как ассоциация молекул.
Возбужденные электронные состояния
Используя слово свет, мы обычно подразумеваем оптическое излучение, видимое человеческим глазом. Спектральная кривая чувствительности человеческого глаза лежит в диапазоне 400 £ l £ 750 нм. Максимум чувствительности находится около 555 нм (зеленый свет). Для фотохимии интерес представляет более широкая область излучения, которую формально можно разделить следующим образом:
ближнее ультрафиолетовое (200 £ l £ 400 нм)
видимое (400 £ l £ 750 нм)
ближнее инфракрасное излучение (750 £ l £ 1000 нм)
При поглощении кванта света с l = 200–1000 нм возбуждаются внешние электроны молекулы, осуществляющие химическую связь; их возбуждение может приводить к химическому превращению. Этот спектральный диапазон является основным для спектроскопии поглощения и испускания света.
Спектры поглощения
Спектр поглощения вещества обычно состоит из полос разной интенсивности и ширины. Происхождение этих полос можно проиллюстрировать с помощью энергетической диаграммы молекулярных орбиталей (МО). Электроны в молекуле в основном состоянии располагаются парами на МО с разной энергией. Длинноволновая полоса в электронном спектре поглощения обычно соответствует переходу электрона с верхней занятой МО (ВЗМО) на нижнюю вакантную МО (НВМО). Полосы поглощения с большей энергией соответствуют переходам на вышележащие вакантные МО (например, S0S2) или переходам с нижележащих занятых МО (например, S–1S1).
|
|
|
Структура и форма полосы поглощения
|
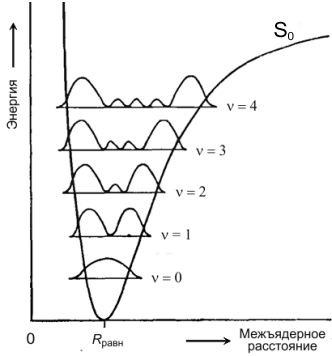
Полосы в спектрах поглощения нередко имеют определенную структуру. Это связано с тем, что каждому электронному состоянию соответствует набор разных колебательных состояний. На рисунке показана зависимость потенциальной энергии двухатомной молекулы в основном электронном состоянии от межъядерного расстояния (кривая S0). Максимумы на кривых для колебательных состояний ( = 0, 1, 2, 3, 4) отвечают наиболее вероятным межъядерным расстояниям. Для нулевого колебательного состояния = 0 наиболее вероятное межъядерное расстояние находится в области минимума кривой потенциальной энергии. Для более высоких колебательных уровней наиболее вероятные межъядерные расстояния находятся вблизи точки поворота колебания. |
| |
|
Принцип ФранкаКондона Для объяснения относительной интенсивности переходов между колебательными уровнями основного и возбужденного электронных состояний используют принцип ФранкаКондона. Этот принцип основан на том, что электронный переход является намного более быстрым процессом (~1015 с), чем движение ядер в молекуле (~1013 с), то есть за время электронного перехода взаимное расположение ядер и их импульсы практически не изменяются. Поэтому электронно-колебательные переходы можно представить вертикальными линиями, соединяющими поверхности потенциальной энергии основного S0 и возбужденного S1 электронных состояний. Большинство молекул при комнатной температуре находится на нулевом колебательном уровне, поэтому фотоиндуцированные электронные переходы происходят именно с этого уровня. При данном расположении потенциальных кривых S0 и S1 наиболее вероятным электронно-колебательным переходом будет (02)-переход. Интенсивность (00)-перехода сравнительно мала, поскольку этому переходу соответствует маловероятное межъядерное расстояние. |
| |
В многоатомной молекуле кривая потенциальной энергии переходит в многомерную поверхность, поэтому одному электронному переходу соответствует множество колебательных переходов. Часто эти колебательные переходы близки по энергии и им соответствует одна общая широкая полоса поглощения. Форма этой полосы, тем не менее, определяется принципом Франка-Кондона.
Процессы релаксации в электронно-возбужденных состояниях.
В жидких растворах при комнатной температуре электронно-возбужденные состояния молекул подвергаются сравнительно быстрым процессам релаксации электронно-колебательной энергии. Основные процессы релаксации: внутренняя конверсия из верхних возбужденных состояний Sn в нижнее возбужденное состояние S1 (< 1012 с) и колебательная релаксация в состоянии S1, т.е. диссипация избыточной энергии колебаний в среде за счет столкновений возбужденных молекул вещества с молекулами среды (~1011 с).

|
Эти процессы, как правило, происходят существенно быстрее по сравнению с процессом спонтанного испускания фотона, т.е. излучательной дезактивацией возбужденного состояния S1 (~109 с). Поэтому излучательный переход из состояния S1 в основное состояние S0, называемый флуоресценцией, происходит, как правило, из нулевого колебательного состояния. Таким образом, общим переходом при поглощении и испускании света является переход между нулевыми колебательными уровнями основного и возбужденного состояний, который называют (00)-переходом. Энергия (00)-перехода наименьшая при поглощении и наибольшая при испускании. Состояния S0 и S1 обычно имеют аналогичные распределения колебательных уровней по энергиям, поэтому спектр флуоресценции, как правило, близок к зеркальному отражению спектра поглощения, если оба спектра представлены в шкале энергии фотона. |
|
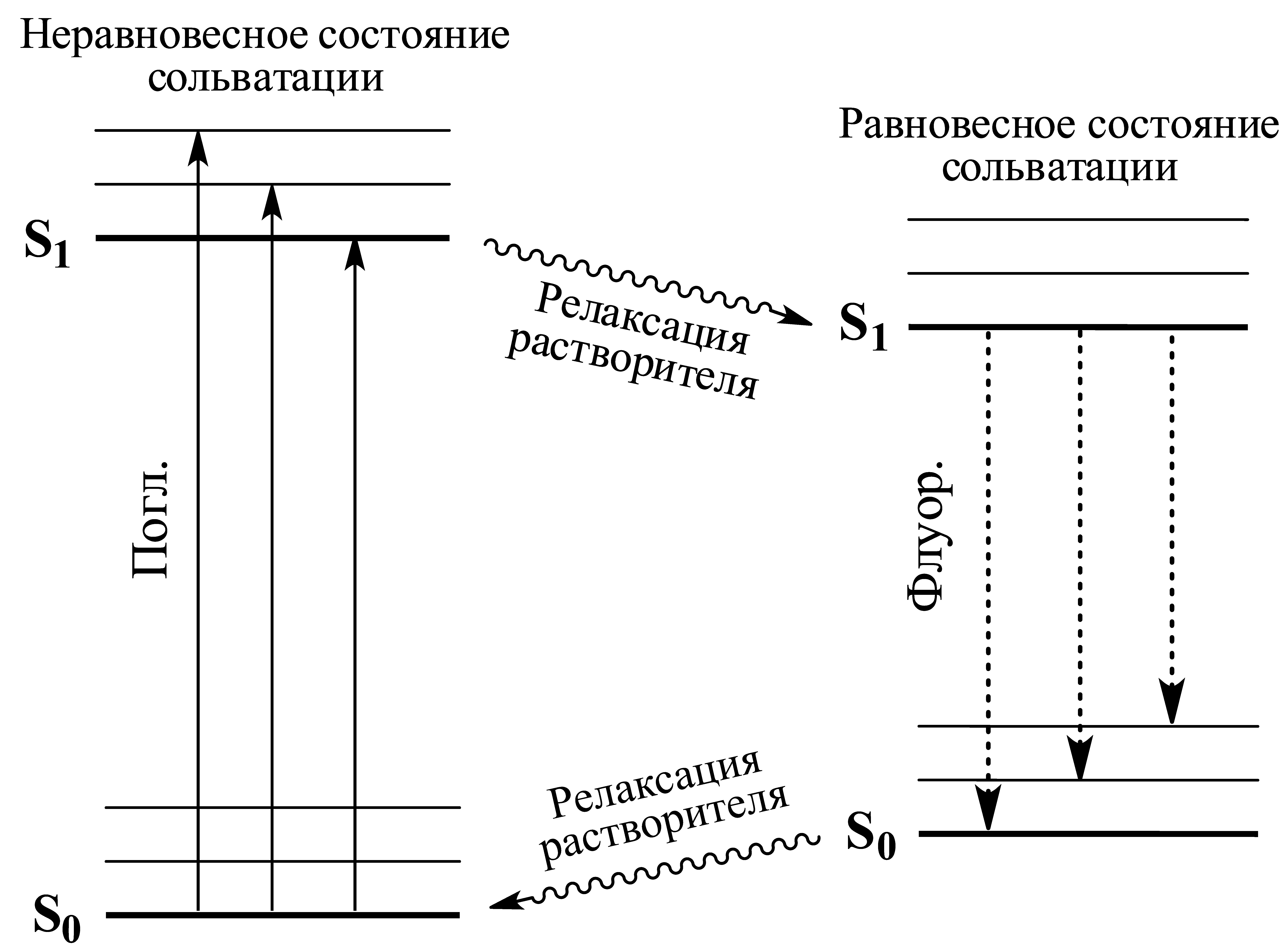
Стоксов сдвиг
Для сложных молекул в жидкой фазе (00)-переход в спектре флуоресценции имеет меньшую энергию, чем (00)-переход в спектре поглощения. Это связано с тем, что сразу после поглощения или испускания фотона молекула оказывается в неравновесном состоянии сольватации. В невязких растворителях при комнатной температуре переход возбужденного флуорофора в равновесное состояние сольватации происходит до испускания фотона. Поэтому (00)-переход при испускании света имеет меньшую частоту, чем (00)-переход при поглощении. Смещение полосы флуоресценции в красную область относительно длинноволновой полосы поглощения называется стоксовым сдвигом.
Мультиплетность
Мультиплетность электронного состояния равна n + 1, где n – число неспаренных электронов. Молекулярные орбитали молекул с четным числом электронов заполнены парами электронов с противоположно направленными спинами. Мультиплетность основного состояния большинства молекул с четным числом электронов равна 1, т.е. это синглетные состояния. При переходе электрона на верхнюю орбиталь его спин может оказаться ориентированным в том же или в противоположном направлении относительно оставшегося на нижней орбитали электрона. Если ориентации спина сохраняется, то мультиплетность возбужденного состояния, как и основного состояния, будет синглетным. Если же возбуждаемый электрон меняет направление спина, возбужденное состояние будет триплетным. Таким образом, одному основному состоянию соответствуют разные возбужденные состояния – синглетные и триплетные.

Диаграмма Яблонского
Физические процессы, протекающие в электронно-возбужденном состоянии молекул, принято представлять в виде диаграммы Яблонского. Основными безызлучательными процессами дезактивации нижнего возбужденного состояния S1 являются внутренняя конверсия (переход между состояниями одинаковой мультиплетности) и интеркомбинационная конверсия (переход между состояниями разной мультиплетности, например, синглет-триплетный переход S1T1). Внутренняя конверсия S1S0 – сравнительно медленный процесс. Поэтому в возбужденном состоянии S1 могут наблюдаться процессы спонтанного испускания фотона (спонтанное излучение) и фотохимические реакции. Излучательными процессами являются разрешенная по спину флуоресценция и запрещенная по спину фосфоресценция.

Классификация электронных переходов
Электронные спектры поглощения в УФ и видимом диапазонах, дают важную информацию о структуре и свойствах электронно-возбужденных состояний молекул. Знание спектра поглощения вещества является обязательным условием фотолюминесцентных и фотохимических исследований. Кратко остановимся на классификации электронных переходов
Электроны в органической молекуле располагаются на молекулярных -, - и n-орбиталях. На каждой молекулярной орбитали помещаются два электрона, отличающихся спинами. При возбуждении молекулы светом происходит переход электрона с занятой связывающей орбитали на свободную разрыхляющую орбиталь. Такие переходы обозначают в соответствии с их орбитальной природой: *, n*, * и n*.
Полосы поглощения, обусловленные переходами *, находятся преимущественно в вакуумной УФ области < 200 нм, где обычные спектрофотометры не применимы.
Переходам n* соответствуют полосы поглощения в УФ области. Например, органические соединения, содержащие n-электроны, локализованные на орбиталяхгетероатомов, О, N, S, поглощают УФ свет в области около 200 нм.
Переходам * и n* соответствуют полосы поглощения в средней УФ-области. При сопряжении кратных связей полосы, обусловленные этими переходами, смещаются в ближнюю УФ- и видимую область спектра. Переходы n* характерны для соединений, содержащих такие хромофорные группы, как С=О, C=S, N=N; эти переходы часто оказываются запрещенными, и соответствующие им полосы поглощения имеют сравнительно низкую интенсивность.
Эта классификация пригодна в основном для относительно простых молекул. В сложных молекулах определенный вклад в электронный переход могут вносить электроны, находящиеся на орбиталях разного типа.
Значительный интерес представляют электронные переходы с переносом заряда. Если в молекуле имеются электронодонорная и акцепторная группы, и они находятся в -электронном сопряжении, то переход S0S1 может сопровождаться переносом заряда от донора к акцептору по цепи сопряжения, как например, в данном стириловом красителе:

В этом случае говорят об электронном переходе с внутренним переносом заряда. Соответствующие полосы поглощения обычно характеризуются высокой интенсивностью и располагаются в видимой, а иногда и в ближней ИК области.
Для слабосвязанных органических донорно-акцепторных комплексов могут наблюдаться полосы поглощения, относящиеся к электронному переходу с переносом заряда от донора к акцептору через пространство (межмолекулярный перенос заряда). Такие комплексы часто называют комплексами с переносом заряда. Длинноволновые полосы поглощения таких комплексов имеют сравнительно низкую интенсивность и могут находиться в ближней УФ, видимой и ближней ИК области спектра.
В металлорганической химии различают полосы поглощения, соответствующие переносу заряда от лиганда к металлу (ПЗЛМ) и от металла к лиганду (ПЗМЛ).