
- •Оглавление
- •ВВЕДЕНИЕ
- •ЛАБОРАТОРНАЯ РАБОТА 1. КЛАССЫ ХИМИЧЕСКИХ СОЕДИНЕНИЙ
- •ЛАБОРАТОРНАЯ РАБОТА 2. ОПРЕДЕЛЕНИЕ МОЛЯРНОЙ МАССЫ ЭКВИВАЛЕНТОВ ЭЛЕМЕНТА И СЛОЖНОГО СОЕДИНЕНИЯ
- •ЛАБОРАТОРНАЯ РАБОТА 3. РАСТВОРЫ
- •ЛАБОРАТОРНАЯ РАБОТА 4. ЖЕСТКОСТЬ ВОДЫ И МЕТОДЫ ЕЕ УМЯГЧЕНИЯ
- •ЛАБОРАТОРНАЯ РАБОТА 5. ЭЛЕКТРОЛИТИЧЕСКАЯ ДИССОЦИАЦИЯ
- •Ионообменные реакции
- •ЛАБОРАТОРНАЯ РАБОТА 6. ГИДРОЛИЗ СОЛЕЙ
- •ЛАБОРАТОРНАЯ РАБОТА 7.ТЕПЛОВЫЕ ЭФФЕКТЫ, НАПРАВЛЕНИЕ ХИМИЧЕСКИХ РЕАКЦИЙ
- •ЛАБОРАТОРНАЯ РАБОТА 8. ХИМИЧЕСКАЯ КИНЕТИКА И РАВНОВЕСИЕ
- •ЛАБОРАТОРНАЯ РАБОТА 10. ГАЛЬВАНИЧЕСКИЕ ЭЛЕМЕНТЫ
- •ЛАБОРАТОРНАЯ РАБОТА 11. ЭЛЕКТРОЛИЗ РАСТВОРОВ ЭЛЕКТРОЛИТОВ
- •ЛАБОРАТОРНАЯ РАБОТА 12. КОРРОЗИЯ МЕТАЛЛОВ. ЗАЩИТА ОТ КОРРОЗИИ
- •ЛАБОРАТОРНАЯ РАБОТА 14. ПОЛУЧЕНИЕ ДИСПЕРСНЫХ СИСТЕМ. УСТОЙЧИВОСТЬ КОЛЛОИДНЫХ РАСТВОРОВ
- •ЛАБОРАТОРНАЯ РАБОТА 15. ВОССТАНОВИТЕЛЬНЫЕ СВОЙСТВА МЕТАЛЛОВ
- •ЛАБОРАТОРНАЯ РАБОТА 17. ЛЕГИРУЮЩИЕ МЕТАЛЛЫ (ХРОМ, МАРГАНЕЦ)
- •ЛАБОРАТОРНАЯ РАБОТА 18. ТЯЖЕЛЫЕ КОНСТРУКЦИОННЫЕ МЕТАЛЛЫ ПОДГРУППЫ ЖЕЛЕЗА (ЖЕЛЕЗО, КОБАЛЬТ, НИКЕЛЬ)
- •ЛАБОРАТОРНАЯ РАБОТА 19. ЦИНК
- •ЛАБОРАТОРНАЯ РАБОТА 20. ОЛОВО И ЕГО КИСЛОРОДНЫЕ СОЕДИНЕНИЯ
- •ЛАБОРАТОРНАЯ РАБОТА 21. СВИНЕЦ И ЕГО КИСЛОРОДНЫЕ СОЕДИНЕНИЯ
- •ЛАБОРАТОРНАЯ РАБОТА 22. СВОЙСТВА МЕДИ И ЕЕ СОЕДИНЕНИЙ
- •БИБЛИОГРАФИЧЕСКИЙ СПИСОК
- •ПРИЛОЖЕНИЕ
ЛАБОРАТОРНАЯ РАБОТА 6. ГИДРОЛИЗ СОЛЕЙ
Цельработы
Ознакомление с процессами, происходящими при растворении в воде различных по составу солей.
Краткиетеоретическиесведения
Гидролиз солей − это обменное взаимодействие ионов соли с молекулами воды, в результате которого образуется слабый электролит. При этом смещается равновесие электролитической диссоциации воды и, как следствие этого, меняется pH раствора.
Вода – слабый амфотерный электролит. Молекулы воды могут как отдавать, так и присоединять катионы Н+ (автопротолиз). В результате взаимодействия между молекулами в чистой воде содержатся помимо молекул H2O гидроксид-ионы ОН− и катионы водорода Н+ (точнее, катионы гидроксония H3O+): H2O + H2O ' H3O+ + ОН−. Часто это равновесие изображают упрощенным уравнением: H2O ' Н+ + ОН−
Количественно диссоциация воды описывается константой диссоциа-
ции:
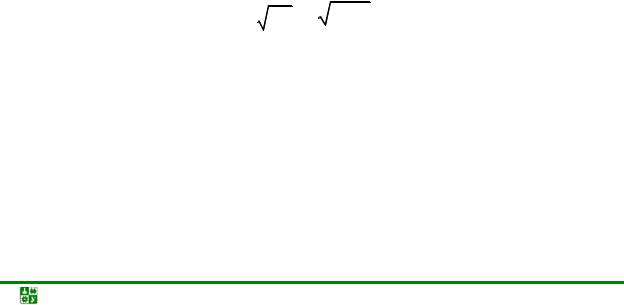
K = [H+ ] [OH− ] = 1,8·10−16 (при 25 ºС)
[H2O]
и ионным произведением воды
Кв = [H+]·[OH–] = К [H2O] = 1,8·10–16 · 55,56 = 10–14 (при 25 ºС)
(с учитом того, что [H2O] = 1000/18 = 55,56 моль/л).
Следовательно, в чистой воде и нейтральных растворах:
[H+] = [OH–] = Kâ = 10−14 = 10–7 моль/л.
Содержание катионов водорода и гидроксид-ионов выражается также через водородный показатель pH – это отрицательный десятичный логарифм концентрации (активности) ионов водорода в растворе:
pH = − lg[H+]
и гидроксильный показатель:
pОH = − lg[ОH−]; pH + pОH = 14.
Химия. Лаб. практикум |
-56- |

ЛАБОРАТОРНАЯ РАБОТА 6. ГИДРОЛИЗ СОЛЕЙ
Краткие теоретические сведения
В чистой воде и нейтральных растворах, когда концентрации ионов равны, pH = pОH = – lg 10−7 = 7.
При pH < 7 среда раствора называется кислой. В кислых растворах концентрация катионов водорода больше концентрации гидроксид-ионов и, следовательно, больше 10−7 моль/л.
При pH > 7 среда раствора называется щелочной. В щелочных растворах [OH–] > [H+], т. е. больше 10−7 моль/г.
Для точного измерения pH используют специальные приборы – pH-метры, датчиками в которых служат стеклянные электроды. Для приблизительного определения pH служат кислотно-основные индикаторы – это вещества, которые изменяют окраску в зависимости от pH раствора. Широкое распространение получили индикаторы, представляющие собой слабые органические кислоты или основания, ионная и молекулярная формы которых сообщают раствору различную окраску. Например, молекулы индикатора метилового оранжевого окрашивают раствор в красный цвет, а его анион
– в желтый.
Изменение окраски, воспринимаемое глазом, происходит у каждого индикатора в определенной области pH (так называемый интервал перехода). Так, лакмус меняет окраску от красной до синей в интервале pH 5,0−8,0; метиловый оранжевый – от желтой до красной при pH 4,4−3,1; фенолфталеин – от бесцветной до малиновой в интервале pH 8,2−10,0.
Нарушение равновесия диссоциации воды при гидролизе соли происходит вследствие того, что ионы соли связывают один или оба иона воды, образуя мало диссоциированное соединение. Следовательно, гидролизу подвергаются лишь те соли, в состав которых входят или ионы слабых кислот, или ионы слабых оснований.
Рассмотрим различные случаи гидролиза.
1. Гидролиз соли, образованной сильным основанием и слабой кислотой (гидролиз по слабому звену − аниону), рассмотрим на примере цианида натрия NaCN (NaOH − сильное основание, HCN − слабая кислота):
NaCN → Na+ + CN−
Ионное уравнение гидролиза:
CN− + H+OH− ' HCN + OH−
Запишем уравнение гидролиза в молекулярной форме, добавив противоионы исходной соли – ионы Na+:
NaCN + H+OH− = NaOH + HCN
Гидролиз соли, содержащей многозарядный анион, идет ступенчато, рассмотрим его на примере карбоната натрия Na2CO3, образованного слабой двухосновной кислотой H2CO3 и сильным основанием NaOH:
Химия. Лаб. практикум |
-57- |

ЛАБОРАТОРНАЯ РАБОТА 6. ГИДРОЛИЗ СОЛЕЙ
Краткие теоретические сведения
CO 23− + H+OH− = HCO −3 + OH− (I ступень)
Представим в молекулярной форме уравнение гидролиза:
Na2CO3 + H+OH− = NaHCO3 + NaOH
Образование HCO −3 (т. е. кислой соли), а не молекулы H2CO3 объясняется тем, что ион HCO −3 диссоциирует в гораздо меньшей степени, чем молекула H2CO3:
H2CO3 |
' H+ + HCO 3− |
KI |
= 3 |
· 10−7 |
HCO 3− |
' H+ + CO 32− |
K2 |
= 5 |
· 10−11 |
Вторая ступень гидролиза выражена менее сильно, ею часто можно пренебречь:
NaHCO3 + H+OH− ' H2CO3 + NaOH |
(II ступень) |
HCO −3 + H+OH− ' H2CO3 + OH–
Таким образом, в результате гидролиза соли, образованной сильным основанием и слабой кислотой, получаются сильное основание и слабая кислота или кислая соль. Избыточные ионы гидроксид-аниона обуславливают щелочную реакцию раствора, поэтому его pH > 7.
2. Гидролиз соли, образованной слабым основанием и сильной кислотой (гидролиз по слабому звену − катиону). В качестве примера возьмем соль хлорид аммония NH4Cl, которая диссоциирует на ионы NH4+ и Cl−:
NH4Cl ' NH4+ + Cl−
NH4+ – ион взаимодействует с молекулами воды с образованием слабого электролита. Ионное уравнение гидролиза хлорида аммония имеет вид
NH4+ + H+OH− ' NH4OH + H+
Слабо поляризующий ион Cl− в гидролитическое взаимодействие с молекулами воды практически не вступает. В молекулярной форме уравнение гидролиза хлорида аммония имеет вид:
NH4Cl + H2O ' NH4OH + HCl
Химия. Лаб. практикум |
-58- |

ЛАБОРАТОРНАЯ РАБОТА 6. ГИДРОЛИЗ СОЛЕЙ
Краткие теоретические сведения
В случае гидролиза соли, образованной многоосновным слабым основанием и сильной кислотой, получим основную соль. Рассмотрим гидролиз хлорида алюминия AlCl3:
AlCl3 → Al3+ + 3Cl−
Al3+ + H+OH− ' AlOH2+ + H+ pH < 7;
AlCl3 + HOH ' AlOHCl2 + HCl
В водном растворе хлорида алюминия только ионы Al3+ и ОН− могут взаимодействовать с нарушением ионного баланса, поскольку образуют слабые электролиты: AlOH2+, Al(OH)2+, Al(OH)3. AlOH2+ − ионы нарушают диссоциацию воды: НОН ' H+ + OH−. Среда становится кислой из-за накопления ионов H+ в результате гидролиза:
Al3+ + HOH 'AlOH2+ + H+
Избыток ионов Н+, согласно принципу Ле Шателье, смещает диссоциацию воды в сторону образования недиссоциированных молекул воды. Поэтому процесс гидролиза прекращается с образованием AlOH2+ − ионов (первая ступень гидролиза) и практически нет Al(OH)2+ − ионов и молекул
Al(OH)3:
AlOH2+ + HOH ' Al(OH)2+ + H+ |
(II ступень) |
Al(OH)2+ + HOH ' Al(OH)3 + H+ |
(III ступень) |
3. Гидролиз соли, образованной слабым основанием и слабой кислотой (полный гидролиз и по катиону, и по аниону). Соли этого типа легче других поддаются гидролизу, так как их ионы связывают одновременно оба иона воды, нарушая равновесие электролитической диссоциации воды и образуя слабые электролиты. Так, в случае гидролиза ацетата аммония в гидролитическое
взаимодействие с водой вступают как катион NH 4+ , так и анион CH3COO−. Реак-
ция среды в результате гидролиза определяется силой слабой кислоты и слабого основания и может быть нейтральной:
CH3COONH4 ' CH3COO– + NH 4+
CH3COO− + NH 4+ + HOH ' CH3COOH + NH4OH
Химия. Лаб. практикум |
-59- |

ЛАБОРАТОРНАЯ РАБОТА 6. ГИДРОЛИЗ СОЛЕЙ
Краткие теоретические сведения
Гидролиз соли, состоящей из многозарядных катиона аниона, рассмотрим на примере сульфида алюминия Al2S3:
Al2S3 → 2Al3+ + 3S2−
Al3+ + HOH = AlOH2+ + H+
S2− + HOH = HS− + OH−
Образующиеся при гидролизе ионы Н+ и ОН− нейтрализуются, что способствует дальнейшему гидролизу до выпадения осадка нерастворимого гидроксида алюминия и образования слабой кислоты:
2Al3+ + 3S2− + 6HOH → 2Al(OH)3↓ + 3H2S↑
Al2S3 + 6H2O → 2Al(OH)3 + 3H2S
В данном случае процесс необратим, потому что продукты гидролиза выпадают в осадок и улетучиваются в виде газа. Водные растворы таких солей приготовить невозможно.
4. Соли, образованные сильным основанием и сильной кислотой: NaCl, KNO3, CaSO4, гидролизу не подвергаются. Например, хлорид натрия NaCl диссоциирует на слабо поляризующие ионы Na+ и Cl−, которые в гидролитическое взаимодействие с водой не вступают.
Количественной характеристикой гидролиза является степень гидролиза и константа гидролиза.
Степень гидролиза αг определяется отношением числа гидролизованных молекул к общему числу растворенных молекул:
αг = Числогидролизованных молекул .
Степень гидролиза выражается в долях единицы или в процентах. Степень гидролиза αг зависит от природы соли, концентрации раство-
ра и температуры. Если необходимо увеличить степень гидролиза, то следует добавить воды и повысить температуру.
Константа гидролиза Кг. Гидролиз солей − процесс обратимый, поэтому к реакции гидролиза применим закон действующих масс.
Гидролиз по катиону в общем виде можно записать уравнением
Kn+ + HOH ' KOH(n-1)+ + H+
Напишем константу равновесия данной обратимой реакции, используя закон действующих масс:
Химия. Лаб. практикум |
-60- |
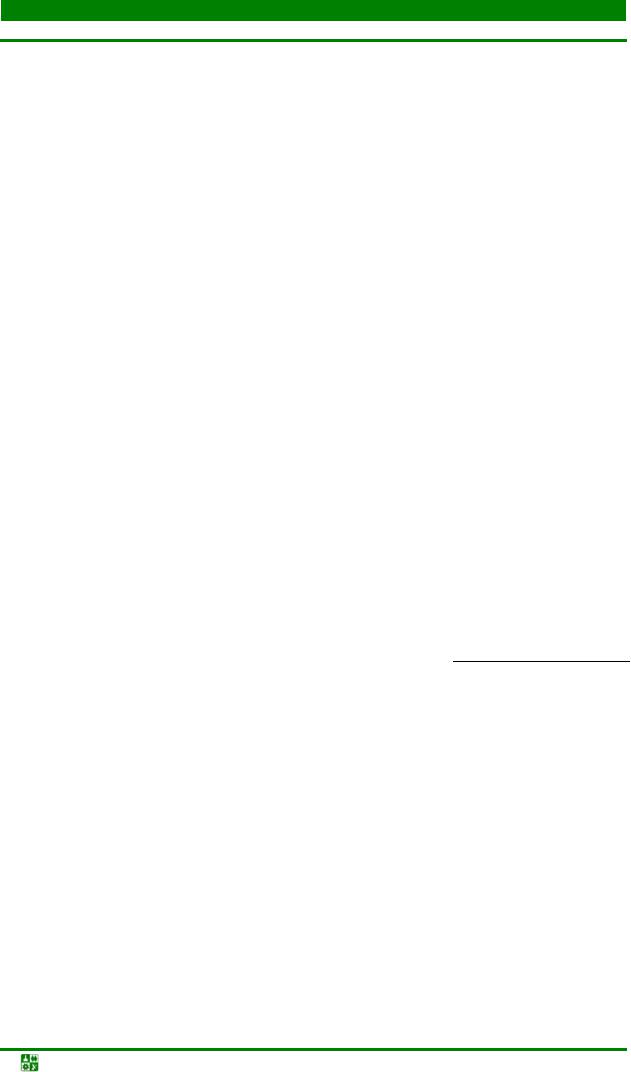
ЛАБОРАТОРНАЯ РАБОТА 6. ГИДРОЛИЗ СОЛЕЙ
Краткие теоретические сведения
Кр = |
[KOH(n - 1)+ |
] [H+ |
] |
. |
[Kn+] [HOH] |
|
|||
|
|
|
||
Величина [HOH] ~ const, внесем ее в константу химического равновесия Кр и обозначим Кг:
Кр · [HOH] = Кг = |
[KOH(n−1)+ |
] [H |
+] |
. |
[Kn+ |
] |
|
||
|
|
|
Кг определяет состояние химического равновесия в растворе гидролизованной соли.
Экспериментальнаячасть
Опыт 1 Определениереакциисредыразличныхсолей
спомощьюуниверсальногоиндикатора
Спомощью универсальной индикаторной бумаги определите рН в
1 н. растворах следующих солей: KCl, Na2CO3, Al2(SO4)3, (NH4)2CO3, CH3COONa и сравните с рН дистиллированной воды. Свои наблюдения и выводы запишите в табл. 6.1.
|
|
|
Таблица 6.1 |
|
|
|
|
рН раствора |
|
Номер п/п |
Испытуемая соль |
Реакция среды |
|
|
1 |
|
|
|
|
... |
|
|
|
|
5 |
|
|
|
|
Какие соли подвергаются гидролизу? Напишите уравнения гидролиза в молекулярной и ионной форме. Почему при гидролизе карбоната натрия не выделяется углекислый газ? Объясните, чем обусловлена реакция среды в каждом случае.
Опыт 2 Влияниетемпературынастепеньгидролиза
А. Налейте в пробирку 2-3 мл 1 н. раствора ацетата натрия и 2−3 капли фенолфталеина. Нагрейте раствор почти до кипения и наблюдайте появление розовой окраски. Охладите пробирку под краном и наблюдайте уменьшение интенсивности окрашивания. Объясните изменение интенсивности окраски раствора с изменением температуры.
Б. В пробирку внесите 7-8 капель сульфата алюминия и столько же ацетатанатрия, нагрейтенаводянойбанедокипения. Объяснитепоявлениеосадка.
Химия. Лаб. практикум |
-61- |

ЛАБОРАТОРНАЯ РАБОТА 6. ГИДРОЛИЗ СОЛЕЙ
Экспериментальная часть
Опыт 3 Влияниеразбавлениярастворанастепеньгидролиза
Внесите в пробирку 2-3 кристаллика хлорида олова (II) и добавьте по каплям воду до выпадения осадка SnOHCl. При подкислении концентрированной соляной кислотой осадок растворяется. Напишите уравнения в молекулярной и ионной форме. Объясните влияние разбавления раствора и добавления соляной кислоты.
Опыт 4 Влияниесилыкислотыиоснования, образующихсоль,
настепеньеегидролиза
Налейте в пробирки по 1-2 мл 1 н. растворов сульфита и карбоната натрия. В каждую пробирку добавьте по одной капле фенолфталеина. Почему окраска фенолфталеина в этих растворах различна? Объясните наблюдаемое явление, сравнив константы диссоциации угольной (К1 = 4,3·10−7; К2 = 5,6·10−11) и сернистой (К1 = 1,7·10−2, К2 = 6,8·10−8) кислот. Напишите уравнение гидролиза сульфита натрия.
Опыт 5 Полный(необратимый) гидролиз
Внесите в пробирку 6−8 капель сульфата алюминия и столько же карбоната натрия. Отметьте выделение углекислого газа и выпадение осадка гидроксида алюминия.
Почему не получилось карбоната алюминия? Какие соли подверглись полному гидролизу?
Контрольныевопросыизадачи
1.Что такое гидролиз? Какие вещества образуются в результате гидролиза? Приведите примеры.
2.Какие соли подвергаются гидролизу? Чем это объясняется?
3.Почему соли, образованные сильным основанием и сильной кислотой, не подвергаются гидролизу?
Химия. Лаб. практикум |
-62- |

ЛАБОРАТОРНАЯ РАБОТА 6. ГИДРОЛИЗ СОЛЕЙ
Контрольные вопросы и задачи
4.Какие соли гидролизуются с образованием кислых солей или слабо диссоциирующих кислот? Приведите примеры.
5.Какие соли гидролизуются с образованием основных солей или слабых оснований? Приведите пример.
6.Какие соли гидролизуются полностью? Почему? Приведите пример.
7.Почему в результате гидролиза изменяются кислотно-основные свойства среды? Как ее можно определить?
8.Что такое степень гидролиза? Как на нее влияют температура и концентрация раствора?
9.Напишите ионные и молекулярные уравнения ступенчатого гидролиза сульфата двухвалентного железа и сульфида натрия. Какая будет реакция среды этих солей в результате гидролиза?
10.Напишите молекулярные и ионные уравнения первой ступени гидролиза нитрата трехвалентного железа и фосфата натрия, определите реакцию среды.
11.Какую реакцию должны показывать водные растворы нитрата аммония, нитрата калия, цианида калия, цианида аммония, ацетата аммония? Ответ мотивируйте и напишите соответствующие уравнения реакций в ионном виде.
12.Как отразится на равновесии гидролиза цианида натрия прибавление щелочи, кислоты или хлорида аммония?
Химия. Лаб. практикум |
-63- |
