
- •Оглавление
- •ВВЕДЕНИЕ
- •ЛАБОРАТОРНАЯ РАБОТА 1. КЛАССЫ ХИМИЧЕСКИХ СОЕДИНЕНИЙ
- •ЛАБОРАТОРНАЯ РАБОТА 2. ОПРЕДЕЛЕНИЕ МОЛЯРНОЙ МАССЫ ЭКВИВАЛЕНТОВ ЭЛЕМЕНТА И СЛОЖНОГО СОЕДИНЕНИЯ
- •ЛАБОРАТОРНАЯ РАБОТА 3. РАСТВОРЫ
- •ЛАБОРАТОРНАЯ РАБОТА 4. ЖЕСТКОСТЬ ВОДЫ И МЕТОДЫ ЕЕ УМЯГЧЕНИЯ
- •ЛАБОРАТОРНАЯ РАБОТА 5. ЭЛЕКТРОЛИТИЧЕСКАЯ ДИССОЦИАЦИЯ
- •Ионообменные реакции
- •ЛАБОРАТОРНАЯ РАБОТА 6. ГИДРОЛИЗ СОЛЕЙ
- •ЛАБОРАТОРНАЯ РАБОТА 7.ТЕПЛОВЫЕ ЭФФЕКТЫ, НАПРАВЛЕНИЕ ХИМИЧЕСКИХ РЕАКЦИЙ
- •ЛАБОРАТОРНАЯ РАБОТА 8. ХИМИЧЕСКАЯ КИНЕТИКА И РАВНОВЕСИЕ
- •ЛАБОРАТОРНАЯ РАБОТА 10. ГАЛЬВАНИЧЕСКИЕ ЭЛЕМЕНТЫ
- •ЛАБОРАТОРНАЯ РАБОТА 11. ЭЛЕКТРОЛИЗ РАСТВОРОВ ЭЛЕКТРОЛИТОВ
- •ЛАБОРАТОРНАЯ РАБОТА 12. КОРРОЗИЯ МЕТАЛЛОВ. ЗАЩИТА ОТ КОРРОЗИИ
- •ЛАБОРАТОРНАЯ РАБОТА 14. ПОЛУЧЕНИЕ ДИСПЕРСНЫХ СИСТЕМ. УСТОЙЧИВОСТЬ КОЛЛОИДНЫХ РАСТВОРОВ
- •ЛАБОРАТОРНАЯ РАБОТА 15. ВОССТАНОВИТЕЛЬНЫЕ СВОЙСТВА МЕТАЛЛОВ
- •ЛАБОРАТОРНАЯ РАБОТА 17. ЛЕГИРУЮЩИЕ МЕТАЛЛЫ (ХРОМ, МАРГАНЕЦ)
- •ЛАБОРАТОРНАЯ РАБОТА 18. ТЯЖЕЛЫЕ КОНСТРУКЦИОННЫЕ МЕТАЛЛЫ ПОДГРУППЫ ЖЕЛЕЗА (ЖЕЛЕЗО, КОБАЛЬТ, НИКЕЛЬ)
- •ЛАБОРАТОРНАЯ РАБОТА 19. ЦИНК
- •ЛАБОРАТОРНАЯ РАБОТА 20. ОЛОВО И ЕГО КИСЛОРОДНЫЕ СОЕДИНЕНИЯ
- •ЛАБОРАТОРНАЯ РАБОТА 21. СВИНЕЦ И ЕГО КИСЛОРОДНЫЕ СОЕДИНЕНИЯ
- •ЛАБОРАТОРНАЯ РАБОТА 22. СВОЙСТВА МЕДИ И ЕЕ СОЕДИНЕНИЙ
- •БИБЛИОГРАФИЧЕСКИЙ СПИСОК
- •ПРИЛОЖЕНИЕ
ЛАБОРАТОРНАЯ РАБОТА 5. ЭЛЕКТРОЛИТИЧЕСКАЯ ДИССОЦИАЦИЯ
Цельработы
Изучение процессов, протекающих в электролитах; электролитическая диссоциация, степень и константа диссоциации, ионообменные реакции, электрическая проводимость, произведениерастворимости.
Краткиетеоретическиесведения
Электролитами называют вещества, которые при растворении в полярном растворителе придают раствору способность проводить электрический ток. Определение электролиты применительно непосредственно и к растворам, которые проводят электрический ток. Таким образом, электролиты это и вещества, это и растворы. Растворы, не проводящие электрический ток, называются неэлектролитами. Примерим неэлектролита является раствор сахарозы в воде.
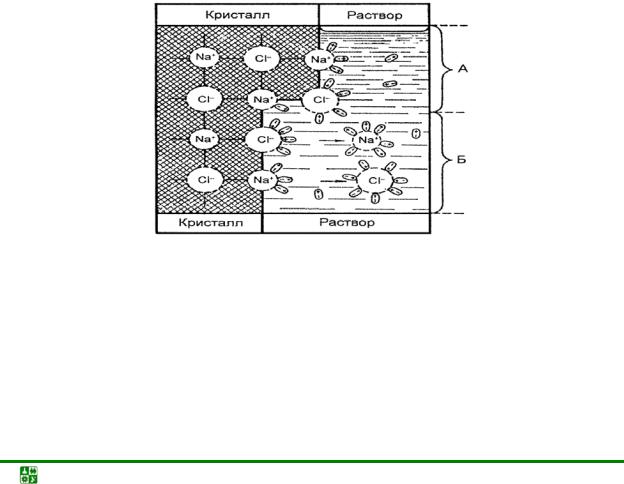
Если поместить электролит в полярный растворитель, то происходит распад электролита на положительно заряженные катионы и отрицательно заряженные анионы (электролитическая диссоциация) в результате сложного физико-химического взаимодействия молекул электролита с полярными молекулами растворителя (процесс сольватации, для воды – гидратации, рис. 5.1).
Рис. 5.1. Схема процесса растворения кристалла NaCl в воде: А – гидратация поверхностно расположенных ионов (предварительная стадия процесса); Б – свободные гидратированные ионы (сольваты), перешедшие в результате диффузии в жидкую фазу
При образовании сольватов выделяется энергия, которая компенсирует энергию, затраченную на разрыв связей в кристаллической решетке. Оп-
Химия. Лаб. практикум |
-45- |
ЛАБОРАТОРНАЯ РАБОТА 5. ЭЛЕКТРОЛИТИЧЕСКАЯ ДИССОЦИАЦИЯ
Краткие теоретические сведения
ределяющее значение при этом имеет величина диэлектрической проницаемости растворителя: чем больше эта величина, тем больше сольватированных ионов в растворе, а значит, и выше энергия сольватации. Это приводит к ослаблению взаимодействия между разноименными ионами, что следует из формулы закона Кулона
F = eε1 re22 ,
где F – сила взаимодействия между зарядами e1 и e2; r – расстояние между центрами ионов; ε – диэлектрическая проницаемость растворителя. Так как для воды при 20 оС ε = 80, то сила притяжения в водном растворе ионов ослабляется в 80 раз.
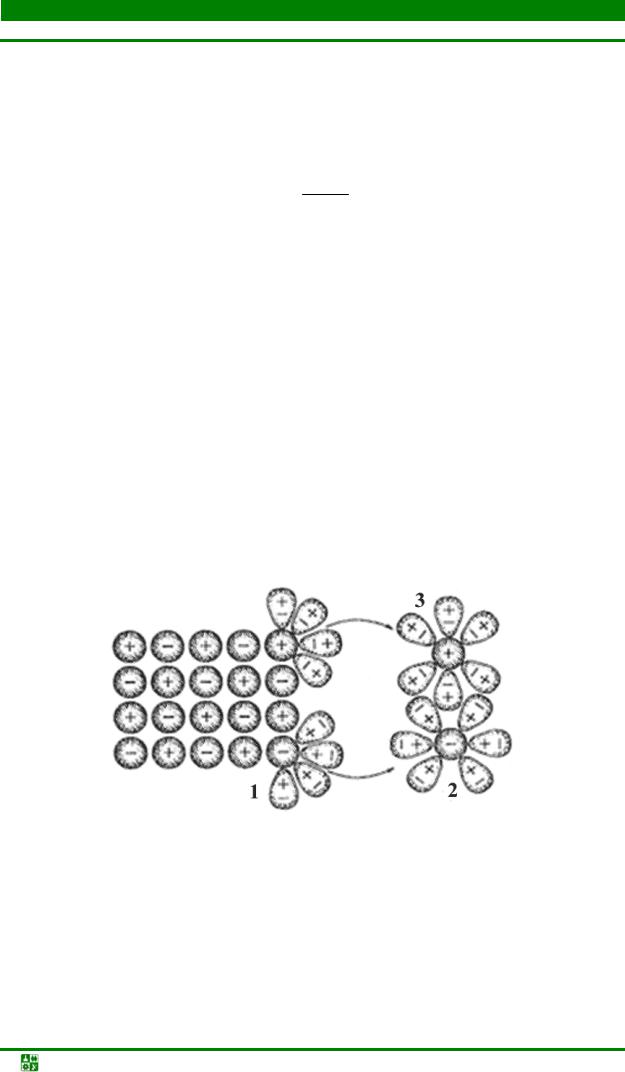
Процесс электролитической диссоциации для соединений с типичной ионной связью (рис. 5.2) может быть записан следующим образом:
NaCl(крист) + (n + m) H2O → Na n H2O + Cl–·m H2O
для соединений с ковалентной связью электролитическая диссоциация обратима (рис. 5.3):
CH3COOH(ж) + (n + m) H2O H+ n H2O + CH3COO− mH2O
HCl(газ) + (n + m) H2O → H n H2O + Cl− m H2O
Рис. 5.2. Схема диссоциации кристалла NаCl: 1 – ориентация полярных молекул Н2О вокруг кристалла; 2, 3 – образование гидратированных катионов (Na+гидр) и анионов (Cl–гидр)
Химия. Лаб. практикум |
-46- |

ЛАБОРАТОРНАЯ РАБОТА 5. ЭЛЕКТРОЛИТИЧЕСКАЯ ДИССОЦИАЦИЯ
Краткие теоретические сведения
Рис. 5.3. Механизм диссоциации электролитов с ковалентным типом связи (на примере НCl): А – ориентация полярных молекул воды вокруг молекул НCl; Б – переход (изменение) типа связи с ковалентной полярной на ионную; В – диссоциация НCl с образованием гидратированного катиона (Н+гидр) и гидратированного аниона (Cl-гидр)
Количественной характеристикой электролитической диссоциации служит степень диссоциации α, равная отношению числа диссоциированных
молекул Nдис к общему числу молекул Nобщ лектролита в растворе α = Näèñ .
Nî áù
Степень диссоциации электролита определяется опытным путем и выражается в долях единицы или в процентах. Если α = 0, то диссоциация отсутствует, при α = 1 или 100 %, электролит полностью распадается на ионы. Следовательно, степень диссоциации, в обратной пропорции зависит от концентрации раствора.
По степени диссоциации все электролиты условно делят на две группы – сильные и слабые. Сильные электролиты – растворы, в которых, при сильном разбавлении, присутствуют только ионы (α ≈ 1). В таком случае растворы сильных электролитов не содержат нейтральных молекул. Слабые элек-
тролиты – растворы, степень диссоциации которых α 1. Слабые электролиты наряду с ионами содержат и недиссоциированные молекулы.
Ксильным электролитам относятся растворы таких кислот, как HNO3, HCl, HBr, HI, H2SO4, HMnO4, а также гидроксидов щелочных и щелочнозе-
мельных металлов – LiOH, NaOH, KOH, RbOH, CsOH, Ca(OH)2, Ba(OH)2, Sr(OH)2; растворы почти всех растворимых солей.
Для перечисленных выше веществ характерно наличие ионной или
сильно полярной ковалентной связи.
Кслабым электролитам относятся растворы некоторых минеральных
кислот, таких как H2CO3, H2S, H2SO3, HCN, HNO2, H3PO4, H2SiO3, H3AsO3, H3AsO4, H3BO3, а также растворы почти всех органических кислот; многих
гидроксидов двух- и трехвалентных металлов – Cu(OH)2, Cr(OH)3, Al(OH)3, Fe(OH)2, а также NH4OH и H2O, растворы некоторых солей – HgCl2, Fe(CNS)3, CdI2, Mg(CN)2 и др. Для этих веществ характерна слабо полярная ковалентная связь.
К слабым электролитам применим закон действия масс, на основании которого может быть записана константа равновесия, называемая применительно к процессу электролитической диссоциации константой диссоциации (Кд). Она равна отношению произведения равновесных концентраций ионов
Химия. Лаб. практикум |
-47- |

ЛАБОРАТОРНАЯ РАБОТА 5. ЭЛЕКТРОЛИТИЧЕСКАЯ ДИССОЦИАЦИЯ
Краткие теоретические сведения
в растворе в степенях, равных их стехиометрическим коэффициентам, к равновесной концентрации недиссоциированных молекул. Например, диссоциа-
ции сероводородной кислоты соответствует уравнение H2S S2- + 2H+. Выражение константы диссоциации, согласно определению, записы-
вают следующим образом:
= [S2−] [H+]2 . Кд [H2S]
Как следует из приведенного выражения, константа диссоциации не зависит от концентрации раствора электролита, в отличие от степени электролитической диссоциации α, и характеризует его способность распадаться на ионы. Чем меньше Кд, тем меньше ионов в растворе, тем слабее электро-
лит. В разбавленных растворах сильных электролитов Кд не имеет физического смысла, т.к. концентрация недиссоциированных молекул практически равна нулю.
Влияниеодноименногоионанастепеньэлектролитическойдиссоциации
При введении в раствор уксусной кислоты ацетат – ионов CH3COO− (прибавлением раствора ацетата натрия CH3COONa) равновесие между недис-
социированными молекулами CH3COOH и ионами CH3COO и H+ сместится в сторону образования молекул кислоты, и степень диссоциации кислоты уменьшится. Аналогичный эффект даст и введение в раствор катионов H+ (путем прибавления раствора сильной кислоты).
Следовательно, прибавление к слабому электролиту одноименных ионов (одинаковых с ионами слабого электролита) уменьшает степень диссоциации этого электролита.
Многоосновные кислоты диссоциируют ступенчато. Например, диссоциация сернистой кислоты протекает следующим образом:
I ступень: H2SO3 H + HSO 3− |
Кд ( I ) = 1,3·10-2; |
II ступень: HSO 3− H + SO 32− |
Кд ( II ) = 5,0·10−6; |
общее уравнение диссоциации: H2SO3 2H + SO 23− . Аналогично для дигидроксида свинца можно записать:
I ступень: Pb(OH)2 PbOH+ + OH− |
Кд (I) = 9,55·10−4; |
II ступень: PbOH+ Pb2+ + OH– |
Кд (II) = 3,0·10−8. |
Химия. Лаб. практикум |
-48- |

ЛАБОРАТОРНАЯ РАБОТА 5. ЭЛЕКТРОЛИТИЧЕСКАЯ ДИССОЦИАЦИЯ
Краткие теоретические сведения
Произведениерастворимости
При растворении вещества в воде одновременно протекают два противоположно направленных процесса, например:
Растворение
AgCl ' Ag+ + Cl−
Осаждение
Когда раствор вещества ненасыщен, то процесс растворения этого вещества преобладает над процессом осаждения (выделения) его из раствора. В пересыщенном растворе наблюдается обратное явление – преобладает процесс выделения растворенного вещества из раствора. В насыщенном растворе, находящемся над осадком растворенного вещества, устанавливается состояние динамического равновесия. В этом случае скорость растворения равна скорости осаждения.
При установившемся равновесии в единицу времени столько же ионов Ag+ + Cl− переходит в осадок, сколько их переходит в раствор с поверхности осадка.
Согласно закону действия масс, при установившемся равновесии в насыщенном водном растворе AgCl:
[Ag+ ] [Cl− ] = [AgCl] KAgCl ,
где [Ag+] и [Cl ] – равновесные концентрации ионов серебра и хлора; [AgCl] – концентрация вещества в твердой фазе, т. е. содержание вещества в единице объема осадка.
В гетерогенных системах столкновения между элементарными частицами растворенного вещества и твердого вещества происходит лишь на поверхности раздела фаз, и независимо от количества твердого вещества, его концентрация остается постоянной и не влияет на скорость реакции. Поэтому можно написать:
[Ag+]· [Cl–] = КAgCl · [AgCl] = const
Произведение концентраций ионов малорастворимого электролита в его насыщенном водном растворе в степенях, равных их стехиометрическим коэффициентам, при данной температуре есть величина постоянная и называется произведением растворимости. Произведение растворимости обозначают знаком ПР с индексом того электролита, о котором идет речь. Например:
[Ag+]· [Cl–] = ПРAgCl
или в общем виде для любого малорастворимого электролита
Химия. Лаб. практикум |
-49- |
