
e52ed3fc_opuholi
.pdfМинистерство здравоохранения и социального развития Российской Федерации Государственное бюджетное образовательное учреждение
высшего профессионального образования «Иркутский государственный медицинский университет»
Кафедра патологии с курсом клинической иммунологии и аллергологии
Учебное пособие для самоподготовки студентов медицинских факультетов по теме:
«Патофизиология опухолевого роста».
пособие составлено: доц.. Е.В.Гузовской, асс. Д.В. Бычковым
под редакцией зав. кафедрой патологии, проф. И.Ж. Семинского
Иркутск, 2011.
Вопросы для самоподготовки к теме занятия.
1.Определение опухоли.
2.Этиология опухолевого роста.
3.Клеточный цикл, его фазы.
4.Механизмы регуляции клеточного цикла.
5.Понятие о протоонкогенах и антионкогенах.
6.Паранеопластические синдромы.
7.Метастазирование, его этапы.
Опухоль – типовой патологический процесс, характеризующийся бесконтрольным нерегулируемым разрастанием тканей.
Опухоли традиционно принято делить на доброкачественные и злокачественные.
Для доброкачественных опухолей характерен лишь тканевой атипизм, т.е. нарушение соотношения между стромой и паренхимой, а для злокачественных – и клеточный, т.е. изменение свойств клетки.
Клеточный атипизм проявляется в виде:
1.генетического атипизма – увеличение ядерно-цитоплазматического отношения, наличие анеуплоидии и полиплоидии, хромосомных аберраций и генных мутаций.
2.иммунологического атипизма – экспрессия антигенов, не свойственных нормальным клеткам (например, синтез α-фетопротеина, в норме присутствующего в эмбриональных тканях).
3.биохимического атипизма – преобладание анаэробного гликолиза над аэробным, снижение антиоксидантной активности, неспособность эффективно синтезировать из ацетата и глюкозы жирные кислоты.
Относительные критерии доброкачественности и злокачественности
новообразований.
Критерий |
Доброкачественные |
Злокачественные |
|
опухоли |
опухоли |
Поверхность |
Гладкая, бывает |
Неровная, без капсулы |
|
капсула |
|
Размер |
Любой |
Очень большими бывают |
|
|
исключительно редко |
Скорость роста |
Низкая |
Высокая |
Характер роста |
Экспансивный |
Инфильтративный |
Степень дифференцировки |
Высокая, клетки |
Низкая, клетки |
|
мономорфны |
полиморфны |
Митотический индекс |
Соответствует норме |
Повышен, встречаются |
|
|
патологические митозы |
Кровеносные сосуды |
Нормальные |
Многочисленные, |
|
|
аномальные, может |
|
|
отсутствовать эндотелий |
Дегенеративные изменения |
Минимальны |
Выражены, бывают |
|
|
кровоизлияния, некрозы |
Метастазирование |
Нет |
Типично |
Генетический аппарат |
Нормальный |
Повышенное содержание |
|
кариотип и |
ДНК и аномалии |
|
содержание ДНК |
кариотипа |
Прогноз |
Редко |
Обычно без лечения |
|
обусловливают |
тяжелый или летальный |
|
смерть больного, |
|
|
даже если не лечатся |
|
|
(за исключением |
|
|
опухолей ЦНС) |
|
Этиология опухолевого роста.
Факторы, способные вызывать превращение нормальной клетки в опухолевую, называют канцерогенами. В роли канцерогенов могут выступать экзогенные (физические, химические, биологические) и эндогенные (гормоны, 3- метилхолантрен желчных кислот и др.) факторы. Рассмотрим основные теории канцерогенеза.
1.Механическая теория Р. Вирхова (теория хронического неспецифического раздражения).
Данная теория предполагает, что там, где клетки повторно повреждаются и регенерируют, возникает повышенный риск неоплазии. Клинический пример - возникновение рака привратника желудка в области пищевой дорожки. Экспериментальное подтверждение: развитие аденокарциномы желчного пузыря у морских свинок с вшитыми в желчный пузырь инородными телами.
2.Теория эмбриональной дистопии Ю. Конгейма.
По исходной версии данной теории, неоплазия – результат своеобразной формы дизэмбриогенеза. В организме сохраняются клетки эмбриональных зачатков, которые могут дистопироваться и претерпевать различные воздействия, приводящие их в активное состояние. Результатом их пролиферации являются опухоли. Данная теория имеет много подтверждений. Во-первых, многие из опухолевых клеток настолько мало дифференцированы, что по своим свойствам напоминают эмбриональные, во-вторых, такие опухоли как тератомы и эмбриомы напрямую происходят из зародышевых клеток.
3. Теория химического канцерогенеза.
Сформировалась в 18-19 вв. на основе теории Вирхова по мере развития промышленности. Было подмечено, что у трубочистов часто встречается рак мошонки, а у рабочих анилинового завода – рак мочевого пузыря. В начале 20 в. эта теория получила экспериментальное подтверждение. Японские патофизиологи К. Ямагива и К. Ишикава путем многократной аппликации каменноугольной смолы на кожу уха кролика получили сначала папиллому, а затем и плоскоклеточную карциному (см. рис.1). Позднее канцерогенные свойства были обнаружены у 3,4- бензпирена, бензидина, полициклических углеводородов (компоненты табачной смолы), полистирола, асбеста, тяжелых металлов, нитрозаминов и т.д. Афлатоксин В (антибиотик плесневого грибка) считается самым сильным химическим канцерогеном, т.к. доза в одну миллионную долю грамма на килограмм массы тела вызывает у животных в эксперименте рак печени после нескольких введений.

Химические канцерогены, взаимодействуя с ДНК (алкилирование, окисление, делеция ее участков), могут вызвать мутации, причем некоторые из этих мутаций не летальны для клеток, но вызывают экспрессию протоонкогенов или утрату антионкогенов (см. ниже). Некоторые вещества сами напрямую не взаимодействуют с ДНК, но могут усиливать действие канцерогенов, т.е. они являются коканцерогенами. Например, фенобарбитал не оказывает сам по себе мутагенного действия, но т.к. он индуцирует систему микросомального окисления в печени, то может усиливать образование канцерогенных метаболитов из проканцерогенов.
Рис.1. Моделирование папилломы и клоскоклеточной карциномы по Ямагиве и Ишикаве. Слева – опухоль, справа – микропрепарат опухоли.
4. Теория эндогенного химического канцерогенеза.
Еще в 1937 году известный отечественный онколог Шабад Л.М. заметил, что известный канцероген метилхолантрен очень схож по своему строению с дезоксихолевой кислотой. Позднее было выявлено, что желчь действительно обладает канцерогенными свойствами для мышей, к тому же в ней был обнаружен метилхолантрен. При медленном пассаже пищи дегидрирование желчных кислот в кишечнике способствует формированию канцерогенов, поэтому богатая пищевыми волокнами диета, ускоряющая перистальтику кишечника, является защитной в отношении рака толстой и прямой кишки. Получены убедительные доказательства канцерогенности и тератогенности промежуточных метаболитов фенилаланина и тирозина. Продукция данных метаболитов повышена у больных лейкозами и другими новообразованиями, а также у больных фенилкетонурией. Как риск
канцерогенеза необходимо рассматривать усиленное образование оксидантов в клетках, т.к. активные кислородные и галогеновые радикалы могут также оказывать мутагенный эффект при действии на ДНК. Более того, существует множество данных, свидетельствующих об антиканцерогенных свойствах таких антиоксидантов как селен, витамины С, Е, Р и т.д. Имеются сведения о способности гранулоцитарного фактора роста приводить к развитию миелолейкоза при длительном применении.
Важное место в теории эндогенного химического канцерогенеза занимают представления о дизгормональном онкогенезе. Гормонозависимые, гормонообразующие и гормоночувствительные опухоли известны давно. Например, рак простаты формируется при наличии повышенного содержания определенных дериватов андрогенов – дигидротестостерона, являющегося митогенным фактором для клеток простаты. В связи с этим кастрация и введение эстрогенов приводят к регрессу рака простаты и препятствуют развитию аденомы простаты. Но эстрогены могут быть и провокаторами роста опухолей. В 1932 году была получена модель рака молочной железы, индуцированная эстрогенным препаратом фолликулином. В данное время доказана эстрогензависимая природа рака молочной железы, шейки и тела матки, яичников.
5.Теория физического канцерогенеза.
Сразвитием технологий человек стал все более подвергаться выраженному воздействию невидимых глазом физических факторов – электромагнитных колебаний и различных ионизирующих излучений (инфракрасное, ультрафиолетовое, рентгеновское и радиоактивное). Наиболее чувствительны к излучениям ткани с высокой пролиферативной активностью. Инфракрасные лучи имеют минимальную канцерогенную способность. В ультрафиолетовом спектре наиболее мутагенна фракция с длиной волны 290-320 нм, т.к. она интенсивно поглощается ДНК и повышает реакционную способность молекул азотистых оснований. В результате могут формироваться мутантные гены. О роли УФ-лучей в канцерогенезе наглядно свидетельствует распространенность базально-клеточного рака кожи в странах с высокой естественной инсоляцией. В 1912 году путем рентгеновского облучения была получена саркома у крыс. После рентгенотерапии неоплазм нередко выявляются вторичные ятрогенные неопластические поражения.
Впервые годы после бомбардировки Хиросимы и Нагасаки заболеваемость в той местности лейкозами возросла в 2,5 раза. Также значительно повысилась заболеваемость раком молочной железы, легких, кишечника и щитовидной железы. Ионизирующие излучения могут сами или через оксиданты вызывать различные мутации, в том числе не только в момент лучевого воздействия, но и позже, при восстановлении структуры ДНК репаразной системой.
6.Теория вирусного канцерогенеза.
В настоящее время установлена возможность разных вариантов взаимодействия вируса и клетки. Если вирус подавляет синтез жизненно важных клеточных белков, синтезирует токсические для хозяина компоненты или индуцирует апоптоз – то эффектом деятельности будет гибель клетки-хозяина. Но возможна и интеграция генов ДНК-содержащего вируса в геном клетки. Если такая латентная инфекция затрагивает генетическую регуляцию роста клеток, то возможно развитие неопластической трансформации (рис.2). В эксперименте на
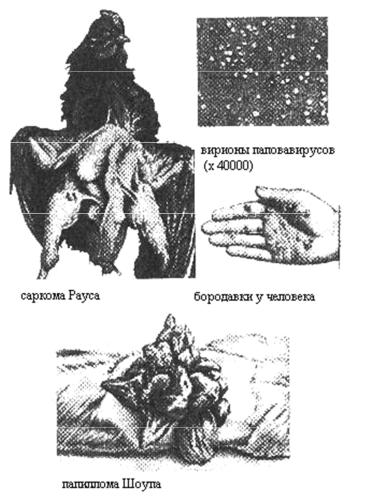
животных и в культурах клеток доказано, что вирус саркомы Рауса (куриный ретровирус) и SV40 (ДНК-содержащий вирус, выделенный у обезьян) способны вызывать трансформацию нормальных клеток в опухолевые. К вирусам, вызывающим развитие опухолей у человека относят: ДНКсодержащие вирусы папилломы (образование папиллом, рак шейки матки), вирус гепатита В (рак печени), вирус Эпштейна-Барр (лимфома Беркита у жителей Западной Африки и Папуа - Новая Гвинея, а у китайцев и инуитов рак носоглотки), а также РНКсодержащие вирусы Т-лейкоза человека типа I (HTLV-1).
Рис. 2 Саркома Рауса (куриная саркома, возбудитель – ретровирус С) и другие свидетельства участия вирусов в канцерогенезе.
7. Теория предраковых состояний.
Термин предрак введён в 1886г. М.В. Дюбреем. Картер Р.Л. определил
предраки как состояния и заболевания, которые переходят в рак так часто, что это может быть статистически предсказуемо. Beck S.C. в 1933г
разделил предрак на факультативный и облигатный. Считают, что облигатный, как правило, переходит в рак, а факультативный трансформируется в злокачественную опухоль гораздо реже.
Шабад Л.М. предложил 4 стадии развития злокачественной опухоли:
1.Неравномерная диффузная гиперплазия.
2.Появление очаговых пролифератов.

3. |
Стадия доброкачественной опухоли. |
|
|
4. |
Стадия злокачественной опухоли. |
|
|
Биологическая особенность клеток предраковых очагов |
- |
большая |
|
чувствительность к действию факторов, вызывающих клеточное деление. |
Переход |
||
в последнюю стадию зависит от экспозиции канцерогена и характера наступивших патологических изменений в тканях.
8. Клональная теория М. Бернета (1937 г).
Согласно ей, опухоль развивается из одной клетки-мутанта. Это происходит при нарушении работы иммунной системы, так как в норме генетически чужеродные клетки уничтожаются Т-киллерами.
Современные представления о патогенезе неоплазии.
Злокачественные новообразования относят к группе генетических болезней соматических клеток, так как в злокачественных клетках всегда имеются мутационные изменения на генном, хромосомном и геномном уровне. Мутации, появляющиеся в результате действия мутагенов биологической (вирусы), химической или физической природы, нарушают процессы клеточного деления. Для развития опухоли необходимо несколько последовательных мутаций, которые приводят к нарушению клеточного цикла.
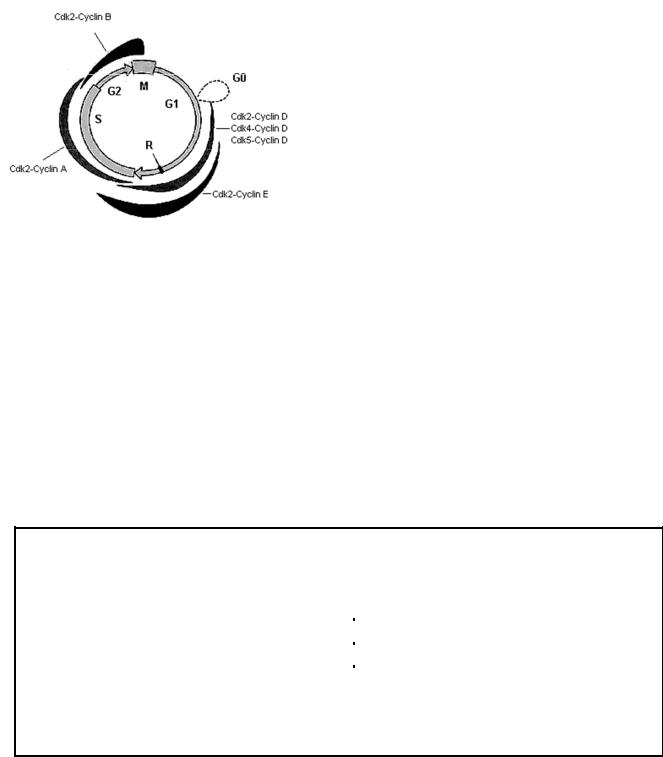
Краткие сведения о клеточном цикле. Клеточный цикл – это период жизни клетки от одного деления до другого или от деления до смерти (рис.3). Клеточный цикл состоит из интерфазы (период вне деления) и самого клеточного деления.
Если клетка собирается когда-нибудь делиться, то интерфаза будет состоять из трех периодов. Сразу после выхода из митоза клетка вступает в пресинтетический или G1 период, далее переходит в синтетический, или S период и потом - в постсинтетический или G2 период. G2 периодом заканчивается интерфаза, и после нее клетка вступает в следующий митоз.
Клетка, не планирующая снова делиться, вступает в период покоя, или G0 период. Если клетка, находящаяся в G0 периоде, будет делиться, то она выходит из G0 периода и вступает в G1 период. Таким образом, если клетка находится в G1 периоде, то она обязательно рано или поздно будет делиться, не говоря уже о S и G2 периодах, когда клетка в ближайшее время обязательно вступит в митоз.
Рис. 3 Клеточный цикл
Длительность периодов клеточного цикла различна. Наибольшим постоянством отличаются S, G1,2 периоды и митоз, а G0 период очень вариабелен. Так, G0 период может продолжаться от 2-4 ч до нескольких недель или даже месяцев. Как правило, продолжительность S периода варьирует от 6 до 8 ч, а G2 периода - от нескольких часов до получаса. Длительность митоза составляет в среднем от 40 до 90 минут. Причем самой короткой фазой митоза можно считать анафазу. Она занимает всего несколько минут.
G1 период характеризуется высокой синтетической активностью, так как клетка должна увеличить свой объём до размера материнской, а, значит, и количество органелл, различных веществ. И пока этого не произойдет, клетка продолжает оставаться в G1-периоде. Видимо, единственным исключением из этого является дробление, при котором бластомеры делятся, не достигая размеров исходных клеток.
Вконце G1 периода принято различать специальный момент, называемый R- точкой (точка рестрикции, R-пункт), после которого клетка обязательно в течение нескольких часов (обычно 1-2) вступает в S период. Период времени между R- точкой и началом S периода можно рассматривать в качестве подготовительного для перехода в S период. Самый главный процесс, который идет в S периоде, - это удвоение или редупликация ДНК. Все остальные реакции, происходящие в это время в клетке, направлены на обеспечение синтеза ДНК. К таким вспомогательным процессам можно отнести синтез гистоновых белков, синтез ферментов, регулирующих и обеспечивающих синтез нуклеотидов и образование новых нитей ДНК. В G2 периоде происходит синтез белков, из которых образуются микротрубочки веретена деления (тубулин, динеин, нексин, спектрин), происходит синтез АТФ.
Ворганизме существует два типа физиологической регуляции клеточного размножения.
1.Эндокринная регуляция, осуществляемая железами внутренней секреции (гипофиз, надпочечники, щитовидная, околощитовидные, поджелудочная и половые железы)
идействующая на весь организм.
2.Паракринная регуляция – активные вещества, распространяющиеся диффузией и действующие на соседние клетки-мишени (факторы роста – эпидермальный, факторы роста тромбоцитов, нервов и т.п.).
Сейчас является установленным, что прохождение клетки по всем периодам клеточного цикла строго контролируется. При движении клеток по клеточному циклу в них появляются и исчезают, активируются и ингибируются специальные регуляторные молекулы, которые обеспечивают прохождение клетки по определенному периоду клеточного цикла и переход из одного периода в другой. Одними из основных регуляторов клеточного цикла являются циклин-зависимые протеинкиназы (Cdk) и белки циклины.
Циклин-зависимые протеинкиназы присутствуют в клетке постоянно, независимо от периода клеточного цикла, то есть имеются в избытке. В норме без активирующего действия циклинов они не влияют на клеточный цикл. Если же синтез их нарушен, снижено количество или имеются мутантные формы с измененными свойствами, то это может повлиять на течение клеточного цикла.
Циклинов существует несколько типов, причем синтез каждого циклина происходит в строго определенный период клеточного цикла (рис.4)
Рис. 4 Изменения концентраций различных циклинов по фазам клеточного цикла. Толщина черных секторов отражает концентрацию циклинов
Например, ключевым белком, регулирующим вступление клетки в митоз (G2/M-переход), является специфическая серин/треонин-протеинкиназа (или Cdk2), которая активируется циклином В. В активной форме фермент фосфорилирует многие белки, принимающие участие в митозе, таких, например, как входящий в состав хроматина гистон H1, ламинин (компонент цитоскелета, обнаруженный в ядерной мембране), факторы транскрипции, белки митотического веретена и ряд ферментов. Фосфорилирование этих белков запускает процесс митоза. Остальные фазы клеточного цикла запускают другие циклины и соответствующие им Cdk (см. таблицу). После завершения митоза регуляторная субъединица – циклин – маркируется убиквитином и подвергается протеолизу. Этот процесс регулирует антионкоген р53. Затем наступает очередь протеинфосфатаз, которые дефосфорилируют белки, принимавшие участие в митозе, после чего клетка возвращается в состояние интерфазы.
РЕГУЛЯЦИЯ КЛЕТОЧНОГО ЦИКЛА
G1 период |
Cdk2 |
+ |
циклин |
D1 |
Cdk5 и циклин D3 |
|
|
||
|
|
|
||
R-пункт периода G1 |
Cdk2 + циклин С |
|
|
|
переход из G1 в S период |
Cdk2 + циклин Е |
|
|
|
переход из S в G2 период |
Cdk2 + циклин А |
|
|
|
переход из G2 периода в митоз (М |
Cdk2 + циклин В |
|
|
|
период) |
|
|
|
|
циклин H + Cdk7 необходим для фосфорилирования и активациии Cdk2 в комплексе с циклином В
Клетки человеческого тела делятся с весьма разными скоростями. Нейроны или клетки скелетной мышцы не делятся совсем, клетки печени обычно делятся раз
водин или два года, а некоторые клетки кишечного эпителия делятся чаще двух раз
всутки. Эти различия возникают благодаря неодинаковому распределению в этих тканях фермента теломеразы. Теломером называют многочисленный повтор последовательности нуклеотидов – ГГТТАГ- на 3΄-конце ДНК. После каждого клеточного деления происходит укорочение теломерной последовательности, чем и ограничено количество возможных клеточных делений. Поэтому в регулярно
обновляющихся клетках эпителия, крови активность теломеразы, которая восстанавливает теломер, высока. В нормальных нейронах и миоцитах теломераза не функционирует.
Деление опухолевых клеток нормальному контролю не подчиняется. Это может быть связано с дефектами любого звена регуляции клеточного цикла. Если нормальная клетка делится только в благоприятных условиях и при наличии внешнего митогенного сигнала, то опухолевая клетка нуждается лишь в эндогенном сигнале.
Гены, регулирующие клеточное деление можно разделить на две группы.
1.Гены, чьи продукты стимулируют пролиферацию клеток (т.н. протоонкогены, которые кодируют факторы роста, рецепторы к факторам роста, некоторые протеинкиназы, циклины, G-белки семейства ras или ядерные регуляторные белки).
2.Гены, чьи продукты тормозят пролиферацию (так называемые антионкогены, регулирующие клеточный цикл, запускающие апоптоз и подавляющие пролиферацию клеток)
Соответственно выделяют два типа мутаций, вызывающих неконтролируемый клеточный рост. Мутации генов первого типа приводят к гиперактивации, «стимулирующего» гена; они доминантны, а изменённый ген называется онкогеном (его нормальный аллель – протоонкогеном). Мутации второго типа инактивируют «ингибирующий» ген; они рецессивны (мутантный ген называется опухолевым супрессорным геном).
Внастоящее время известно около 100 протоонкогенов, каждый из которых может превращаться в онкоген. Выделяют следующие основные пути превращения протоонкогена в онкоген.
∙Делеция или точковая мутация – становится возможен синтез аномально активного протоонкобелка.
∙Амплификация гена – множественное копирование протоонкогена с образованием большого количества онкопротеинов.
∙Хромосомные транслокации – ведут к сближению или гибридизации протоонкогенов и регуляторных генов с последующей активацией.
∙Рекомбинация между протоонкогеном и ретровирусной РНК.
ДНК-овый вирус может проникать в клетку, непригодную для его размножения. Тогда вирусный ген, ответственный за активацию репликации клеточной ДНК, может транскрибироваться и подталкивать клетку в S-фазу клеточного цикла. Ретровирусы менее опасны для генома клетки. Однако изредка ретровирус может «случайно» захватывать регуляторный клеточный ген. Существует два механизма превращения протоонкогена в онкоген при включении в него ретровируса: изменение последовательности нуклеотидов или фрагментация гена и попадание протоонкогена под контроль мощных вирусных промоторов. Кроме того, ДНК-копии вирусной РНК могут встраиваться в геном клетке рядом с протоонкогеном или даже внутрь его (вставочный мутагенез).
Немалую роль в патогенезе неоплазии играет выпадение функций антионкогенов. Антионкогены могут утрачиваться в результате делеции генов либо становиться дефектными в результате точковых мутаций, что приводит к растормаживанию протоонкогенов. Антионкогены доминантны. Например, при
