
- •Учебно-методические указания к практическим занятиям по общей и неорганической химии
- •Основные атомные константы элементов периодической системы
- •Длины и энергии некоторых химических связей
- •Термодинамические свойства
- •Константы диссоциации слабых электролитов при 25оС
- •Произведения растворимости (пр) малорастворимых электролитов
- •Константы нестойкости (Кн) некоторых комплексных ионов
- •Стандартные восстановительные потенциалы в водных растворах
ГБОУ ВПО «ПЕРМСКАЯ ГОСУДАРСТВЕННАЯ
ФАРМАЦЕВТИЧЕСКАЯ АКАДЕМИЯ»
МИНИСТЕРСТВА ЗДРАВООХРАНЕНИЯ И СОЦИАЛЬНОГО РАЗВИТИЯ РОССИЙСКОЙ ФЕДЕРАЦИИ
КАФЕДРА ОБЩЕЙ И НЕОРГАНИЧЕСКОЙ ХИМИИ
Учебно-методические указания к практическим занятиям по общей и неорганической химии
(ДЛЯ СТУДЕНТОВ I КУРСА ОЧНОГО ОБУЧЕНИЯ)
ПЕРМЬ 2012
Методические указания содержат планы и краткое описание практических занятий по курсу общей и неорганической химии. Пособие предназначено для студентов первого курса ПГФА.
В подготовке «Учебно-методических указаний» принимали участие ассистенты Гущина Г.И., Фёдорова И.В., старшие преподаватели Сурикова О.В., Михалёв В.А., доцент Касимова Н.Н., профессор Михайловский А.Г.
Рецензент – доцент кафедры физической и коллоидной химии Рюмина Т.Е.
Рекомендовано к изданию ученым советом ПГФА
(протокол № 10 от 28 июня 2012 года)
ВВЕДЕНИЕ
Семинарские занятия и лабораторные работы являются составной частью курса общей и неорганической химии.
Методические указания можно условно разделить на две части. Первые двенадцать занятий посвящены вопросам общей химии. Вторая часть (5 занятий) посвящена изучению свойств элементов и их соединений на основе Периодического закона. Обе части тесно между собой связаны.
К каждому занятию необходимо готовиться дома. Основными источниками информации для подготовки к занятию являются конспект лекций и рекомендуемые учебники. Следует проработать не только теоретические вопросы, но и ответы на вопросы для подготовки к занятию и самоконтроля, а также составить по возможности уравнения реакций. На многих занятиях предусмотрены лабораторные работы. При подготовке к ним следует изучить описание опытов, составить необходимые уравнения реакций.
ОСНОВНЫЕ ПРАВИЛА РАБОТЫ В ХИМИЧЕСКОЙ ЛАБОРАТОРИИ
Ознакомиться с действующими инструкциями по технике безопасности и неукоснительно их соблюдать.
Работать только в халате.
Не загромождать свое рабочее место и содержать его в чистоте.
Опыты начинать только после внимательного ознакомления с руководством и выяснения всех непонятных вопросов у преподавателя.
Бережно относиться к оборудованию в лаборатории, реактивам и материалам. Не расходовать реактивов больше требуемого для опытов количества. Помнить, что избыточные количества сухих реактивов и растворов не положено возвращать обратно в банки с реактивами.
Все опыты, связанные с нагреванием, с применением концентрированных кислот и щелочей, а так же опыты по получению вредных газов (хлор, сероводород, сернистый газ и т.д.) проводить только в вытяжном шкафу при включенной вентиляции.
Не ставить склянки с реактивами на книги и тетради. Берегите их от попадания капель реактивов.
В лаборатории категорически запрещается принимать пищу.
После окончания работы в лаборатории вымыть пробирки, убрать рабочее место, сдать его дежурному и вымыть руки, так как многие вещества, с которыми приходится соприкасаться, являются ядовитыми.
Рекомендуемая литература
Общая химия. Биофизическая химия. Химия биогенных элементов: учебник для ВУЗов./ Ю.А. Ершов, В.А. Попков, А.С. Берлянд; под редакцией Ю.А. Ершова.- М.: Высш. шк., 2007,2005
Слесарев, В.И. Химия: Основы химии живого: учебник для ВУЗов. – С-Пб.: Химиздат, 2007,2005,2001
Глинка, Н.Л. Задачи и упражнения по общей химии / Н.Л. Глинка; ред. В.А. Рабинович, Х.М. Рубина. – М.: Интеграл-Пресс, 2005, 2001
Список сокращений.
Пр. – пробирка
к. – капля
п/к – по каплям
мкрш – микрошпатель
ЗДМ – закон действующих масс
ОВ – окислительно-восстановительные (свойства)
ОВР – ОВ реакции
КО – кислотно-основные (свойства)
СО – степень окисления
КЧ – координационное число
ОЭО – относительная электроотрицательность
ЗАНЯТИЕ 1
Тема: КЛАССЫ НЕОРГАНИЧЕСКИХ СОЕДИНЕНИЙ
Вопросы занятия:
Техника безопасности и правила работы в лаборатории.
Основные классы неорганических соединений: оксиды, основания, кислоты, соли. Классификация. Химические формулы. Номенклатура. Способы получения. Химические свойства. Генетическая связь классов неорганических соединений.
Самостоятельная работа по теме: «Классы неорганических соединений».
Вопросы для подготовки к занятию и самоконтроля
Какие из перечисленных ниже оксидов реагируют между собой: оксид кальция, оксид углерода (II), оксид фосфора (V), оксид углерода (IV), оксид серы (VI), оксид азота (I), оксид калия?
Оксид, в котором элемент проявляет свою максимальную степень окисления – это:
а) P2O5; б) Cl2O5; в) CO2; г) Cr2O3.
Гидратом какого оксида является трехосновная кислота?
а) Cl2O5; б) P2O5; в) N2O5; г) N2O3.
4. Приведите два уравнения реакций между оксидом углерода (IV) и гидроксидом кальция, приводящих к образованию разных солей.
5. Осадок сначала выпадает, а затем исчезает при:
а) добавлении раствора хлорида цинка к раствору гидроксида натрия;
б) пропускании углекислого газа через «известковую воду»;
в) сливании растворов сульфата натрия и хлорида бария;
г) сливании растворов карбоната натрия и азотной кислоты.
6. Цепочку превращений: металл → оксид металла → основание → соль можно осуществить для:
а) калия; б) алюминия; в) кальция; г) железа.
7. Напишите уравнения реакций, протекающих без изменения степеней окисления элементов по схеме:
гидроксид → карбонат → сульфат → хлорид → нитрат (все вещества хорошо растворимы в воде).
8. Алюминий растворили в концентрированном растворе гидроксида калия. Через полученный раствор пропускали углекислый газ до прекращения выделения осадка. Осадок отфильтровали и прокалили. Полученный твердый остаток сплавили с карбонатом натрия. Напишите уравнения описанных реакций.
9. Какие три соли из перечисленных пяти могут одновременно находиться в водном растворе: сульфат магния, карбонат натрия, хлорид меди (II), хлорид бария, нитрат натрия? Приведите два варианта ответа, сопроводив их при необходимости уравнениями реакций.
10. При взаимодействии 1 моль гидроксида кальция и 1 моль фосфорной кислоты образуется:
а) фосфат кальция; в) гидрофосфат кальция;
б) дигидрофосфат кальция; г) фосфат кальция?
11. При написании какой формулы допущена ошибка:
а) (ZnOH)2SO4; б) Na3PO4; в) NaH2PO4 ; г) AlHSO4 ?
12. Выразите в виде уравнений реакций следующие цепочки превращений:
K2O → K2CO3 → KHCO3 → K2CO3 → CO2;
б) Fe → Fe2O3 → Fe2(SO4)3 → Fe(OH)3 → Fe(OH)2NO3 → Fe(NO3)3;
в) Cr2O3 → Cr2(SO4)3 → Cr(OH)3 → Na3[Cr(OH)6] → Cr(OH)3.
13.
В цепочке превращений FeS
![]() X1
X1
![]() X2
веществами Х1
и Х2
являются
соответственно:
X2
веществами Х1
и Х2
являются
соответственно:
а) FeCl2 и FeO; в) FeCl3 и Fe2O3;
б) H2S и SO3; г) H2S и SO2.
14. В схеме превращений ZnO → X1 → X2 → Zn(OH)2 веществами Х1 и Х2 являются соответственно:
а) Zn(OH)2 и ZnCl2; в) ZnCl2 и ZnSO4;
б) Zn(OH)2 и ZnSO4; г) ZnCl2 и ZnO.
15. Составьте в молекулярной и ионной форме не менее трех необратимо протекающих реакций с участием:
а) сульфата цинка; б) хлорида железа (III); в) карбоната аммония.
16. К раствору, содержащему смесь хлорида калия и сульфата натрия, сначала добавили избыток натрата бария, а затем – избыток нитрата серебра. Какие ионы остались в растворе? Напишите уравнения реакций в ионном виде.
17. Назовите следующие соединения: NaNO2, Mg(HCO3)2, CaSiO3, Al(OH)2NO3, Na3[Al(OH)6], NH4HS.
18. Составьте формулы следующих соединений: дигидрофосфат аммония, сульфит кальция; нитрат гидроксохрома (III); сульфид аммония; сульфат гидроксомагния.
ЗАНЯТИЕ 2
Тема: СТРОЕНИЕ АТОМА. ПЕРИОДИЧЕСКИЙ ЗАКОН
Д.И. МЕНДЕЛЕЕВА
Вопросы семинара:
Основные модели строения атомов: планетарная модель Резерфорда, модель Бора, квантовомеханическая модель. Двойственная природа электрона, соотношение де Бройля. Принцип неопределённости Гейзенберга. Понятие волновой функции и атомной орбитали.
Квантовые числа, их физический смысл и значение. Принцип Паули, правило Гунда, правило Клечковского. Электронные и электронографические формулы (ЭФ и ГЭФ).
Периодический закон (ПЗ) и периодическая система (ПС) Д.И. Менделеева: формулировка Д.И.Менделеева и современная формулировка. Физический смысл ПС, теоретическое обоснование. Короткая и длинная формы ПС. Периоды малые (короткие) и большие (длинные).
Классификация элементов ПС. Непереходные элементы (s-, p-элементы). Переходные элементы (d-, f-элементы). Понятие об электронных аналогах. Электронное строение аналогов главных и побочных подгрупп ПС. Сходство и различие в свойствах соединений элементов главной и побочной подгрупп ПС.
Основные атомные константы: радиус атома (Rат.), потенциалы ионизации (I), энергия средства к электрону (Е), относительная электроотрицательность (ОЭО), их изменение по группам и периодам. Характер изменения свойств простых и сложных веществ.
Вопросы для подготовки к занятию и самоконтроля
Какое из указанных ниже теоретических положений можно отнести к основным положениям квантовой теории:
а) электрон вращается вокруг ядра только по определённым стационарным орбитам;
б) соотношение Эйнштейна Е = mC2;
в) принцип неопределённости Гейзенберга;
г) изотопы одного элемента различаются массовыми числами.
Энергетический уровень соответствует:
а) значению главного квантового числа;
б) номеру группы в периодической системе;
в) значению орбитального квантового числа;
г) количеству p-электронов на внешнем слое.
Какой квантовый уровень заполняют электроны, какова форма электронного облака, если значения КЧ:
а) n=4, l=3; б) n=2, l=0; в) n=5, l=3; г) n=6, l=2;
Составьте электронные формулы атомов элементов с зарядами ядра: 15, 24, 35, 43, 50, 82.
Определите местоположение элементов в периодической системе (период, группа, подгруппа) по приведённым ниже конфигурациям валентных электронов: 4s24p5, 5d56s2, 3d44s2, 4d85s2, 5d106s2, 3s23p3.
Приведите общие формулы электронных аналогов подгрупп элементов: B, N, O, Ti, V, Cr, Mn, Ni, Cu.
Какие степени окисления могут проявлять эти элементы? Какова взаимосвязь между степенью окисления и окислительно-восстановительными свойствами?
Химический элемент (Э) находится в 4-м периоде, имеет формулу высшего оксида ЭО3, летучего водородного соединения не образует. О каком элементе идёт речь?
К какой группе элементов (щелочные металлы, галогены, переходные элементы и т.д.) следовало бы отнести элементы с порядковыми номерами 111, 115, 117.
Дана группа элементов: Mn, V, As, Ti.
Какой из этих элементов имеет наибольшее число неспаренных электронов в основном состоянии?
Дана группа элементов: In, Sb, Sn, Co.
Какой из этих элементов имеет наименьшее число неспаренных электронов в основном состоянии?
Изоэлектронные частицы – частицы, имеющие одинаковое электронное строение. Какие частицы в данном ряду изоэлектронны: Fe2+, Mn2+, Co3+, Ni2+? Какому элементу изоэлектронны Cl-,K+?
В каком ряду элементов происходит возрастание радиуса атомов:
а) Ca, Ge, As в) Si, Al, Mg, Na.
б) Sr, Ca, Mg, Be. г) I, Br, Cl, F.
Как изменяется первый потенциал ионизации в главной подгруппе с увеличением порядкового номера элемента? Как изменяются восстановительные свойства элементов IIА – подгруппы от Be к Ra?
Чем различаются между собой понятия энергии сродства к электрону и электроотрицательности? Как изменяется электроотрицательность p-элементов в подгруппе с увеличением порядкового номера элементов? Окислительные свойства какого из элементов – фосфора или сурьмы – выражены сильнее? Приведите обоснованные ответы.
Каковы для s- и p-элементов одного периода тенденции изменения Rа., E, I, и ОЭО с увеличением порядкового номера элемента? Как и почему изменяются окислительные и восстановительные свойства элементов от натрия к хлору?
Какой из двух сравниваемых элементов обладает более выраженными металлическими свойствами: а) ванадий или мышьяк; б) галлий или мышьяк; в) висмут или мышьяк?
В каком ряду элементов происходит возрастание относительной электроотрицательности атомов:
а) F, Cl, Br, I; в) N, P, As, Sb;
б) B, C, N, O; г) B, Al, Ga, In.
ЗАНЯТИЕ 3
Тема: ХИМИЧЕСКАЯ СВЯЗЬ И СТРОЕНИЕ МОЛЕКУЛ
Вопросы семинара:
Типы химической связи. Ковалентная химическая связь. Расчёты Гейтлера и Лондона. Метод валентных связей.
Типы, механизмы образования и свойства ковалентной связи.
Теория гибридизации, типы гибридизации.
Пространственное строение ковалентных молекул.
Относительная электроотрицательность атомов. Степень ионности связи. Ионная и металлическая связь.
Межмолекулярные связи: водородные связи; ван-дер-ваальсовы взаимодействия.
Типы кристаллических решёток. Зависимость физических свойств веществ от типа кристаллической решётки.
Контрольная работа по теме «Строение атома и химическая связь».
Вопросы для подготовки к занятию и самоконтроля
Каков характер химической связи в соединениях: HBr, NH3, CaH2 , если атомы имеют следующие значения ОЭО: H – 2,1; Br – 2,8; N – 3,07; Ca – 1,04? Для сравнения: Na – 0,93; Cl – 3,0.
Выберите пару молекул, все связи в которых ионные:
а) KF, Na2O б) SO3, CaCl2 в) СH3COOH, KI г) PCl5, N2O3
В каком соединении – HСlO, HBrO или HIO - степень ионности связи O-Hal выше, если атомы имеют следующие значения ОЭО: O - 3,5;
Cl – 3,0; Br – 2,8; I – 2,6?
Каков механизм образования ковалентных связей
а) в молекуле CH4; б) в ионе NH4 +?
Чему равна кратность связи в молекулах?
а) HF; б) CO2; в) N2
Укажите положение, противоречащее теории гибридизации:
а) гибридизации подвергаются орбитали, близкие по форме и энергии;
б) гибридные орбитали имеют разную энергию;
в) в процессе гибридизации изменяется пространственная ориентация орбиталей;
г) суммарное число орбиталей не изменяется
В какой из молекул валентный угол центрального атома наименьший?
а) SiCl4; б) CO2; в) SeO2
Атом кислорода в молекуле OF2 находится в sp3-гибридизации. В гибридизации принимают участие одноэлектронные облака и две неподелённые электронные пары. Какую форму имеет молекула?
Атом углерода в молекуле COСl2 (фосген) находится в sp2-гибридизации. В гибридизации принимают участие только одноэлектронные облака. Какую форму имеет молекула?
Суммарный дипольный момент какой молекулы равен нулю?
а) SO2Cl2 (форма тетраэдрическая);
б) BeF2 (форма линейная);
в) H2O (форма угловая)
г) NH3 (форма пирамидальная)
Какое свойство не характерно для веществ с молекулярной кристаллической решёткой?
а) в расплавленном состоянии являются сильными электролитами;
б) в твёрдом состоянии являются изоляторами;
в) имеют невысокие температуры плавления;
г) не обладают высокой твёрдостью.
Для какой кристаллической решётки характерно наличие общих электронов, свободно перемещающихся между атомами («электронный газ»)?
ЗАНЯТИЕ 4
Тема: ОСНОВНЫЕ ЗАКОНОМЕРНОСТИ ПРОТЕКАНИЯ ХИМИЧЕСКИХ РЕАКЦИЙ. ЭНЕРГЕТИКА И НАПРАВЛЕНИЕ ХИМИЧЕСКИХ РЕАКЦИЙ
Вопросы семинара:
Основные понятия химической термодинамики: система, фаза, параметры состояния, функции состояния, энергия.
Первый закон (первое начало) термодинамики. Теплота и работа.
Тепловые эффекты химических реакций. Энтальпия.
Термохимия. Закон Гесса и следствия из него.
Второе начало термодинамики. Энтропия. Самопроизвольные процессы в изолированных системах.
Свободная энергия Гиббса. Уравнение Гиббса и его анализ. Самопроизвольные процессы в закрытых системах.
Вопросы для подготовки к занятию и самоконтроля
К какому типу относится система, состоящая из насыщенного раствора солей и кристаллов, находящихся в сосуде Дьюара (термосе):
а) по составу
б) по характеру взаимодействия с окружающей средой?
Чему равен тепловой эффект реакции в изобарно-изотермических условиях?
а) сумме энтальпий образования продуктов реакции
б) энтальпии реакции с обратным знаком
в) стандартной энтальпии
г) работе против внешних сил
3. Что такое термохимические уравнения реакций? Составьте термохимическое уравнение на основе следующих данных: при взаимодействии 20 г оксида магния с углекислым газом выделилось 51 кДж тепла.
4. Рассчитайте тепловой эффект реакции:
ZnO(к) + SO3(г) = ZnSO4(к)
5. Какое из веществ энергетически более ценно для организма, если их окисление протекает по реакциям:
а) 2C3H8O3(ж) + 7O2(г) = 6CO2(г) + 8H2O(ж)
б) C2H5OH(ж) + 3O2(г) = 2 CO2(г) + 3H2O(ж)
6. В изолированной системе самопроизвольно протекают процессы, при которых:
а) Δ G > 0
б) Δ S < 0
в) Δ G < 0
г) Δ H < 0
7. Не используя табличных данных, определите знак изменения энтропии в реакциях:
а) 2H2 (г) + O2 (г) = 2H2O(г)
б) H2SO4(ж) + Fe(к) = FeSO4(к) + H2(г)
в) NH4NO3 (к) = N2O(г) + 2H2O(г)
Н

+50
∆G
а рисунке представлена зависимость ∆G реакции от абсолютной температуры. Эта реакция возможна:

а
T
б )
только при высоких температурах
)
только при высоких температурах
в) при любых температурах
г
-50
ЗАНЯТИЕ 5
Тема: ОСНОВНЫЕ ЗАКОНОМЕРНОСТИ ПРОТЕКАНИЯ ХИМИЧЕСКИХ РЕАКЦИЙ. СКОРОСТЬ ХИМИЧЕСКИХ РЕАКЦИЙ. ХИМИЧЕСКОЕ РАВНОВЕСИЕ
Вопросы семинара:
Понятие о скорости химической реакции. Зависимость скорости химической реакции от концентрации реагирующих веществ. Закон действующих масс для скоростей реакций. Константа скорости.
Зависимость скорости химической реакции от температуры. Правило Вант-Гоффа. Понятие об энергии активации.
Обратимые и необратимые реакции. Константа химической реакции и её связь с энергией Гиббса.
Принцип Ле Шателье. Определение направления смещения химического равновесия.
Лабораторная работа.
Контрольная работа по теме «Основные закономерности протекания химических реакций».
Лабораторная работа
Опыт 1. Влияние концентрации реагирующих веществ на скорость гомогенной химической реакции.
В опыте предстоит изучить влияние концентрации тиосульфата натрия на скорость его взаимодействия с серной кислотой:
Na2 S2 O3 + H2 SO4 = S↓ + SO2 + Na2 SO4 + H2O
Реакция протекает достаточно медленно и сопровождается выделением в осадок серы. Скорость реакции условно можно выразить как величину, обратную времени протекания реакции (от момента смешения реагентов до помутнения раствора).
Проведите перед началом работы качественный опыт, чтобы научиться отмечать момент начала помутнения раствора (наблюдайте на темном фоне).
Начертите в тетради нижеприведенную таблицу и заполните её.
|
№ пробирки |
Число капель р-ра Na2S2O3 |
Число капель H2 O |
Сумма капель |
Конц. Na2S2O3 относ. |
Число ударов метронома n |
Скорость относ. 100/n |
|
1 |
2 |
8 |
10 |
С |
|
|
|
2 |
4 |
6 |
10 |
2С |
|
|
|
3 |
6 |
4 |
10 |
3С |
|
|
|
4 |
8 |
2 |
10 |
4С |
|
|
|
5 |
10 |
0 |
10 |
5С |
|
|
В пять сухих пробирок внесите раствор тиосульфата натрия и воду в соответствии с таблицей. Установите пробирки в гнезда штатива в соответствии с их нумерацией. Возьмите пробирку №1, внесите в неё 1 каплю серной кислоты и сразу же начните отсчёт ударов метронома. В момент начала помутнения раствора прекратите отсчёт. Запишите величину n в таблицу. Аналогично определите время реакции в остальных пробирках, результаты внесите в таблицу.
Постройте график зависимости скорости реакции от концентрации тиосульфата натрия. Масштаб оси х: 3 тетрадных клетки – С, 6 клеток – 2С и т.д. Масштаб оси у: в зависимости от конкретных значений скорости (наибольшее значение скорости должно находиться не менее чем в 10 клетках от начала координат). Перед тем как соединить точки линией, подумайте: а) какова зависимость скорости от концентрации? б) должен ли график проходить через начало координат?
Опыт 2. Зависимость скорости гомогенной химической реакции от температуры.
В опыте предстоит изучить влияние температуры на скорость взаимодействия тиосульфата натрия с серной кислотой. Для этого реакцию проводят трижды при различных значениях температуры, оставляя неизменными концентрации реагентов.
Начертите нижеприведенную таблицу и заполните её.
|
№ пробирки |
Число капель р-ра Na2S2O3 |
Число капель H2O |
Температура опыта, °С |
Число ударов метронома n |
Скорость (относит.) 100/n |
|
1 |
5 |
5 |
20 |
|
|
|
2 |
5 |
5 |
30 |
|
|
|
3 |
5 |
5 |
40 |
|
|
В 3 сухих пробирки внесите раствор тиосульфата натрия и воду в соответствии с таблицей. Поместите пробирки в гнёзда термостатов, роль которых выполняют стаканы, наполненные водой заданной температуры (температура опыта). В термостатах уже находятся три пробирки с раствором серной кислоты. Выдержите пробирки в термостатах не менее 5 минут.
Выньте пробирку №1 из термостата (20°) и внесите в неё 1 каплю серной кислоты из того же термостата; сразу же начните отсчет ударов метронома. В момент начала помутнения раствора прекратите отсчет. Запишите величину n в таблицу. Аналогично определите время реакции в остальных пробирках. Вычислите скорость реакции во всех пробирках, результаты внесите в таблицу.
Постройте график зависимости скорости реакции от температуры. По оси х отложите значения температуры 0°, 10°, 20°, 30°, 40° (10° – 3 тетрадных клетки), по оси y – скорость реакции. Соедините точки плавной кривой. Почему зависимость скорости от температуры не имеет линейного характера? Если экстраполировать скорость к нулевой температуре, то пройдет ли график через начало координат? Используя полученные экспериментальные значения скоростей реакции при 40°, 30° и 20°, вычислить температурный коэффициент для каждого опыта и его среднее значение.
Опыт 3. Химическое равновесие и его смещение путем изменения концентрации реагирующих веществ.
В опыте исследуется положение химического равновесия реакции:
FeCl3 + 3 KCNS → Fe(CNS)3 + 3 KCl
красное
окрашивание
Все вещества, кроме роданида железа, практически не имеют окраски. Поэтому по усилению или ослаблению окрашивания можно судить о том, в каком направлении смещается химическое равновесие.
Пр.1 (контрольная): 10 к. 0,0008 М р-ра FeCl3 + 10 к. 0,0025 М р-ра KCNS. Полученный раствор пипеткой перенести в три пробирки по 5 капель.
Пр.2: + 5 к. насыщ. р-ра FeCl3 .
Пр.3: + 5 к. насыщ. р-ра KCNS.
Пр.4: + 2 мкрш. KCl.
Сравнить окраску в пробирках 2,3,4 с окраской в контрольной пробирке. Сделать вывод о направлении смещения химического равновесия. Написать выражение для константы равновесия. Изменяется ли её значение при смещении химического равновесия?
Вопросы для подготовки к занятию и самоконтроля
Чему равна средняя скорость химической реакции (моль/л∙мин), если концентрация одного из реагирующих веществ в начальный момент времени была равна 2 моль/л, а через 35 минут стала равной 1,3 моль/л?
Составьте выражения ЗДМ для скорости следующих реакций:
а) I2(р) + H2S(р) = 2HI(р) + S(к)
б) 2HNO3(р) + Ca(OH)2(р) = Ca(NO3)2 (р) + 2H2O(ж)
в) NH4NO3(к) = N2O(г) + 2H2O(ж)
Как изменится скорость реакции
2NO(г) + Cl2(г) = 2NOCl(г) , если:
а) концентрацию оксида азота увеличить в 2 раза, а концентрацию хлора – уменьшить в 4 раза;
б) повысить концентрацию хлора в 3 раза;
в) снизить давление вдвое?
Какой фактор не влияет на константу скорости реакции в газовой фазе?
а) природа реагирующих веществ
б) давление
в) температура в системе
г) присутствие катализатора
При 100°С некоторая реакция заканчивается за 16 мин. Через какое время закончится эта реакция, если проводить её при 150°С, учитывая, что температурный коэффициент скорости равен 2?
При 25°С срок хранения микстуры 10 дней. При какой температуре срок хранения составит 30 дней, если температурный коэффициент скорости равен 3?
Составьте выражения для констант равновесия следующих реакций:
а) CO(г) + Cl2(г) = COCl2(г)
б) CaCO3(к) = CaO(к) + CO2(г)
в) NO(г) + NO2(г) = N2O3(к)
Вычислить константу равновесия реакции A + B = 2C, если начальные концентрации веществ: A – 3 моль/л, B – 5 моль/л, а равновесная концентрация вещества C равна 2 моль/л.
Как следует одновременно изменить температуру и давление в системе, чтобы сместить равновесие реакции вправо:
N2(г) + 3H2(г) = 2NH3(г) ; ∆H = -92,4 кДж
Как нужно изменить давление в системе, чтобы уменьшить образование угарного газа:
C(к) + CO2(г) = 2CO(г)
ЗАНЯТИЕ 6
Тема: СПОСОБЫ ВЫРАЖЕНИЯ КОНЦЕНТРАЦИИ РАСТВОРОВ И СТЕХИОМЕТРИЧЕСКИЕ РАСЧЕТЫ С ИХ УЧАСТИЕМ
Вопросы семинара:
Массовая доля растворённого вещества. Формулы, связывающие массу растворённого вещества, его объем и плотность.
Особенности расчета массы растворённого вещества при приготовлении раствора из кристаллогидрата. Понятие «кристаллогидрат».
Расчеты, связанные с «укреплением» и разбавлением растворов.
Молярная концентрация раствора.
Молярная концентрация эквивалента раствора. Эквивалент вещества. Фактор эквивалентности. Особенности расчёта фактора эквивалентности участников кислотно-основных и окислительно-восстановительных реакций. Закон эквивалентов. Применение закона эквивалентов.
Переход от одного вида концентрации (массовая доля) к другому (молярность).
Расчёт титра раствора.
Лабораторная работа.
Лабораторная работа
(выполняется по индивидуальным заданиям)
а) приготовление раствора требуемой концентрации из кристаллогидрата и воды, измерение плотности раствора;
б) расчёт молярной концентрации приготовленного раствора;
в) расчёт молярной концентрации эквивалента приготовленного раствора;
г) приготовление нового раствора путём разбавления исходного;
д) расчёт титра вновь приготовленного раствора.
Вопросы для подготовки к занятию и самоконтроля
Для приготовления 10% раствора соли надо взять:
а) 5г соли и 50г воды;
б) 5г соли и 45г воды;
в) 10г соли и 100г воды;
г) 10г соли и 1л воды.
Молярную концентрацию раствора рассчитывают по формуле:
а)
![]() в)
в)![]()
б)
![]() г)
г)![]()
Какую массу гидроксида калия необходимо взять для приготовления
300 мл раствора с молярной концентрацией 0,2 моль/л?
а) 1,07г; б) 60г; в) 3,36г; г) 1,5г.
Чему равен фактор эквивалентности фосфорной кислоты в реакции
H3PO4 + 2 NaOH → Na2HPO4 + 2 H2O?
а) 1; б) 1/3; в) 1/2; г) 3.
Чему равен фактор эквивалентности восстановителя в реакции
KBr + Cl2 → KCl +Br2?
а) 2; б) 1/2; в) 1; г) 3.
Сколько надо взять хлорида калия для приготовления 200мл 6%-го раствора с плотностью 1,1г/мл?
Рассчитайте массовую долю вещества (%) в растворе, полученном при сливании 60г 10%-го и 20г 30%-го растворов.
Рассчитайте массу медного купороса и объём воды, необходимые для приготовления 320г 5%-го раствора CuSO4.
Рассчитайте молярную концентрацию раствора, если известно, что для его приготовления взято 5г хлорида натрия и 135г воды (плотность раствора равна 1,07г/мл).
Рассчитайте объём 10%-го раствора гидроксида калия (плотность раствора 1,12 г/мл), который потребуется для приготовления 200мл раствора с молярной концентрацией эквивалента 0,5моль/л.
ЗАНЯТИЕ 7
Тема: РАСТВОРЫ И ИХ СВОЙСТВА. ХИМИЧЕСКИЕ РАВНОВЕСИЯ В РАСТВОРАХ ЭЛЕКТРОЛИТОВ
Вопросы семинара:
Контрольная работа по теме «Способы выражения концентрации растворов».
Основные определения: раствор, растворитель, растворенное вещество, растворимость. Классификация растворов: жидкие, твёрдые, газообразные, концентрированные, разбавленные, насыщенные, ненасыщенные, пересыщенные.
Процесс растворения как физико-химический процесс. Термодинамика процесса растворения.
Коллигативные свойства растворов. Биологическое значение осмоса. Осмотическое давление. Изотонические, гипо- и гипертонические растворы.
Теория электролитической диссоциации. Электролиты и неэлектролиты. Основные положения теории. Кислоты, основания и соли как электролиты. Степень и константа диссоциации. Сильные и слабые электролиты. Закон разбавления Оствальда и расчёты на его основе.
Ионные реакции в растворах электролитов. Условия протекания.
Ионное произведение воды. Водородный показатель pH. Расчёт pH в растворах кислот и оснований. Индикаторы.
Лабораторная работа.
Лабораторная работа
Опыт 1. Тепловые эффекты процессов растворения (демонстрация).
Опыт 2. Сравнение электропроводности различных растворов: глюкозы, хлорида натрия, соляной кислоты, уксусной кислоты, гидроксида натрия, гидроксида аммония, водопроводной воды (демонстрация).
Опыт 3. Экспериментальная проверка закона разбавления Оствальда на основе определения электропроводности растворов (демонстрация).
Опыт 4. Окраска некоторых кислотно-основных индикаторов в кислой, нейтральной и щелочной среде.
Пр.1: 10-15к. H2O + 1к. HCl + 2к. лакмуса.
Пр.2: 10-15к. H2O + 1к. NaOH + 2к. лакмуса.
Отметьте окраску индикатора в каждой из пробирок. Проделайте тот же опыт с метиловым оранжевым и фенолфталеином. Результат опыта оформите в виде таблицы.
|
Индикатор |
Интервал (рН) перехода окраски |
Окраска индикатора в среде | ||
|
кислой |
нейтральной |
щелочной | ||
|
Лакмус |
5,0-8,0 |
|
|
|
|
Метиловый оранжевый |
3,1-4,4 |
|
|
|
|
Фенолфталеин |
8,0-9,8 |
|
|
|
Опыт 5. Приближенное определение рН раствора с помощью универсальной индикаторной бумаги.
Нанесите на полоску универсальной индикаторной бумаги 1-2 капли испытуемого раствора. Немедленно сравните окраску мокрой полоски со шкалой цветов, которая нанесена на пенал. Приближённое значение рН внесите в таблицу:
|
Испытуемые растворы |
HCl 0.1н |
CH3COOH 0,1н |
NaOH 0,1н |
NH4OH 0,1н |
AlCl3 р-р |
NaHCO3 р-р |
|
Величина рН |
|
|
|
|
|
|
Опыт 6. Смещение равновесия диссоциации слабой кислоты в присутствии соли этой кислоты.
Пр.1,2: по 8-10к. р-ра CH3COOH + 2к. метилоранжа.
Пр.1 – контрольная. Пр.2: + 2мкрш. CH3COONa. Сравнить окраску пр.2 с контрольной. Написать уравнение диссоциации уксусной кислоты и объяснить, как смещается это равновесие при добавлении ацетат-иона? Как меняется при этом концентрация Н+ - ионов?
Опыт 7. Смещение равновесия диссоциации слабого основания в присутствии соли этого основания.
Пр. 1,2: по 8 -10к. р-ра NH4OH + 1к. фенолфталеина.
Пр.1 – контрольная. Пр.2 + 2мкрш. NH4Cl. Сравнить окраску Пр.2 с контрольной. Написать уравнение диссоциации гидроксида аммония и объяснить, как смещается это равновесие при добавлении ионов аммония? Как меняется при этом концентрация ОН- - ионов?
Вопросы для подготовки к занятию и самоконтроля
Формула Pосм. = iCRT применима:
а) только к растворам неэлектролитов;
б) только к растворам электролитов;
в) к растворам слабых электролитов;
г) к любым растворам.
Изотоничны ли водные растворы сахарозы C12H22O11 и глицерина C3H8O3 c массовой долей 1%:
а) нет, не изотоничны;
б) Pосм.(С12H22O11) > Pосм.(С3H8O3)
в) да, изотоничны;
г) данных недостаточно.
3. Отношение числа молекул электролита, распавшихся на ионы, к общему числу молекул называется:
а) константой диссоциации;
б) степенью диссоциации;
в) степенью гидролиза;
г) константой гидролиза.
4. Формула слабого электролита:
а) H2SO4; б) HNO2; в) KCl; г) NaOH.
5. Какие ионы могут образоваться при диссоциации Fe(OH)2?
а) Fe2+ и OH-; б) Fe2+, OH- и FeOH+;
в) FeOH+ и OH-; г) Fe2+.
6. Степень диссоциации гидроксида аммония можно увеличить при:
а) разбавлении;
б) охлаждении;
в) добавлении хлорида аммония;
г) подщелачивании.
7. Степень диссоциации фтороводородной кислоты можно уменьшить при:
а) разбавлении;
б) нагревании;
в) подщелачивании;
г) подкислении.
8. Концентрация H+- ионов (моль/л) составляет 10-5. Чему равна концентрация OH- ионов:
а) 10-14; б) 10-10; в) 10-9; г) 10-7.
9. Определите рН раствора уксусной кислоты с молярной концентрацией 0,005моль/л.
10. Определите рН 0,2%-го раствора хлороводородной кислоты с плотностью 0,1г/мл.
11. Рассчитайте концентрацию Н+- ионов в сантимолярном растворе KOH.
12. Найдите рН децимолярного раствора гидроксида аммония.
13. Составьте в молекулярной и ионной форме уравнения нижеприведённых реакций. Соблюдаются ли условия протекания ионообменных реакций?
а) CaCO3 + HCl → … д) BiI3 + KI → …
б) Zn(OH)2 + HNO3 → … е) MnS + HCl → …
в) Zn(OH)2 + NaOH → … ж) Ca(OH)2 + CO2 → …
г) Ca (HCO3)2 + NaOH → … з) CH3COOH + NaOH → … .
ЗАНЯТИЕ 8
Тема: РАСТВОРЫ И ИХ СВОЙСТВА. ХИМИЧЕСКИЕ РАВНОВЕСИЯ В РАСТВОРАХ ЭЛЕКТРОЛИТОВ
(продолжение)
План занятия и вопросы семинара
Контрольная работа по теме: «Ионные реакции, рН растворов».
Понятие «гидролиз». Основные случаи гидролиза солей: Гидролиз по аниону; по катиону; по катиону и аниону. Какие соли не подвергаются гидролизу? Почему?
Степень и константа гидролиза. Расчёт константы, степени гидролиза и величины рН растворов гидролизующихся солей.
Смещение равновесия гидролиза. Необратимый гидролиз.
Современные представления о кислотах и основаниях. Протолитическая теория Бренстеда-Лоури.
Лабораторная работа.
Лабораторная работа
Опыт 1. Гидролиз солей.
Пользуясь универсальной индикаторной бумагой, определить рН растворов солей, предложенных преподавателем. Приближённое значение рН внести в таблицу:
|
Раствор соли |
рН |
Раствор соли |
рН |
|
Al2(SO4)3 |
|
MgSO4 |
|
|
Na2S |
|
ZnSO4 |
|
|
Na2CO3 |
|
CH3COONH4 |
|
|
FeCl3 |
|
Na3PO4 |
|
|
Na2SO3 |
|
K2CO3 |
|
Опыт 2. Гидролиз смеси солей с противоположным характером среды (полный гидролиз).
Пр.1: 5к. р-ра Al2(SO4)3 + 5к. р-ра Na2S = осадок + газ.
Пр.2: 5к. р-ра Al2(SO4)3 + 5к. р-ра Na2CO3 = осадок + газ
Доказать, что в обеих пробирках в осадок выпало одно и то же вещество – Al(OH)3, используя его амфотерные свойства. Объяснить причину образования этого осадка. Написать уравнения реакций в молекулярной и ионной форме.
Вопросы для подготовки к занятию и самоконтроля
Какая соль не подвергается гидролизу? Почему?
а) Na2CO3; б) CH3COONa; в) KCl; г) Na2S.
2. Составьте молекулярные и ионные уравнения гидролиза фосфата калия, хлорида железа (III), сульфита калия, сульфида натрия, хлорида алюминия и ацетата аммония.
3. Какая соль гидролизуется по аниону?
а) CuSO4; б) Na3PO4; в) ZnCl2; г) Fe(NO3)3.
4. Какая соль гидролизуется по катиону?
а) K2S; б) ZnSO4; в) Na2CO3; г) CaSO3.
5. Кислую реакцию среды имеет раствор:
а) Na2CO3; б) KNO3; в) FeCl3; г) K2SO3.
6. Щелочную реакцию среды имеет раствор:
а) AlCl3; б) Na2SO4; в) Na2S; г) Cr2(SO4)3.
7. В растворе какой соли лакмус окрашен в розовый цвет, а фенолфталеин -бесцветный ?
а) Na2SO3; б) K3PO4; в) LiNO3; г) FeCl3.
8. Гидролиз хлорида алюминия можно усилить при:
а) добавлении Н+- ионов;
б) добавлении ОН- - ионов;
в) охлаждении;
г) увеличении концентрации раствора.
9. Степень гидролиза фосфата калия уменьшается при:
а) разбавлении;
б) нагревании;
в) подкислении;
г) подщелачивании.
10.
Какая формула может быть применена для
вычисления константы гидролиза фосфата
натрия Na3PO4?![]()
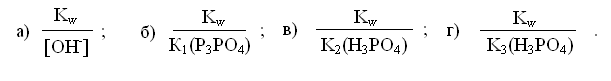
ЗАНЯТИЕ 9
Тема: РАСТВОРЫ И ИХ СВОЙСТВА. ХИМИЧЕСКИЕ РАВНОВЕСИЯ В РАСТВОРАХ ЭЛЕКТРОЛИТОВ
(продолжение)
План занятия и вопросы семинара
Насыщенный раствор. Гетерогенное равновесие между раствором и осадком труднорастворимого электролита.
Произведение растворимости и расчет растворимости веществ на его основе.
Обменные реакции в растворах электролитов. Определение направления протекания ионообменных реакций с участием труднорастворимых электролитов.
Лабораторная работа.
Контрольная работа по темам: «Гидролиз» и «Произведение растворимости».
Лабораторная работа
Опыт 1. Образование и растворение осадков.
Пр.1: 5к. р-ра BaCl2 + 2к. р-ра Na2CO3 = осадок.
Пр.2: 5к. р-ра BaCl2 + 2к. р-ра Na2SO4 = осадок.
В обе пробирки добавить HCl. Объяснить различное поведение осадков. Составить необходимое уравнение реакций.
Опыт 2. Последовательное осаждение труднорастворимых веществ. Предварительный опыт:
Пр.1: 2к. р-ра KCl + 2к. р-ра AgNO3 = осадок I.
Пр.2: 2к. р-ра K2CrO4 + 2к. р-ра AgNO3 = осадок II.
Написать уравнения реакций в молекулярной и ионной форме. Отметить цвета осадков AgCl и Ag2CrO4 , выписать из табл. величины ПР. Какая соль менее растворима? Какой осадок будет выпадать из раствора, содержащего одновременно ионы Cl- , CrO42- и Ag+ , в первую очередь? Убедиться в этом, проведя опыт:
Пр.3: 1к. р-ра KCl + 1к. р-ра K2CrO4 + 8-10к. воды, перемешать. Прибавлять по каплям р-р AgNO3, наблюдать последовательное образование осадков.
Вопросы для подготовки к занятию и самоконтроля
Выражение ПР для Ag2CrO4:
а) [Ag+] [CrO42-]; в) [Ag+] [CrO42-];
б) [Ag+] + [CrO42-]; г) [Ag+]2 [CrO42-].
2. Какая соль наименее растворима в воде?
а) AgCl (ПР = 1,8·10-10); в) CuS (ПР = 6,0·10-36);
б) Ag2CrO4 (ПР = 1,6·10-12); г) BaCO3 (ПР = 5,1·10-9).
3. Какая соль наиболее растворима в воде?
а) AgI (ПР = 1,5·10-16); в) HgS (ПР = 1,6·10-52);
б) CaCO3 (ПР = 5,0·10-9); г) BaSO4 (ПР = 1,1·10-10).
4. Рассчитайте значение ПР, если растворимость ZnS в воде при некоторой температуре составляет 4·10-3моль/л.
5. Концентрация Ca2+ в насыщенном растворе CaSO4 равна 1·10-4 моль/л. Вычислите ПР этой соли.
6. Произведение растворимости PbI2 равно 8,7·10-9. Найдите растворимость этой соли и концентрацию ионов Pb2+ и I-.
ЗАНЯТИЕ 10.
Тема: ОКИСЛИТЕЛЬНО-ВОССТАНОВИТЕЛЬНЫЕ РЕАКЦИИ
Вопросы семинара:
1. Понятие об окислительно-восстановительных реакциях. Степень окисления (СО). Высшая (максимальная), низшая (наименьшая), промежуточная степени окисления. Правила определения степени окисления атомов. Окислитель, восстановитель, процессы окисления, восстановления.
2. Окислительно-восстановительные свойства элементов и соединений в зависимости от положения в П.С.Э. Д.И. Менделеева.
3. Типы окислительно-восстановительных реакций (ОВР).
Межмолекулярное окисление – восстановление. Внутримолекулярное окисление-восстановление (конмутация). Диспропорционирование (дисмутация).
4. Уравнивание ОВР ионно-электронным методом (методом полуреакций).
5. Фактор эквивалентности окислителя и восстановителя, их определение.
6. Стандартное изменение энергии Гиббса ОВР и стандартные окислительно-восстановительные потенциалы полуреакций.
7. Определение возможности и направления протекания ОВР.
8. Константа равновесия и полнота протекания ОВР.
Вопросы для подготовки к занятию и самоконтроля.
1. Какие из указанных ниже реакций относятся к ОВР? При положительном ответе укажите окислитель и восстановитель, определите тип ОВР (межмолекулярные, внутримолекулярные, реакции диспропорционирования).
а) Zn + H2SO4 = ZnSO4 + H2;
б) Na2CO3 + SiO2 = Na2SiO3 + CO2;
в) K2Cr2O7 + 3 K2SO3 + 4 H2SO4 = Cr2(SO4)3 + 4 K2SO4 + 4 H2O;
г) 2 K2HPO4 = K4P2O7 + H2O;
д) NH4NO3 = N2O + 2 H2O;
е) 3 K2MnO4 + 2 H2O = 2 KMnO4 + MnO2 + 4 KOH.
2. Как изменяется степень окисления центрального атома в нижеприведенных переходах? На основании изменения степени окисления определите, какой процесс (окисление или восстановление) происходит при этом.
а) H2S → S; г) MnO4- → MnO42-; ж) I2O5 → H5IO6;
б) NH3 → NO; д) Cl- → ClO4-; з) As2O3 → AsO33-;
в) Fe2O3 → Fe; е) BiO3- → Bi3+; и) SO2 → SO32-.
3. Исходя из положения центрального атома нижеприведенных соединений в периодической системе, определите, какие вещества могут проявлять только окислительные свойства, только восстановительные свойства или окислительно-восстановительную двойственность.
а) KMnO4, H2S, KI;
б) NaNO2, PH3, PbO2;
в) Zn, H3AsO3, I2;
г) HNO3, H2O2, KBiO3;
д) SO42-, MnO2, K2Cr2O7.
5. Используя ионно-электронный метод, составьте уравнения полуреакций для данных превращений.
|
|
рН < 7 |
pH > 7 |
pH = 7 |
|
а) |
IO4- I2 |
MnO2 MnO42- |
H2S SO42- |
|
б) |
SO42- S |
NO2- NO3- |
MnO4- MnO2 |
|
в) |
ClO3- Cl2 |
[Cr(OH)6]3- CrO42- |
BrO3- Br- |
|
г) |
NO3- N2 |
Pb2+ PbO2 |
ClO4- Cl- |
|
д) |
FeO42- Fe3+ |
MnO2 MnO4- |
PbO2 Pb2+ |
6. Уравняйте ОВР ионно-электронным методом:
а) Sb2O3+KMnO4+HCl→MnCl2+KCl+H2O+Sb2O5;
б) Cl2 + I2 + H2O → HCl + HIO3;
в) Cr2O3 + KNO3 + KOH → KNO2 + K2CrO4 + H2O;
г) K2MnO4 + H2O → KMnO4 + MnO2 + KOH;
д) MnSO4 + NaBiO3 + HNO3 → HMnO4 + Bi(NO3)3 + NaNO3 + Na2SO4 + H2O;
е) BiCl3 + SnCl2 + NaOH → Bi + Na2[Sn(OH)6] + NaCl;
ж) AsH3 + AgNO3 + H2O → Ag + H3AsO4 + HNO3;
з) KMnO4 + H2S + H2SO4 → MnSO4 + S + K2SO4 + H2O
и) SO2 + KMnO4 + KOH → K2SO4 + MnO2 + H2O
к) Cr(OH)3 + H2O2 + NaOH Na2CrO4 + H2O;
л) K2Cr2O7 + H2O2 + H2SO4 Cr2(SO4)3 + O2 + K2SO4 + H2O;
7. Пользуясь таблицей значений стандартных восстановительных потенциалов, ответьте на следующие вопросы:
а) какой из металлов является самым сильным восстановителем?
Li;Ca;K;Pb;Mg.
б) какой из ионов металлов является самым сильным окислителем?
Cu2+; Ni2+; Ag+; Co2+; Zn2+.
8. Определите, в каком направлении будет протекать приведенная ниже реакция при стандартных условиях:
PbO2+Br2+ 4H2O↔ 2BrO3-+ 8H++Pb2+рН < 7.
9. В реакционных смесях присутствуют следующие частицы:
а) BrO3-, Br-, H3AsO4, HAsO2, H+, H2O;
б) AsO43-, AsO2-, ClO-, Cl-, OH-, H2O;
в) HClO, Cl2, NO3-, NO2-, H+, H2O.
Составьте для сопряженных пар уравнения полуреакций, сравните их восстановительные потенциалы и предложите суммарное ионное уравнение протекающей реакции. Какая частица является окислителем?
10. В задании 5, для реакций б, г, д рассчитайте при стандартных условиях константы равновесий химических реакций. Сделайте вывод о полноте протекания реакций.
ЗАНЯТИЕ № 11.
Тема: КОМПЛЕКСНЫЕ СОЕДИНЕНИЯ
Вопросы семинара:
1. Понятие и структура комплексных соединений: центральный атом (комплексообразователь), лиганды, дентатность (координационная емкость), координационное число центрального атома, комплексный ион, внутренняя и внешняя сфера.
2. Номенклатура комплексных соединений.
3. Химическая связь в комплексных соединениях. Типы гибридизации комплексообразователя (sp, sp3, dsp2, d2sp3, sp3d2).
Влияние лигандов на спаривание электронов в орбиталях (ячейках). Пространственное строение комплексных ионов
4. Классификации комплексных соединений.
В зависимости от природы лиганда (аквакомплексы, аминокомплексы, гидроксокомплексы, ацидокомплексы, соединения смешанного типа, хелаты).
В зависимости от иона во внешней сфере (кислоты, основания, соли, неэлектролиты)
В зависимости от заряда комплексного иона (катионного типа, анионного типа, электронейтральные комплексы).
5. Изомерия комплексных соединений.
Ионизационная изомерия, координационная изомерия, гидратная изомерия, геометрическая изомерия или цис-транс изомерия, или пространственная изомерия.
6. Поведение комплексных соединений в растворах.
Первичная диссоциация (первый тип). Вторичная диссоциация (второй тип).
Константа нестойкости комплексных соединений (Кн).
7. Основные реакции образования комплексных соединений.
Растворение соли в избытке аммиака. Растворение амфотерных гидроксидов в избытке щелочи. Растворение трудно растворимых соединений в избытке хорошо растворимой соли. Обмен ионами с комплексным соединением.
8. Условия образования и разрушения комплексных соединений.
9. Лабораторная работа № 6
Вопросы для подготовки к занятию и самоконтроля
1. Для нижеприведенных комплексных соединений определить заряд комплексного иона, степень окисления комплексообразователя и его координационное число, дентатность лигандов. Назвать соединение.
а) K2[PtCl4]; д) [Cr(H2O)6]Cl3; и) [Cr(H2NCH2CH2NH2)3]Cl3;
б) Na3[Fe(C2O4)3]; е) [Cu(NH3)4]SO4; к) [Co(H2O)4Cl2];
в) K3[Fe(CN)6; ж) [Cr(H2O)4Cl2]Cl; л) [Pt(NH3)2Cl2].
г) Na3[Co(NO2)6]; з) [Co(H2O)(NH3)4(CN)]Br2;
2. Составить формулы комплексных соединений по их названиям:
а) нитрат тетраамминмеди (II);
б) бромид акватетраамминцианокобальта (III);
в) диамминтетрароданохромат (III) бария;
г) гексацианоферрат (II) железа (III);
д) триамминтринитритокобальт;
е) гексахлороплатинат (IV) калия;
ж) хлорид диакватетраамминплатины (IV);
3. Из раствора комплексной соли CoCl3·5NH3нитрат серебра осаждает только 2/3 содержащегося в ней хлора. В растворе соли не обнаружено ионов кобальта и свободного аммиака. Каково координационное строение этого соединения?
4. Какие из нижеприведенных молекул или ионов не могут выступать в качестве лигандов и по какой причине?
а) NH3; б) NH4+; в) K+; г) CH4.
5. Комплексные соединения часто образуются по схеме, представляющей две последовательно протекающие реакции:
1) Обменная реакция между двумя солями с образованием труднорастворимой соли.
2) Реакция комплексообразования между осадком и избытком осадителя. Составьте в соответствии с этой схемой следующие уравнения реакций:
а) AgNO3 + KI (изб) → б) SnCl2 + NaOH (изб) →
в) Hg(NO3)2 + KI (изб) → г) AgNO3 + Na2S2O3 (изб) →
6. Составьте выражения для констант нестойкости различных комплексов серебра: аммиачного, цианидного, хлоридного, бромидного и тиосульфатного. На основании величин Кн расположите их в ряд по возрастанию прочности. Ответьте на следующие вопросы:
а) В растворе какого комплекса серебра концентрация свободных Ag+- ионов наименьшая? наибольшая?
б) Какой из комплексов труднее всего разрушить? Легче всего?
7. Приведите уравнения реакций разрушения соединения [Cu(NH3)4]Cl2двумя способами:
а) Осаждением иона-комплексообразователя.
б) Переводом в новый комплекс. Чем должен определяться выбор осадителя?
8. Выразите в виде уравнений реакций нижеприведенные схемы переходов. В каждом случае объяснить возможность (или невозможность) их осуществления:
а) Ag +→ [Ag(NH3)2]+→ [Ag(CN)2]-→Ag2S
б) AgCl → [Ag(S2O3)2]3- → Ag2S → [Ag(CN)2]-
9. Из нижеприведенных молекул и ионов Zn2+, K+, Cl-, NH3 составить координационные формулы комплексных соединений катионного, анионного и электронейтрального типа (5 соединений). Назвать эти соединения.
10. Составить уравнения реакций растворения Fe(OH)3 в фосфорной, щавелевой и фтороводородной кислотах с образованием соответствующих комплексов. При написании формул комплексных соединений учесть дентатность лигандов. Назвать полученные соединения. К какому типу комплексных соединений они относятся?
Лабораторная работа
Опыт 1. Получение и разрушение гидрокомплексов Al (III) и Zn(II).
Пр.1: 3-4к. р-ра AlCl3+ п/к 2н. р-ра NaOH = осадок + изб. р-ра NaOH = раствор.
Пр.2: 3-4к. р-ра ZnSO4+ п/к 2н. р-ра NaOH = осадок + изб. р-ра NaOH = раствор. К содержимому пр.1,2 прибавить п/к HCl до образования осадков.
Составить уравнение реакций получения гидроксидов алюминия и цинка и их растворения в избытке щелочи с образованием гидрокомплексов. Составить уравнения реакций разрушения КС. Объяснить причину разрушения.
Опыт 2. Получение и разрушение аминокомплекса серебра.
Пр.1,2: по 3-4к. р-ра AgNO3 + 1-2к. р-ра NaCl = осадок + п/к р-р NH3 = раствор. Пр.1: + 1-2к. р-ра KI = осадок. Пр.2: + 2-3к. р-ра HNO3 = осадок.
Составить уравнения реакций получения аминокомплекса серебра и его разрушения. Объяснить причину разрушения.
Опыт 3. Получение и разрушение ацидокомплексов железа(III).
Пр.1,2: по 3-4к. р-ра FeCl3 + по 3-4к. р-ра KCNS = р-р кроваво-красного цвета. Пр.1 + п/к р-р NH4F, пр.2 + п/к р-р H2C2O4 до обесцвечивания.
Составить уравнения реакций образования и разрушения роданидного комплекса железа, учтя, что к.ч. Fe3+=6, а дентатность лигандов CNS- и F- равна 1, C2O42- равна 2. Объяснить разрушение окрашенного роданидного комплекса и образование бесцветных фторидного и оксалатного комплексов.
ЗАНЯТИЕ 12
Тема: ХИМИЯ НЕМЕТАЛЛОВ. Р-ЭЛЕМЕНТЫ VII ГРУППЫ.
Вопросы семинара:
1. Положение галогенов в периодической системе. Строение электронных оболочек атомов. Электронно-графические формулы атомов элементов, проявляемые степени окисления. Характер изменения в группе основных атомных констант (радиус атома, энергия сродства к электрону, энергия ионизации, относительная электроотрицательность).
2. Простые вещества. Лабораторные способы получения галогенов. Сравнительная окислительная активность галогенов.
3. Водородные соединения галогенов. Протолитические свойства. Участие в ОВР. Сравнительная характеристика восстановительных свойств галогенид-ионов. Качественные реакции на галогенид-ионы.
4. Соединения галогенов в положительных степенях окисления. Кислородсодержащие кислоты галогенов и их соли, на примере хлора. (хлорноватистая, хлористая, хлорноватая, хлорная кислоты). Их сила и окислительная способность.
5. Лабораторная работа
Вопросы для подготовки к занятию и самоконтроля
1. Установите соответствие электронной формулы и степени окисления
р-элементов VII группы:
1) Br-1; 3) Br+3; а) 4s24p2; в) 4s24p6;
2) Cl+7; 4) Cl+1; б) 2s22p6; г) 3s23p4.
2. В каком ряду элементов происходит возрастание радиуса атомов:
а) I Br Cl F; б) F Cl Br I;
в) C N O F; г) Ge As Se Br.
3. В результате какой реакции выделяется кислород?
а) F2 + H2O →;
б) Сl2+H2O→;
в) Br2+H2O→;
г) I2+H2O→.
4. Какой из галогенид-ионов обладает наименьшей восстановительной активностью:
а) хлорид-ион;
б) фторид-ион;
в) иодид-ион;
г) бромид-ион.
5. В результате какой реакции можно получить хлорную кислоту?
а) Cl2O+H2O→; б) СlO2+H2O→;
в) Сl2O7+H2O→; г) Сl2+H2O→.
6. Установить соответствие между названием кислоты и формулой ее соли:
1. Хлороводородная а) KClO3;
2. Хлорноватистая б) KClO4;
3. Хлорная в) KClO2;
4. Хлористая г) KClO;
5. Хлорноватая д) KCl.
7. В каком случае идет процесс окисления:
а) Cl2 → HClO; б) ClO4- → Cl-;
в) ClO3- → Cl2; г) HClO → Cl-.
8. Уравняйте реакции ионно-электронным методом (метод полуреакций).
а) As + NaClO + NaOH→ Na3AsO4 + NaCl + H2O;
б) Cl2 + I2 + H2O → HCl + HIO3;
в) NaFeO2 + Cl2 + NaOH → Na2FeO4 + NaCl + H2O.
9. Какая соль при добавлении раствора нитрата серебра образует желтый осадок?
а) KF;
б) KCl;
в) KBr;
г) KI.
10. Вычислите молярную концентрацию растворов HCl и HF кислот, рН которых равна 3.
11. При смешивании растворов MgSO4 и KF оказалось, что в полученном растворе концентрации ионов равны: [Mg2+]= 2,1·10-3 моль/л, [F-] = 3·10-7 моль/л. ПР (MgF2) = 7,1·10-8 моль/л. Выпадет ли осадок фторида магния?
12. Рассчитать константу гидролиза по I ступени и определить рН в растворе соли указанной концентрации
FeCl3 (0,001 моль/л).
Лабораторная работа
Опыт 1. Получение хлора и хлорной воды (демонстрационный опыт).
В колбу Вюрца вносят 3-4 г перманганата калия и приливают по каплям концентрированную соляную кислоту. Наблюдать выделение газообразного хлора, отметить окраску. Опустить газоотводную трубку в сосуд с водой, наблюдать растворение хлора в воде. Составить уравнение реакций получения хлора и его растворения в воде.
Опыт 2. Растворимость брома и йода в органических растворителях.
Пр.1: 2-3 к. бромной воды разбавить водой до бледно-желтой окраски, прибавить 5-6 к. органического растворителя (бензол, хлороформ), интенсивно встряхнуть, дать отстояться. Наблюдать окраску слоя органического растворителя.
Пр. 2. Повторить опыт, заменив бромную воду йодной водой. Объяснить, почему бром и йод переходят из водного раствора в органический.
Опыт 3. Сравнение окислительной активности галогенов в реакциях их взаимного вытеснения.
Пр.1: 1-2 к. р-ра KBr + 5-6 к. H2О + 2-3 к. хлорной воды (получение в оп. 1) + 5-6 к. органического растворителя. Интенсивно встряхнуть и дать отстояться. Наблюдать окраску слоя органического растворителя.
Пр.2. Повторить опыт (Пр.1), заменив р-р KBr на KI.
Пр.3. Повторить опыт (Пр.2), заменив хлорную воду на бромную.
На основании окраски слоя органического растворителя укажите, какой продукт реакции переходит в органическую фазу. Составьте уравнения протекающих реакций. Расположите галогены в ряд по их убывающей окислительной активности.
Опыт 4. Качественные реакции на галогенид-ионы.
Пр.1: 2-3 к. р-ра KCI + 1к. р-ра AgNO3 = осадок.
Пр.2: 2-3 к. р-ра KBr + 1к. р-ра AgNO3 = осадок.
Пр.3: 2-3 к. р-ра KI + 1к. р-ра AgNO3 = осадок.
Указать цвет осадков и составить уравнения (молекулярная и ионная форма) реакций.
Опыт 5. Сравнение восстановительных свойств галогенид-ионов.
Пр.1: 1-2 к. р-ра + 5-6 к. H2O + 2-3 к. р-ра FeCl3 + 2-3 к. органического растворителя. Интенсивно встряхнуть, дать отстояться и наблюдать окраску слоя органического растворителя.
Пр. 2. Повторить опыт, заменив р-р KI на KBr. В какой пробирке органический растворитель окрасится? Составить уравнение реакции. На основании значений стандартных восстановительных потенциалов сделать хаключение6, какой из галогенид-ионов может, а какие не могут восстанавливать FeCl3 до FeCl2.
Опыт 6. Контрольное задание: определить в предложенном образце присутствие одного из ионов: Cl-, Br-, I-. Тестирование проводите в соответствии со схемой:
окраска слоя предпол.налич.
органич. р-ля иона в образце
рвствор + хлорная + органич. бесцветная хлорид
образца вода р-ль желтая бромид
розовая иодид
Дополнительные (подтверждающие) реакции:
а) с AgNO3 (cм. оп.4);
б) с FeCl3 (см.оп.5).
ЗАНЯТИЕ 13
Тема: ХИМИЯ НЕМЕТАЛЛОВ. Р-ЭЛЕМЕНТЫ VI ГРУППЫ.
Вопросы семинара:
1. Положение халькогенов в периодической системе. Строение электронных оболочек атомов. Электронно-графические формулы атомов элементов, проявляемые степени окисления. Характер изменения в группе основных атомных констант (радиус атома, энергия сродства к электрону, энергия ионизации, относительная электроотрицательность).
2. Простые вещества. Лабораторные способы получения кислорода.
3. Водородные соединения халькогенов. Лабораторные способы получения сероводорода. Протолитические свойства. Участие в ОВР.
4. Пероксид водорода и его участие в ОВР. Уравнивание ОВР методом полуреакций (электронно-ионным методом).
5. Соединения серы в положительных степенях окисления. Оксид серы (IV), сернистая кислота и ее соли (сульфиты). Получение, химические свойства.
Оксид серы (VI). Получение, химические свойства.
6. Концентрированная и разбавленная серная кислота и ее соли (сульфаты).
Протолитические свойства, участие в ОВР.
7. Тиосульфат натрия. Строение, получение и химические реакции со свободными галогенами.
8. Лабораторная работа
Вопросы для подготовки к занятию и самоконтроля
1. Установите соответствие электронной формулы и степени окисления
р-элементов VI группы:
1) S2-; 3) Te0; 5) Se2-; а) 3s23p0; в) 3s23p6; д) 5s25p4;
2) Se+4; 4) S+6; 6) S+4; б) 4s24p6; г) 4s24p0; е) 3s03p0.
2. В каком ряду элементов происходит уменьшение относительной электроотрицательности атомов:
а) Te Se S O; б) O S Se Te;
в) C N O F; г) Ge As Se Br.
3. Стандартные теплоты образования (∆Нfo, кДж/моль) водородных соединений р-элементов VI группы имеют ниже приведенные значения. Какое из этих соединений самое термически неустойчивое?
а) H2O б) H2S в) H2Se г) H2Te
-242 -21 +30 +99
4. Составьте уравнения химических реакций, в которых сероводород поглощается:
а) раствором щелочи; б) раствором иода в) подкисленным раствором дихромата калия.
Проведите классификацию указанных реакций.
5. В каком случае идет процесс восстановления:
а) S → SO42-; б) SO42- → SO2;
в) H2S → S; г) S2O32- → S4O62-.
6. Допишите продукты и уравняйте ОВР методом полуреакций:
а) KMnO4 + H2O2 + H2SO4 MnSO4 + O2 + K2SO4 + H2O;
б) HNO3 + H2O2 NO2 + H2O + O2.
в) H2O2 + Ag2O Ag + H2O + O2;
г) KNO2 + H2O2 KNO3 + H2O;
д) FeSO4 + H2O2 + H2SO4 Fe2(SO4)3 + H2O;
е) KI + H2O2 + H2SO4 I2 + K2SO4 + H2O;
7. В каком случае реакция невозможна?
а) H2SO4 (конц.) + Hg; б) H2SO4 (разб..) + Cr;
в) H2SO4 (конц.) + Au; г) H2SO4 (разб..) + Fe.
8. Какое азотсодержащее соединение образуется в результате реакции:
KI + H2SO4 (конц) = K2SO4 + … + I2 + H2O
а) H2SO3; б) S; в) SO2; г) H2S.
9. Какое азотсодержащее соединение образуется в результате реакции:
KBr + H2SO4 (конц) = K2SO4 + … + Br2 + H2O;
а) H2S; б) H2SO3; в) S; г) SO2; .
10. В реакции H2SO4 (конц) + Al = Al2(SO4)3 + H2S↑ + H2O коэффициент при кислоте:
а) 30; б) 5; в) 3; г) 15.
11. Какая из солей не гидролизуется?
а) K2SO4; б) (NH4)2SO4; в) FeSO4; г) Cr2(SO4)3.
12. Какая из солей при гидролизе будет иметь самую маленькую величину рН?
а) Na2SO3; б) CaSO3; в) FeSO3; г) BaSO3.
13. Для предложенных солей рассчитать константу гидролиза по Iступени и
определить рН в растворе солей указанной концентрации.
MgSO4 (1 моль/л);
Na2S (0,03 моль/л).
14. В результате гидролиза сульфита калия образуется:
а) сернистая кислота и вода; б) гидросульфит калия и щелочь;
в) оксид серы (IV), вода и щелочь; г) оксид серы (IV) и вода.
Лабораторная работа
Опыт 1. Качественная реакция на сульфид-ион.
Пр.1: 2-3 к. р-ра Na2S + 1к. р-ра AgNO3 = осадок.
Указать цвет осадков и составить уравнения (молекулярная и ионная форма) реакций.
Опыт 2. Восстановительные свойства сероводородной кислоты.
1-2 к. р-ра K2Cr2O7 + 3-4 к. H2SO4 + п\к р-р H2S (оп. 1 а) до изменения окраски раствора и его помутнения. Составить уравнение окисления Na2S до серы, приняв во внимание, что дихромат калия восстанавливается до сульфата хрома (III).
Опыт 3. Окислительно-восстановительные свойства пероксида водорода.
Пр. 1: 3-4 к. р-ра KMnO4 + 3-4 к. H2SO4 + п/к Н2О2 до обесцвечивания.
Пр. 2: 1-2 к. р-ра Kl + 3-4 к. H2SO4 + 1-2 к. Н2О2 = окраска.
Составить уравнения реакций, установить функцию Н2О2 в обоих случаях.
Опыт 4. Получение SO2, H2SO3 и изучение их свойств (демонстрация).
В колбу Вюрца внести 3-4 гр. Сульфита натрия и приливать по каплям H2SO4, наблюдать выделение сернистого газа. Исследовать свойства SO2:
а) опустить газоотводную трубку в колбу с водой, пропускать газ 1-2 мин., проверить реакцию среды с помощью индикатора;
б) Пр.1: 5-6 к. бромной воды + SO2(газ). Наблюдать изменение окраски.
В) Пр.»: 5-6 к. сероводородной воды + SO2(газ). Наблюдать помутнение раствора.
Составить уравнения реакций: получения SO2; взаимодействия SO2 с водой и ступенчатой диссоциации сернистой кислоты (выписать значения (Кд); взаимодействия с Br2; взаимодействия с H2S. Сравнить протолитические свойства H2SO3 и H2S. В чем отличие участия в ОВР SO2 и H2S?
Опыт5. Взаимодействие концентрированной и разбавленной H2SO4 с металлами.
Пр.1: 2-3 мкршп. Al + 5-6 к. H2SO4 (разб.), нагреть. Наблюдать выделение газа.
Пр.2: 2-3 мкршп Al + 5-6 к. H2SO4 (конц..), нагреть. К отверстию поднести фильтр, смоченный р-ром соли Pb(NO3)2. Наблюдать образование темного пятна. Написать уравнения всех протекающих реакций. Оценить окислительные свойства H2SO4 концентрированной и разбавленной. Что будет, если вместо алюминия взять медь?
Опыт 6. Свойства тиосульфата натрия.
Пр.1: 5-6 к. р-ра Na2S2O3 + 2-3 к. р-ра НСl. Наблюдать помутнение и постепенное образование осадка.
Пр. 2: 5-6 к. I2 + п/к р-р Na2S2O3 до обесцвечивания раствора. Написать уравнения протекающих реакций. Объяснить неустойчивость тиосерной кислоты с точки зрения строения тиосульфат-иона (пр. 1). Одинаковы ли будут продукты реакции (пр.2), если заменить I2 на Cl2 или Br2?
Опыт 7. Контрольное задание: определить в предложенном образце присутствие одного из ионов: S2-, SO32-, S2O32-, SO42-. Тестирование проводите в соответствии со схемой:
да нет SO42-
Раствор осадок S2O32-
образца + 5-6 к. HCl нет р-р обес-
есть + 2-3 к. I2 да + 1 к. р-ра Pb(NO3)2
цвечив.? да
S2- осадок
нет черный
SO32-
Примечание: 1) каждый следующий шаг схемы проводить с новой порцией
контрольного раствора;
2) на обнаруженные ионы провести дополнительные (подтверждающие) реакцию.
ЗАНЯТИЕ 14
Тема: ХИМИЯ НЕМЕТАЛЛОВ. Р-ЭЛЕМЕНТЫ V ГРУППЫ.
Вопросы семинара и план занятия:
Общая характеристика р-элементов V группы. Электронные и электронно-графические формулы, возможные степени окисления. Изменение основных атомных констант, физических и химических свойств в ряду азот – фосфор – мышьяк – сурьма - висмут.
Водородные соединения. Стандартные энтальпии их образования. Характер изменения прочности и восстановительных свойств в ряду NH3 - PH3 - AsH3 - SbH3 - PbH3. Аммиак как донор электронной пары.
Азот. Оксиды. Классификация. Реакции с водой и со щелочами.
Азотная и азотистая кислоты и их соли. Участие в ОВР; окислительно-восстановительная двойственность соединений в с.о.+3. Реакции термического разложения нитратов.
Фосфор. Оксиды. Кислоты. Основность кислот. Структурные формулы. Названия кислот и солей.
Мышьяк, сурьма, висмут. Оксиды в с.о.+3 и +5; их гидратные формы. Кислотно-основной характер оксидов и гидратных форм. Окислительно-восстановительные свойства соединений мышьяка, сурьмы, висмута.
Лабораторная работа.
Лабораторная работа
Опыт 1. Получение аммиака и изучение его свойства (демонстрация).
Равные объемы порошкообразных (NH4)2SO4 и Ca(OH)2 растереть в ступке, внести в пробирку с газоотводной трубкой, нагреть. Доказать наличие аммиака в выделяющемся газе:
с влажной лакмусовой бумажкой;
б) поднести стеклянную палочку, смоченную конц. cоляной кислотой, наблюдать выделение белого «дыма».
Собрать газообразный аммиак в пробирку и доказать его хорошую растворимость в воде. Составить уравнение реакций получения аммиака; его взаимодействие с HCl; равновесие диссоциации в водном растворе.
Опыт 2. Получение NO и изучение его свойств.
В колбу Вюрца внести медную стружку и р-р HNO3 (1:1), нагреть. Через газоотводную трубку собрать газ в цилиндр, наполненный водой и помещенный вверх дном в чашку с водой. Отметить цвет NO. Снять стеклянную пластинку, закрывающую отверстие цилиндра, и наблюдать за изменением окраски газа. Вновь накрыть цилиндр стеклянной пластинкой, энергично встряхнуть. Вследствие растворения NO2 в воде, в цилиндре образуется вакуум, и пластинка плотно прижимается к отверстию. Изучить свойства образовавшегося раствора:
Пр.1: 5-6к. р-ра из цилиндра + 1-2к. лакмуса.
Пр.2: 3-4к. р-ра KMnO4 + п/к р-р из цилиндра до обесцвечивания.
Составить уравнения следующих реакций: а) взаимодействия HNO3 с медью; б) окисления NO на воздухе; в) растворения NO2 в воде; г) взаимодействия KMnO4 со смесью двух кислот: HNO2 и HNO3.
Опыт 3. Окислительно-восстановительная двойственность солей азотистой кислоты.
Пр.1: 3-4к. р-ра KMnO4 + 2-3к. H2SO4 + п/к р-ра KNO2 до обесцвечивания.
Пр.2: 1-2к. р-ра KI + 2-3к. H2SO4 + 3-4к. р-ра KNO2. Докажите образование свободного йода: а) реакция с крахмалом, б) экстракцией органическим растворителем.
Составьте уравнения протекающих реакций и установите функцию нитрит-иона в обоих случаях.
Опыт 4. Поведение солей фосфорной кислоты в водных растворах. Установить реакцию среды и величину рН в растворах Na3PO4, Na2HPO4, NaH2PO4 с помощью индикаторов лакмуса, фенолфталеина и универсальной индикаторной бумаги. Составить необходимые уравнения химических равновесий.
Опыт 5. Восстановительные свойства соединений Sb(III).
Пр.: 2-3к. р-ра KMnO4 + 2-3к. р-ра HCl+ 3-5к. р-ра SbCl3 до обесцвечивания раствора. Составить уравнение реакции окисления SbCl3 до SbCl5 (точнее до H[SbCl6]). При этом KMnO4 восстанавливается до MnCl2..
Опыт 6. Окислительные свойства соединений висмута (V).
Пр.1: 1к. (не больше!) р-ра MnSO4 + 5-6к. HNO3 + 1мкш. NaBiO3. Наблюдать возникновение розовой или фиолетовой окраски. Данная реакция используется как качественная на соли Mn(II). Составить уравнение реакции.)
Вопросы для подготовки к занятию и самоконтроля
Составьте электронные формулы атомов азота, фосфора и мышьяка в основном и возбужденном состояниях. Объясните, почему фосфор и мышьяк с хлором образуют хлориды ЭCl3 и ЭCl5, а азот – только NCl3?
Соединение в котором степень окисления азота иная, чем в других соединениях, - это
а) NH3 б) Cl3N в) NF3 г) NH4Cl
Соединение в котором степень окисления азота иная, чем в других соединениях, - это
а) CsNO3 б) N2O5 в) N(O)F3 г) (NH4)2SO4
Соединение в котором степень окисления азота иная, чем в других соединениях, - это
а) NaNO2 б) NaNH2 в) N2O3 г) NF3
5. Нарастание металлических свойств в группе подтверждается:
1) Взаимодействием фосфора, мышьяка, сурьмы и висмута с HNO3 (конц..).
2) Изменением устойчивости водородных соединений.
3) Изменением кислотно-основных соединений в с.о.+3.
Приведите необходимые объяснения и уравнения реакций.
Что делает молекулу аммиака способной к образованию аммонийных солей и комплексов с ионами металлов? составьте уравнения взаимодействия аммиака с а) водой; б) соляной кислотой; в) сульфатом меди (II). Одинакова ли функция аммиака в этих реакциях?
Укажите схему реакции, в которой аммиак – восстановитель:
а) K + NH3 → KNH2 + H2 в) NH3 + CuO → Cu + N2 +H2O
б) NH3 + H3PO4 → г) NH3 + H2O →
Восстановительные свойства аммиака не проявляются в реакции:
а)
2NH3
+ 3CuO
![]() 3Cu + N2
+ 3H2O
3Cu + N2
+ 3H2O
б) 3NH3 + 3H2O + AlCl3 = Al(OH)3↓ + 3NH4Cl
в)
4NH3
+ 5O2
![]() 4NO + 6H2O
4NO + 6H2O
г) 2NH3 + NaOCl = N2H4 + NaCl + H2O
К смеси газов N2O + NO + NO2 добавили избыток кислорода, пропустили через раствор щелочи и на выходе обнаружили:
а) N2O, NO б) N2O, O2 в) NO, NO2 г) N2O, NO2
При взаимодействии P4O6 c водой образуется…
[1] ортофосфорная кислота
[2] пирофосфорная кислота
[3] фосфорноватистая кислота
[4] фосфористая кислота
11. Раствор, содержащий смесь солей Sb(NO3)3 и Bi(NO3)3 обработали избытком раствора NaOH. Напишите уравнения протекающих при этом реакций.
12. Особенности азотной кислоты, как окислителя в зависимости от её концентрации и природы восстановителя. Закончите уравнения следующих реакций:
а) HNO3(к) + Cu → д) HNO3(к) + KI →
б) HNO3(р) + Cu → е) HNO3(к) + H2S →
в) HNO3(к) + S → ж) HNO3(к) + P →
г) HNO3(р) + Al → з) HNO3() + I2 →
13. Кислотный и основной оксиды одновременной образуются при термическом разложении:
а) натриевой селитры в) нитрата меди(II)
б) бертолетовой соли г) нитрата серебра(I)
14. В каком ряду перечисленные ниже нитраты разлагаются при нагревании с образованием продуктов: MeO + NO2 + O2?
а) Ca(NO3)2, Pb(NO3)2, Fe(NO3)2;
б) NaNO2, KNO3, ZnNO3;
в) Al(NO3)3, Zn(NO3)2, Ni(NO3)2,;
г) Hg(NO3)2, AgNO3, Mn(NO3)2.
15. В каком ряду перечисленные ниже нитраты разлагаются на нитрит металла и кислород?
а) ZnNO3, Hg(NO3)2, Cu(NO3)2;
б) Mg(NO3)2, Zn(NO3)2, Fe(NO3)2;
в) Ca(NO3)2, NaNO3, Mg(NO3)2;
г) NaNO3, Ca(NO3)2, KNO3.
16. Гидроортофосфат натрия при нагревании переходит в фосфат, а дигидроортофосфат натрия в метафосфат. Составьте уравнение реакции.
17. Укажите формулу вещества, с которым реагирует дигидрофосфат калия, но не реагирует ортофосфат калия:
а) Ca(OH)2 в) H2SO4(конц.)
б) KOH г) H3PO4
18. На основании значений стандартных восстановительных потенциалов определите, как изменяются окислительные свойства в ряду соединений As+5 → Sb+5 → Bi+5 и восстановительные свойства в ряду As+3 → Sb+3 → Bi+3.
Е°H3AsO4/HAsO2 = 0.56B; E°[-SbCl6]-/Sb3+ = 0.75B;
E°BiO3-/Bi3+
= 1.8B.![]()
19.
Конечным веществом в цепочке превращений
на основе азота HNO3(разб.)
![]() X1
X1
![]() Х2
Х2
![]() Х3
Х3
![]() Х4
является:
Х4
является:
1) нитрат аммония; 3) оксид азота(IV);
2) оксид азота(I); 4) азотная кислота.
20. Укажите вещества, обозначенные в цепочке превращений
цифрами 1-4:
…1
![]() NH3
NH3
![]()
![]() …2
…2![]() …1
…1![]() …3
…3![]() 4
4
а) NO2 б) N2 в) NO г) NH4NO2.
21.
Напишите уравнения реакций, соответствующие
следующей схеме: (NH4)2Cr2O7
![]() A
A
![]() Б
Б![]() В
В![]() Г
Г![]() Д
Д![]() Е(тв.
в-во)
Е(тв.
в-во)
ЗАНЯТИЕ 15
Тема: ХИМИЯ НЕМЕТАЛЛОВ. Р-ЭЛЕМЕНТЫ IV И III ГРУППЫ.
Вопросы семинара:
Общая характеристика р-элементов IV группы. Электронные и электронно-графические формулы, степени окисления. Изменение основных атомных констант, физических и химических свойств в ряду углерод – кремний – германий – олово – свинец.
Углерод. Оксиды. Угольная кислота. Соли.
Кремний. Оксид. Кислота. Соли.
Олово и свинец, как металлические представители IV оксиды и гидроксиды, их кислотно-основной характер. Окислительно-восстановительные свойства соединений олова и свинца.
Бор – неметаллический представитель р-эементов III группы. Оксид бора. Кислоты и их соли; устойчивость и сила кислот. Термическое разложение ортоборной кислоты (ступенчато).
Алюминий, химические свойства. Оксид и гидроксид алюминия. Соли.
Лабораторная работа
Опыт 1. Получение углекислого газа и изучение его свойств (демонстрационный опыт).
Получить CO2 в аппарате Киппа по реакции: CaCO2 + HCl.
Пр.1: насытить углекислым газом воду, проверить реакцию среды (лакмус);
Пр.2: насыщ. р-ра Ca(OH)2 (известковая вода) + CO2 из аппарата Киппа. Наблюдать образование осадка; при длительном пропускании CO2 осадок растворится. Отлить половину раствора в пр.3.
Пр.2: 10к. к содержимому пробирки прилить 3-4к. р-ра NaOH, наблюдать образование осадка.
Пр.3: нагреть, наблюдать образование осадка.
Составить уравнения: 1) образование CO2, равновесия, устанавливающегося при растворении CO2 в воде; в каком направлении смещается это равновесие при подкислении или подщелачивании этого раствора; 3) реакций, протекающих в пробирках 2 и 3.
Опыт 2. Получение геля кремневой кислоты.
Пр.: 5-6к. насыщенного раствора Na2SiO3 + CO2 из аппарата Киппа. Наблюдать образование геля (студневидного осадка) кремневой кислоты. Составить молекулярное и ионное уравнения протекающих реакций, сопоставить силу угольной и кремневой кислот.
Опыт 3. Получение гидроксидов олова и свинца и доказательство их амфотерности.
Получите в отдельных пробирках Sn(OH)2 и Pb(OH)2. Проделайте реакции, доказывающие амфотерный характер этих гидроксидов.
Опыт 4. Окислительно-восстановительные свойства соединений олова и свинца.
Пр. 1: 2-3к. р-ра SnCl2 + п/к р-р NaOH до растворения выпавшего в начале осадка Sn(OH)2 + 1-2к. р-ра Bi(NO3)3 . наблюдать образование черного осадка висмута. Составить уравнения трех последовательно протекающих реакций: а) образование Sn(OH)2; б) растворения Sn(OH)2 в избытке щелочи с образованием тетрагидроксостанната (II) натрия; в) взаимодействие последнего с Bi(NO3)3 в щелочной (NaOH) среде.
Пр.2: 1 мкш. PbO2 + 5-6к. H2SO4 + 1-2к. р-ра MnSO4, нагреть. Наблюдать образование розовой окраски (ион MnO4-). Составить уравнение реакции.
Опыт 5. Гидролиз тетрабората натрия (буры).
Определить реакцию среды раствора Na2B4O7 по фенолфталеину и величину рН по универсальной индикаторной бумаге. Составить уравнения гидролиза буры по I и II ступеням в молекулярном и ионном виде.
Опыт 6. Качественная реакция на борную кислоту и её соли (демонстрация).
В фарфоровую чашку поместить 2-3 мкш. буры или борной кислоты, 3-4к. конц. серной кислоты, 2-3 мл этилового спирта, размешать стеклянной палочкой и поджечь. Наблюдать пламя с зелёной каймой. Написать уравнения реакций образования и горения борноэтилового эфира.
Опыт 7. Взаимодействие алюминия с кислотами и щёлочью.
Проделать реакции алюминия с кислотами: серной конц. и разб., азотной разб., щелочью. Если реакции протекают медленно, пробирки нагреть на пламени спиртовки. Составить уравнения протекающих реакций.
Опыт 8. Получение и свойства гидроксида алюминия.
Получить осадок Al(OH)3 и доказать его амфотерные свойства.
Опыт 9. Гидролиз солей алюминия.
Пр.1: проверить реакцию среды в р-ре AlCl3 с помощью индикатора лакмуса. Составить уравнение гидролиза соли в молекулярной и ионной форме.
Пр.2: 3-4к. р-ра AlCl3 + 3-4к. р-ра Na2S, наблюдать образование осадка и запаха сероводорода.
Пр.3: проделать аналогичный опыт, заменив Na2S на Na2CO3. Составить уравнения реакций полного гидролиза AlCl3 в присутствии Na2S и Na2CO3.
Какова роль Na2S и Na2CO3?
Вопросы для подготовки к занятию и самоконтроля
Сравните свойства двух первых и двух последних элементов IVгруппы и объясните причину их различия.
Графит обрабатывают концентрированной азотной кислотой. Образуются смесь газов поглощают насыщенным раствором гидроксида натрия. Составьте уравнения реакций, уравняйте их.
Составьте уравнения обменных реакций в растворе с участием соединений углерода:
а) BaCO3 + HCl → д) CaMg(CO3)2 + H2SO4 →
б) CO2 + H2O + CaCO3 → е) Ca(OH)2 + CO2(недостаток) →
в) CO2 + Na[Al(OH)4] → ж) Ca(OH)2 + CO2(избыток) →
г) K2CO3 + H2O + ALCl3 → з) NaHCO3 + … → CaCO3↓ + …
Как можно различить растворы, содержащие гидрокарбонат калия и карбонат натрия?
а) добавлением соляной кислоты
б) добавлением хлорида калия
в) добавлением хлорида кальция
г) добавлением избытка гидроксида бария
5) Какие вещества полностью переводят гидрокарбонаты в карбонаты?
а) сильные кислоты в) вода
б) щелочи г) раствор углекислого газа
6) Кремний растворили в концентрированном растворе гидроксида калия. К полученному раствору добавили избыток соляной кислоты. Помутневший раствор нагрели. Выделившийся осадок отфильтровали и прокалили с карбонатом кальция. Напишите уравнения описанных реакций.
7) Как из растворимых силикатов получить кремневую кислоту в виде геля и золя? Какой вывод следует сделать о сравнительной силе угольной и кремниевой кислот, если последняя выделяется при пропускании CO2 в раствор «жидкого стекла»?
8) Какая из указанных ниже солей Na2CO3 и Na2SiO3 будет иметь в водном растворе при одинаковых условиях (концентрация, температура) большую степень гидролиза? В каком из растворов величина рН будет выше? Предложите способ усиления и подавления гидролиза.
9) При одних и тех же условиях степень гидролиза какой соли больше: Na2SnO2 или Na2SnO3; Sn(NO3)2 или Pb(NO3)2? Где больше величина рН? Избыток каких ионов в растворе уменьшает гидролиз этих солей?
10) Допишите продукты и уравняйте ОВР:
а) SnCl2 + KMnO4 + HCl → MnCl2 + …
б) PbO2 + MnSO4 + HNO3 → HMnO4 + …
11) Дайте сравнительную характеристику бора и алюминия. В чем причина различия свойств? Явление «диагонального» сходства элементов. Сопоставьте свойства элементов бора и кремния; алюминия и бериллия. Допишите уравнения реакций:
B
+ HNO3(к)
→ Al
+ HNO3(к)
![]()
B + NaOH + H2O → Al + NaOH + H2O →
Si + NaOH + H2O → Be+ NaOH + H2O →
12) Тетроборат натрия может быть получен сплавлением соды с оксидом бора. Напишите уравнение этой реакции. Какое равновесие определяет среду водного раствора полученной соли и как оно может быть полностью смещено вправо?
13) Выразите в виде уравнений следующие цепочки превращений:
а) CaC2 → C2H2 → CO2 →CaCO3 → Ca(HCO3)2 → CaCO3 → CO2
б) SiO2 → Si → Mg2Si →SiH4 → SiO2 → K2SiO3 → H2SiO3 → SiO2 → SiF4
в) Sn → Sn(NO3)2 → Sn(OH)2 →K2[Sn(OH)4] → K2[Sn(OH)6] → Sn(OH)4
г) Al2O3 → Al → Al2(SO4)3 →Al(OH)3 → Na3[Al(OH)6] → AlCl3 → Al(NO3)3 → K3[Al(OH)6] → Al(OH)3 → Al2O3
ЗАНЯТИЕ 16.
Тема: ХИМИЯ МЕТАЛЛОВ. D – ЭЛЕМЕНТЫ VII И VIII ГРУПП
Вопросы семинара:
Обоснование размещения марганца, технеция и рения в VII группе Периодической системы. Сходство и различие элементов побочной и главной подгрупп. Электронные конфигурации атомов. Степени окисления.
Кислотно-основные свойства оксидов и гидроксидов марганца в зависимости от степени окисления.
Окислительно-восстановительные свойства соединений марганца.
Общая характеристика d–элементов VIII группы. Их деление на подгруппы и семейства: железо и платиновых металлов. Факторы, лежащие в основе этого и другого деления.
Кислотно-основные свойства оксидов и гидроксидов железа в зависимости от степени окисления.
Окислительно-восстановительные свойства соединений железа.
Качественные реакции на соединения железа(II) и железа(III).
Лабораторная работа.
Лабораторная работа
Опыт 1. Восстановительные свойства соединений марганца (II).
Пр.1,2: получить в двух пробирках Mn(OH)2 обменной реакцией. Пр.1 встряхнуть, пр.2 добавить 2-3к. Br-воды. В обеих пробирках наблюдать изменение цвета осадка.
Пр.3: 1к. MnSO4 + 5-6к. HNO3 + 1мкш. NaBiO3. Наблюдать появление розовой (малиновой) окраски. Составить уравнения реакций, протекающих в пробирках 1-3. Уравнять ионно-электронным методом.
Опыт 2. Окислительно-восстановительная двойственность соединений марганца (IV).
Пр.1: 1мкш. MnO2 + 5-6к. конц. HCl , нагреть. Доказать выделение Cl2 с помощью влажной йодкрахмальной бумажки.
Демонстрация: в тигель внести 1 гранулу KOH и 2-3мкш. KClO3, нагревать до расплавления, затем внести 0,5мкш. MnO2. Наблюдать образование расплава зеленого цвета. Тигель охладить, содержимое растворить в 2-3 мл воды и сохранить для опыта 4. Составить уравнения реакций, установить в обоих случаях функцию MnO2 .
Опыт 3. Окислительно-восстановительная двойственность манганатов.
Пр.1: 5-6к. р-ра K2MnO4 (из предыд. оп.) + п/к хлорную воду до изменения окраски с зеленой на розовую.
Пр.2: 5-6к. р-ра K2MnO4 + 1мкш. Na2SO3. Наблюдать изменение окраски и выделение осадка. Составить уравнения реакций, протекающих в пр.1 и 2. Определить функцию манганата в том и другом случае.
Пр.3: 5-6к. р-ра K2MnO4 + 3-4к. Н2SO4.. наблюдать изменение окраски и выпадение осадка, составить уравнение протекающей реакции. К какому типу ОВР она относится?
Опыт 4. Влияние реакции среды (рН) на окислительные свойства перманганата калия.
Пр. 1: 2-3 к. р-ра KMnO4 + 3-4 к. Н2SO4 + 1 мкш. Na2SO3.
Пр. 2: 2-3 к. р-ра KMnO4 + 3-4 к. Н2O + 1 мкш. Na2SO3
Пр. 3: 2-3 к. р-ра KMnO4 + 5-6 к. КОН + 1 мкш. Na2SO3
Наблюдать во всех пробирках изменение окраски раствора и выпадение
(пр.2) осадка. Составить уравнения ОВР. Дать оценку окислительно-восстановительных свойств MnO4- - иона, используя значения восстановительных потенциалов.
Опыт 6. Окисление солей железа (III) в кислой среде.
В пр. : 3-4 к. р-ра KMnO4 + 2-3 к. Н2SO4 + 1 мкш. FeSO4 (соль Мора).
Наблюдать обесцвечивание раствора. Составить уравнение реакции окисления соли железа (II).
Опыт 7. Качественные реакции на соединения железа (II)и (III).
Пр. 1: 1 мкш. соли Мора (FeSO4) растворить в 1 мл воды + 1-2 к. р-ра красной кровяной соли (гексацианоферрат(III) калия). Наблюдать изменение окраски раствора.
Пр. 2: 1-2 к. р-ра FeCl3 + 2-3 к. желтой кровяной соли (гексацианоферрат(II) калия). Наблюдать изменение окраски раствора. Составить уравнения реакций, протекающих в пр. 2 и 3, учтя, что в обоих случаях образуется одно и то же соединение: KFe[Fr(CN)6].
Пр.3:1-2 к. р-ра FeCl3 + 5-6 к. Н2О + 1-2 к. NH4CNS. Наблюдать появление кроваво-красного окрашивания. Составить уравнение реакции образования комплексного соединения – гексароданоферрат(III) аммония.
Вопросы для подготовки к занятию и самоконтроля
1. Укажите заряд ядра атома, у которого конфигурация валентных электронов….4d55s2
а) 26; б) 75; в) 25; г) 43.
2. Нехарактерные для d-элементов свойства - это:
а) различные степени окисления;
б) окислительно-восстановительные реакции;
в) окраска ионов;
г) отсутствие склонности к комплексообразованию;
3. Какое свойство характерно для элементов подгруппы марганца:
а) в подгруппе имеются как металлы, так и не металлы;
б) высшая положительная степень окисления +7;
в) как и галогены, имеют отрицательную степень окисления -1;
г) простые вещества являются окислителями.
4. В чем различие элементов подгруппы марганца и галогенов?
а) в свойствах простых веществ;
б) в числе валентных электронов;
в) в высшей положительной степени окисления;
г) в формулах высших оксидов.
Почему Mn и Cl стоят в таблице Д.И. Менделеева в одной группе, но разных подгруппах?
5. Установите соответствие:
1) KMnO4 а) бесцветный
2) MnO2 б) розовый
3) K2MnO4 в) бурый
4) MnSO4 г) зеленый
6. Допишите продукты реакции и уравняйте их ионно-электронным методом. Как изменится цвет в ходе реакций?
а) MnSO4 + (NH4)2S2O8 + H2O → HMnO4 + (NH4)2SO4 + H2SO4;
б) MnO2 + KBr + H2SO4 → …
в) MnO2 + KNO3 + KOH → KNO2 + …
г) K2MnO4 + FeSO4 + H2SO4 → Fe2(SO4)3 + …
д) KMnO4 + H2C2O4 + H2SO4 → CO2 + …
е) MnO2 + PbO2+ HNO3 → …
ж) MnO2 + NaBiO3+ HNO3 → …
7. Выразите в виде уравнений реакций следующие схемы:
Mn → MnSO4 →HMnO4 → KMnO4 → MnO2 → K2MnO4
K2MnO4 → MnO2 →MnCl2 → HMnO4
KMnO4 → K2MnO4 → MnSO4 → Mn(OH)2 → MnO2
8. Восстановите исходные вещества по продуктам реакции:
… → KCl + Na2FeO4 + CO2
а) KFeO2 + NaOH + H2O →
б) Fe2O3+ KClO + Na2CO3 →
в) FeCl3 + KOH + Na2CO3 →
г) FeCl2 + K2CO3 + NaOH →
9. Осуществите переходы:
Fe → FeCl2 → Fe(OH)2 → Fe(OH)3 → KFeO2 → FeCl3
Fe → FeCl3 → Fe(OH)3 → KFeO2→ K2FeO4
10. Какой объем 0,2н раствора сульфата железа(II) требуется для восстановления в кислотной среде перманганата калия, который содержится в 40 мл 0,1н раствора.
11. Какой из ионов – Fe+2, Co+2 или Ni+2 обладает более сильными восстановительными свойствами?
а) Fe+2 в) Co+2
б) Ni+2 г) все не являются восстановителями
12. Сопоставьте кислотно-основные свойства оксидов и гидроксидов Fe(II) и Fe(III). На основании этого решите вопрос: какая соль FeSO4 и Fe2(SO4)3 гидролизована в большей степени и почему?
13. Закончите уравнения реакций. Какого типа эти реакции?
Одинакова ли функция FeCl3 в данных уравнениях.
FeCl3 + Na2CO3 + H2O →
FeCl3 + H2S + H2O →
14. Напишите формулы двух солей железа(III), в одной из которых железо является катионом, в другой входит в состав аниона.
15. Сплавили оксид железа(III) с хлоратом калия в щелочной среде. Полученный продукт красного цвета обработали раствором бромида калия в кислой среде. Продукт реакции - соединение железа – восстановили аммиаком, который сам окисляется до свободного азота.
Полученное соединение железа даёт с гексацианоферратом(III) калия синее окрашивание. Составьте уравнение реакций, уравняйте их методом полуреакций.
Вопросы для подготовки к занятию и самоконтроля
1. Укажите заряд ядра атома, у которого конфигурация валентных электронов … 4d55s2:
а) 26; б) 75; в) 25; г) 43.
2. В каком ряду оксидов марганца наблюдается усиление кислотных свойств?
а) MnO → MnO3 → MnO2 → Mn2O7
б) MnO → MnO2 → Mn2O7 → MnO3
в) MnO → MnO2 → MnO3 → Mn2O7
г) Mn2O7 → MnO3 → MnO2 → MnO
3. В какой группе соединений присутствуют ортоферрит натрия?
а) Na2FeO4, HCrO2, K2MnO4;
б) Na2FeO4,H2CrO4, KMnO4;
в) NaFeO2, H2Cr2O7, K2MnO4;
г) Na3FeO3, MnO2, K2MnO3.
4. Наличие незаполненного d–подуровня обусловливает характерные свойства d-элементов:
а) различные степени окисления;
б) окислительно-восстановительные свойства;
в) окраска ионов;
г) отсутствует склонность к комплексообразованию.
5. В чем различие элементов подгруппы марганца и галогенов?
а) в свойствах простых веществ;
б) в числе валентных электронов;
в) в высшей положительной степени окисления;
г) в формулах высших оксидов.
6. Почему Mn и Cl стоят в таблице Д.И. Менделеева в одной группе, но разных подгруппах?
7. Закончите уравнения реакций. Уравняйте их ионно-электронным методом.
а) KMnO4 + KI + H2SO4 →
б) KMnO4 + KI + KOH →
в) KMnO4 + KI + H2O →
Как доказать, что образуется I2?
8. Допишите уравнения реакций. Подберите коэффициенты ионно-электронным методом. Что является окислителем в этих реакциях? Как меняется окраска раствора?
а) K2MnO4 + FeSO4 + H2SO4 → Fe2(SO4)3 + …
б) K2MnO4 + H2S + H2SO4 →
в) K2MnO4 + Na2SO3 + H2O →
9. Допишите уравнения реакций, уравнять ионно-электронным методом.
а) KMnO4 + Na2S + H2SO4 →
б) KMnO4 + MnSO4 + H2O →
в) KMnO4 + H2C2O4 + H2SO4 → CO2 + …
г) Mn(NO3)2 + PbO2 + HNO3 →
д) MnSO4 + NaBiO3 + HNO3 →
Как изменяется окраска растворов?
10. Как можно из MnO2 получить соединения марганца (II), (VI) и (VII). Докажите это на реакциях:
MnO2 + HCl(к) →
MnO2 + KI + H2SO4 →
MnO2
+ NaNO3
+ Na2CO3
![]()
MnO2 + PbO2+ HNO3 →
MnO2 + NaBiO3+ HNO3 →
Окислителем или восстановителем является соединение марганца в приведенных реакциях?
11. Осуществите следующие превращения:
Mn → MnSO4 →HMnO4 → KMnO4 → MnO2 → K2MnO4
K2MnO4 → MnO2 →MnCl2 → HMnO4
KMnO4 → K2MnO4 → MnSO4 → Mn(OH)2 → MnO2
12. Восстановите исходные вещества по продуктам реакции:
… → KCl + Na2FeO4 + CO2
а) KFeO2 + NaOH + H2O →
б) Fe2O3+ KClO + Na2CO3 →
в) FeCl3 + KOH + Na2CO3 →
г) FeCl2 + K2CO3 + NaOH →
13. Осуществите переходы:
Fe → FeCl2 → Fe(OH)2 → Fe(OH)3 → KFeO2 → FeCl3
Fe → FeCl3 → Fe(OH)3 → KFeO2→ K2FeO4
14. Имеются реактивы FeSO4, HNO3, KCN. Получите берлинскую лазурь.
15.Какой объем 0,2н раствора сульфата железа(II) требуется восстановления в кислотной среде перманганата калия, который содержится в 40 мл 0,1н раствора.
16. Какой объем 0,1н раствора пероксида водорода необходимо окислить избытком перманганата калия для получения 324мл газа (н.у.).
17 Какой из ионов – Fe+2, Co+2 или Ni+2 обладает более сильными восстановительными свойствами?
а) Fe+2 в) Co+2
б) Ni+2 г) все не являются восстановителями
18. Сопоставить кислотно-основные свойства оксидов и гидроксидов Fe(II) и Fe(III). На основании этого решить вопрос: какая соль FeSO4 и Fe2(SO4)3 гидролизована в большей степени и почему? Какое значение рН имеют растворы MnCl2, Mn(CH3COO)2. Почему?
ЗАНЯТИЕ 17.
Тема: ХИМИЯ МЕТАЛЛОВ. D - ЭЛЕМЕНТЫ VI,II И I ГРУПП
Вопросы семинара и план занятия:
d- Элементы подгруппы хрома: особенности электронного строения. Кислотно-основные свойства соединений хрома в зависимости от степени окисления. Различия в окраске ионов в зависимости от СО и среды. Гидролиз солей хрома (III), примеры. ОВ свойства соединений хрома. Сравнение окислительно-восстановительных свойства соединений Cr(III) в щелочной среде и Cr(VI) в кислой среде. Примеры реакций. Качественная реакция на соединения Cr(III) и Cr(VI).
d- Элементы подгруппы цинка: изменение ОВ и КО свойств соединений в подгруппе. Соединения ртути в различных СО. Взаимодействие ртути с азотной кислотой в зависимости от концентрации кислоты и соотношения количеств ртути и кислоты. Получение оксидов ртути их свойства. ОВ свойства соединений ртути. Катионы ртути(I) и ртути(II) как комплексообразователи. Химизм токсического действия соединений Cd и ртути. Удаление пролитой ртути (демеркуризация).
d- Элементы I группы. Соединения меди(I), меди(II) и серебра. КО и ОВ свойства, способность к комплексообразованию, примеры комплексов. Соединения золота(I) и золота(III).
Лабораторная работа.
Тестовый контроль по теме «d-элементы».
Вопросы для подготовки к занятию и самоконтроля
Объясните, почему CO(+2) более устойчива для марганца и менее устойчива для хрома. Образуют ли эти элементы водородные соединения?
Какие из перечисленных соединений: CrSO4, Cr2(SO4)3. Cr(OH)3, CrO3, Cr2O3, Na2CrO4 проявляют только окислительные свойства, только основные или кислотные, а какие амфотерные?
Какое соединение хрома образовалось в ходе реакции, если окраска изменилась с оранжевой на желтую?
а) Cr(OH)3; б) KCrO2; в) K2CrO4 ; г) K3[(Cr(OH)6 ].
4. В каком случае происходит процесс восстановления хрома:
а) Cr3+ → Cr2O72-; б) Cr2O72- → CrO42-;
в) CrO42- → Cr2O72-; г) CrO42- → Cr2(OH)3.
5. В пробирке находится раствор соли хрома(III) рН раствора равен 12. Какая соль находится в растворе? а) CrCl3; б) CrCl3; в) NaCrO2; г) Cr2(SO4)4.
6. В пробирке находится раствор соли, рН раствора равна 4. Какая соль в растворе?
а) Na3[Cr(OH)6]; б) KCrO2; в) Cr2(SO4)3.
7. Какую соль необходимо прибавить к раствору хлорида хрома(III), чтобы прошел полный (совместный) гидролиз?
а) NaNO3 б) BiCl3 в) NH4NO3 г) Na2CO3.
8. Выразите в виде уравнений следующие схемы:
а) Na2CrO4 → Na2Cr2O7 → Cr2(SO4)3 → Cr(OH)3 → K3[Cr(OH)6] → Cr(OH)3
б) Cr2(SO4)3 → Cr(OH)3 → K3[Cr(OH)6] → K2CrO4 → K2Cr2O7→ Cr2(SO4)3
9. Закончите уравнения нижеприведенных реакций; те из них, которые являются окислительно-восстановительными, уравняйте электронно-ионным методом:
а) Cr2O3 + KClO3 + KOH →
б) K2Cr2O7 + KOH →
в) Cr2O3 + Na2CO3 →
г) Cr2O3 + KClO3 + KOH →
д) K2Cr2O7 + H2O2 + H2SO4(в среде эфира) →
10. Закончите уравнения реакций:
а) Cu + HNO3(конц.) →
б) Ag + HNO3(разб.) →
в) Zn + H2SO4(конц.) →
г) An + HNO3 + HCl →
д) Zn + HNO3(разб.) →
е) Hg + HNO3(конц., изб.) →
ж) Hg(изб.) + HNO3(разб.) →
11. В лаборатории оказались без этикеток банки с KOH, Zn(NO3)2, Cd(NO3)2 и Hg(NO3)2; все эти вещества бесцветны. Предложите способ идентификации этих веществ при условии, что, кроме этих реактивов, в вашем распоряжении имеется только вода.
12. С помощью универсальной индикаторной бумаги измерили рН раствора ZnCl2, величина оказалась равной 3. Затем измерили рН раствора CdCl2 такой же концентрации. Какая из нижеприведенных величин рН раствора CdCl2 может быть реальной:
а) рН = 3; б) рН = 5; в) рН = 1; г) рН = 9.
Лабораторная работа
Опыт 1.Кислотно-основные свойства гидроксидов.
Пр.1: Получить осадок Cr(OH)3 и доказать его амфотерные свойства. Составить необходимые уравнения реакций.
Пр. 2: Получить обменной реакцией гидроксид меди; доказать его амфотерность.
Пр.3,4: Получить обменными реакциями гидроксиды цинка и кадмия; доказать соответствующими реакциями, что Zn(OH)2 амфотерен, а Cd(OH)2 обладает основными свойствами. Составить необходимые уравнения реакций.
Опыт 2. Гидролиз солей хрома (III).
Пр. 1: Определить реакцию среды в растворе Cr2(SO4)3 c помощью лакмуса и универсальной индикаторной бумаги. Составить уравнения гидролиза солей в молекулярной и ионной форме.
Пр.2,3: Провести реакцию гидролиза соли хрома (III) в присутствии карбоната натрия (Пр.2) и сульфида натрия (Пр. 3). Наблюдать образование осадка. Составить уравнения протекающих реакций полного гидролиза соли хрома. Почему в присутствии Na2CO3 и Na2S гидролиз идет до конца?
Опыт 3. Окислительно-восстановительные свойства соединений хрома, меди и серебра.
Пр. 1: 3-4 к. р-ра соли хрома(III) + п/к р-р КОН до растворения осадка Cr(OH)3 + 5-6 к. Н2О2.Нагреть, наблюдать образование желтой окраски. Составить уравнение реакции окисления гексагидроксохромата (III) натрия пероксидом водорода до хромата калия.
Пр. 2: 2-3 к. р-ра K2Cr2O7 + 2-3 к. H2SO4 + 1 мкш. Na2SO3. Наблюдать изменение окраски раствора, составить уравнение реакции восстановления дихромата калия до сульфата хрома (III).
Пр. 3: В тщательно вымытую пробирку прилить 5-6 к. р-ра AgNO3 + п\к р-р аммиака до растворения осадка AgOH + 6-8 к. р-ра глюкозы, осторожно нагреть. Наблюдать образование на стенках блестящего налета серебра. Составить уравнение окисления глюкозы C5H6(OH)5CHO аммиачным раствором гидроксида серебра [Ag(NH3)2]OH до глюконовой кислоты C5H6(OH)5COOH.
Пр. 4: 3-4 к. р-ра CuSO4 + 1-2 к. р-ра KI. Наблюдать образование осадка и изменение окраски раствора. Доказать тремя способами, что желтая окраска – это йод. Составить уравнение реакции, учтя, что осадок имеет формулу CuI.
Опыт 4. Качественные реакции на соединения хрома (VI), меди и серебра.
Пр.
1: 1-2 к. р-ра K2Cr2O7
+ 3 – 4 к. H2SO4
+ 2-3 к. р-ра Н2О2.
+ 3-4 к. диэтилового эфира, интенсивно
встряхнуть, наблюдать окрашивание
эфирного слоя. Составить уравнение
реакции, учтя, что окраска эфирного слоя
связана с образованием пероксида хрома
CrO5.
Пр. 2-3: по 1-2 к. р-ра AgNO3 + 1 к. р-ра NaCl = осадок. Проверить растворимость осадков в HNO3 и NH3. В каком случае осадок растворяется? Составить уравнения протекающих реакций.
Пр. 4: 3-4 к. р-ра CuSO4 + п/к р-р NH4OH до растворения образовавшегося осадка и изменения цвета раствора. Составить уравнения протекающих реакций.
П Р И Л О Ж Е Н И Е
Таблица 1.
