
нитрит натрия
.doc-
Общие сведения.
Формула:
NaNO2
Нитри́т на́трия (устар. натрий азотистокислый).
Хорошо растворим в воде и гигроскопичен. На воздухе медленно доокисляется до нитрата натрия NaNO3.
Основные свойства:
Систематическое название: Sodium nitrite(англ.) (ИЮПАК) Нитрит натрия
Молярная масса: 69.00 г/моль
Плотность: 2,2 г/см3
Фаза: твёрдая
Растворимость в воде: 82 г/100 мл (20 °C)
Температура плавления: -271 °C Температура разложения: >320 °C
-
Получение.
Нитрит натрия NaNO2 является солью азотистой кислоты и получается обычно из оксидов азота по реакции:
NO + NO2 + 2NaOH = 2NaNO2 + Н2О
-
Качественный анализ.
-
Аналитические реакции на катион натрия.
-
Реакция с ацетатом диоксоуран(VI)цинка Zn(UO2)3(CH3COO)8 c образованием жёлтого кристаллического осадка (фармакопейная реакция - ГФ) или жёлтых кристаллов тетра- и октаэдрической формы, нерастворимых в уксусной кислоте (МКС). Для повышения чувствительности реакции следует нагреть исследуемую смесь на предметном стекле.
NaCl
+ Zn(UO2)3(CH3COO)8
+ CH3COOН
+ 9 H2O
![]()
NaZn(UO2)3(CH3COO)9 · 9 H2O + HCl
Мешающие ионы: избыток ионов K+, катионы тяжёлых металлов (Hg22+, Hg2+, Sn2+, Sb3+, Bi3+, Fe3+ и др.). Реакция используется как дробная после удаления мешающих катионов.
2. Окрашивание бесцветного пламени горелки в жёлтый цвет (ГФ).
3. Реакция с пикриновой кислотой с образованием кристаллов пикрата натрия жёлтого цвета игольчатой формы, исходящих из одной точки (МКС).
-
Error: Reference source not found
Реакция используется как дробная только в отсутствие мешающих ионов (K+, NH4+, Ag+).
4. Реакция с гексагидроксостибатом(V) калия K[Sb(OH)6] с образованием белого кристаллического осадка, растворимого в щелочах.
NaCl
+ K[Sb(OH)6]
![]() Na[Sb(OH)6]
+ KCl
Na[Sb(OH)6]
+ KCl
Условия проведения реакции: а) достаточная концентрация Na+; б) нейтральная реакция раствора; в) проведение реакции на холоду; г) потирание стеклянной палочкой о стенку пробирки. Мешающие ионы: NH4+, Mg2+ и др.
В кислой среде реагент разрушается с образованием белого аморфного осадка метасурьмяной кислоты HSbO3.
K[Sb(OH)6]
+ HCl
![]() KCl + H3SbO4
+
2 H2O
KCl + H3SbO4
+
2 H2O
H3SbO4
![]() HSbO3
+ H2O
HSbO3
+ H2O
-
Аналитические реакции на нитрит-ион.
-
С разбавленными минеральными кислотами (групповым реагентом) (ГФ) (табл. 16).
-
С дифениламином в среде концентрированной H2SO4 (ГФ) с образованием соединения синего цвета. Дифениламин окисляется нитрит-ионом в "дифенилбензидин фиолетовый":

-
С антипирином (ГФ) с образованием нитрозоантипирина изумрудно-зелёного цвета.

Методика: 5-6 капель 5%-ного раствора антипирина помещают в фарфоровую чашку (пробирку), прибавляют 2-3 капли анализируемого раствора, 2-3 капли 1 моль/дм3 H2SO4, перемешивают.
-
С реактивом Грисса (сульфаниловая кислота и щелочной раствор -нафтола). Сульфаниловая кислота диазотируется азотистой кислотой, а образовавшаяся соль диазония сочетается с -нафтолом с образованием азосоединения красного цвета.
-
Количественный анализ.
-
Перманганатометрия.
Определение массовой доли нитрита натрия в растворе перманганатометрическим методом (реверсивное титрование)
5 NaNO2 + 2 KMnO4 + 3 H2SO4 = 5 NaNO3 + 2 MnSO4 + K2SO4+ 8 H2O
М (NaNO2 ) = 69,00 г/моль
Для избежания потерь, связанных с указанным процессом, изменяют порядок титрования: подкисленный раствор перманганата калия титруют раствором нитрита натрия. Последний при этом мгновенно окисляется перманганатом калия до нитрат-иона и оксиды азота не образуются.
Методика: В коническую колбу для титрования вместимостью 250-500 см3 помещают 10-15 см3 0,1 М раствора перманганата калия, прибавляют равный объём разведённой серной кислоты (1:5). Разбавляют раствор 100- 150 см3 воды, слегка нагревают (50-60о С) и титруют раствором нитрита натрия до обесцвечивания розовой раствора.
-
Нитритометрия.
Стандартизация 0, 1 М раствора нитрита натрия
по сульфаниловой кислоте (способ отдельных навесок)
А. Приготовление 0,1 М раствора нитрита натрия (см. табл. 1, стр. 21).
Б. Установка КП раствора нитрита натрия
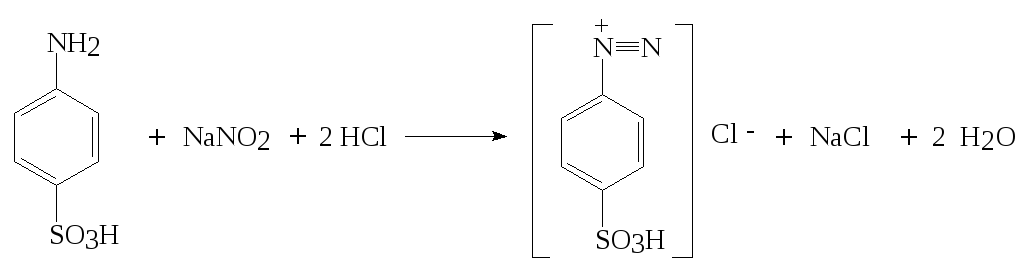
М (сульф. к-ты) = 173,19 г/моль
Методика: Около 0,2 г (точная навеска) сульфаниловой кислоты помещают в толстостенный химический стакан, прибавляют 60 см3 дистиллированной воды, 10 см3 разведённой хлороводородной кислоты (1:2), 1 г бромида калия, 4 капли раствора тропеолина 00 и 2 капли раствора метиленовой сини, охлаждают до 18-200С и титруют раствором нитрита натрия до перехода красно-фиолетовой окраски раствора в голубую.
-
Применение.
Нитрит натрия применяется для образования диазо-аминных соединений. Эти соединения применяются в синтезе как источник аминогрупп при реакциях с «ядром» соединения, за счет относительно более легкого отделения азотных групп N2.
В лабораторных условиях нитрит натрия также используется для деактивации избытка азида натрия
Как пищевая добавка, применяется в пищевой промышленности в двух целях, как антиокислитель, обеспечивающий изделиям из мяса и рыбы «естественный цвет», и как антибактериальный агент, препятствующий росту Clostridium botulinum — возбудителя ботулизма, — тяжелой пищевой интоксикации, вызываемой ботулиническим токсином и характеризуемой поражением нервной системы.
В Евросоюзе может применяться только как добавка к соли не более 0,6 %.
Пищевая добавка E250. Аналогичными свойствами обладает и нитрит калия — пищевая добавка E249.
Соответствует ГОСТу 4197-74 или ТУ 6-09-590-75 (марка ОСЧ 4-7-3).
-
Список литературы.
-
Лурье Ю.Ю. Справочник по аналитической химии. Москва, 1972;
-
Методическое указание «Инструментальные методы анализа», Пермь, 2004;
-
Методическое указание «Качественный химический анализ», Пермь, 2003;
-
Методическое указание «Количественный химический анализ», Пермь, 2004;
-
Рабинович В.А., Хавин З.Я. Краткий химический справочник, Ленинград, 1991;
-
«Большая советская энциклопедия».
