
- •Общие сведения.
- •Получение.
- •Качественный анализ.
- •Аналитические реакции на катион натрия.
- •Аналитические реакции на тиосульфат-ион.
- •Количественный анализ.
- •Гравиметрический анализ.
- •Титриметрический анализ.
- •Окислительно-восстановительное титрование.
- •Перманганатометрия.
- •Цериметрия.
- •Инструментальный анализ.
- •Электрохимические методы анализа
- •Потенциометрия.
- •Потенциометрическое определение тиосульфата натрия
- •Методика
- •Расчет результатов
- •Кулонометрия. Кулонометрические методы анализа
- •Методы определения количества электричества
- •Условия кулонометрических определений:
- •Определение тиосульфата натрия методом кулонометрического титрования
- •Методика
- •Применение.
- •Список литературы.
Цериметрия.
Стандартизация 0,1 М раствора сульфата церия(IV) по
раствору тиосульфата натрия с известным КП (способ пипетирования)
2 Ce(SO4)2 + 4 KI = Ce2(SO4)3 + 2 K2SO4 + I2
I2 + 2 Na2S2O3 = 2 NaI + Na2S4O6
Методика: В склянку с притёртой пробкой вместимостью 250 см3 помещают 20 см3 раствора сульфата церия(IV), добавляют 10 см3 раствора серной кислоты (1:9), 0,5 г Na2CO3, 3 г KI, быстро закрывают склянку пробкой, перемешивают и оставляют стоять 10 минут. Затем обмывают пробку водой и титруют выделившийся йод 0,1 М раствором тиосульфата натрия до соломенно-жёлтой окраски раствора, добавляют 2 см3 раствора крахмала и продолжают медленно титровать при тщательном перемешивании до обесцвечивания раствора.
Параллельно проводят «холостой опыт», для чего к 20 см3 воды добавляют 10 см3 раствора серной кислоты (1:9), 0,5 г Na2CO3, 3 г KI и титруют, как описано выше.
КП 0,1 М Ce(SO4)2 рассчитывают по формуле:
![]() ;
где:
;
где:
V - объём 0,1 М раствора тиосульфата натрия, израсходованного на титрование раствора сульфата церия;
V1 - объём 0,1 М раствора тиосульфата натрия, израсходованного на «холостое» титрование;
Kст - коэффициент поправки 0,1 М раствора тиосульфата натрия;
V2 - объём 0,1 М раствора сульфата церия, взятый для титрования.
Инструментальный анализ.
Электрохимические методы анализа
Потенциометрия.
Потенциометрический метод основан на измерении потенциала электрода, погружённого в анализируемый раствор.
Потенциометрические методы анализа основаны на использовании зависимости электродвижущей силы (ЭДС) электрохимической ячейки от концентрации анализируемого вещества в растворе.
В идеальном случае эта зависимость описывается уравнением Нернста:
![]()
Измеряют ЭДС специально подобранной электродной пары, состоящей из индикаторного электрода и электрода сравнения, опущенных в анализируемый раствор, компенсационным или некомпенсационным способами.
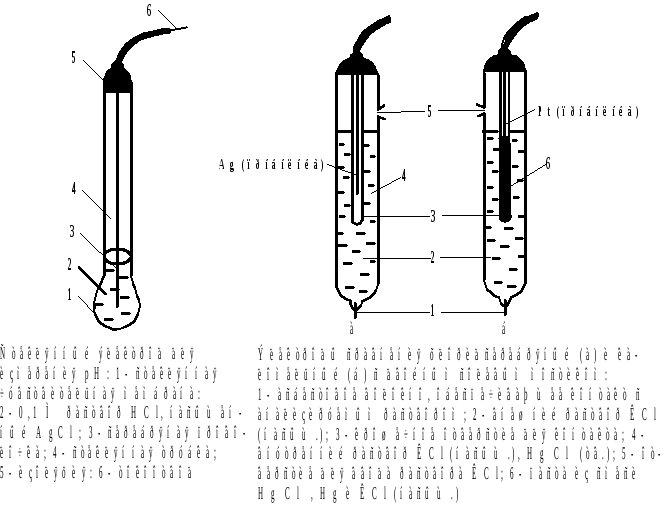
Индикаторные электроды:
а) Активные металлические электроды (Аg, Сu, Рb), потенциал которых зависит от активности собственных ионов в растворе.
б) Инертные металлические электроды (Pt, Аu), потенциал которых зависит от соотношения Ox/Red в растворе. Например, электрод платиновый (ЭПВ) для измерения потенциалов окислительно-восстановительных пар; перед эксплуатацией индикаторную часть электрода обезжиривают спиртом или ацетоном, промывают дистиллированной водой, высушивают фильтровальной бумагой;
в) ионселективные (мембранные) электроды с твёрдой, жидкой или стеклянной мембраной, ферментные ионселективные электроды. Электрод стеклянный (ЭСЛ) для измерения активности ионов Н+ (величины рН); перед эксплуатацией вымачивают не менее 24 часов в 0,1 моль/дм3 растворе хлороводородной кислоты, промывают дистиллированной водой, высушивают фильтровальной бумагой.
Электроды сравнения:
а) электрод хлорсеребряный (НХС, ЭВЛ); промывают электрод дистил-лированной водой, заливают насыщенным раствором хлорида калия и выдерживают в этом растворе 24-48 часов;
(перед эксплуатацией удаляют пробку из бокового отверстия)
б) каломельный электрод
Определение активности ионов и окислительно-восстановительных потенциалов проводят на рН-метрах или универсальных иономерах (ЭВ-74).
Основными частями потенциометрической установки являются: источник тока, потенциометрический мостик, гальванометр, электроды.
В аналитической практике применяют прямую и косвенную потенциометрию (потенциометрическое титрование).
Прямая потенциометрия – метод определения концентрации ионов, основанный на измерении электрохимического потенциала индикаторного электрода, погружённого в исследуемый раствор. Применяется для определения активности Н+, Аg+, Нg 2+, Са 2+, Мg 2+, Zn 2+, Pb 2+, K+, Na+, NО3-, S2-, галогенид-ионов.
Концентрацию определяемого иона в анализируемом растворе находят по градуировочному графику, построенному в координатах Е - рС (С - концентрация стандартных растворов) или расчётным путём, используя уравнение, описывающее зависимость потенциала электрода от активности (концентрации) анализируемых ионов в растворе:
![]()
Метод применяется также для исследования реакций в растворах, определения различных характеристик вещества: установление состава и констант устойчивости комплексных соединений, определение констант ионизации кислот и оснований, рН и буферных ёмкостей буферных растворов, произведения растворимости.
