
- •Вопрос 1: перемещение,скорость материальной точки, вычесление пути
- •Вопрос 2 нормальное и тангенциальное ускорение
- •Вопрос 3: кинематика вращательного движения
- •Вопрос 12:. Уравнение динамики вращательного движения твердого тела
- •Вопрос 13:момент инерции тела
- •Вопрос 15: кинематика гармонических колебаний
- •Вопрос 16:динамика гармонических колебаний
- •Вопрос 23: сложение колебаний с близкими периодами. Биение
- •Вопрос 25 образование и распространение волн. Уравнение волны
- •29. Основное уравнение мкт
- •30.Распределение Максвелла
- •31. Барометрическая формула. Распределение Больцмана
- •34. Диффузия в газах
- •35. Вязкость газов
- •36. Первое начало термодинамики
- •38.Теплоемкость многоатомных и одноатомных молекул
- •39. Применение первого начала термодинамики к изопроцессам
- •41. Адиабатический процесс
- •43. Энтропия
- •44. Цикл Карно
- •48. Внутренняя энергия реального газа
- •49. Жидкое состояиие. Поверхностное натяжение жидкости
- •50. Строение и свойства твёрдых тел.
29. Основное уравнение мкт
Если газ в объеме V содержит N молекул, движущихся со скоростями v1, v2, ..., vN, то целесообразно рассматривать среднюю квадратную скорость
![]() (43.2)
(43.2)
характеризующую всю совокупность молекул газа.
Уравнение (43.1) с учетом (43.2) примет вид
![]() (43.3)
(43.3)
Выражение (43.3) называется основным уравнением молекулярно-кинетической теории идеальных газов. Точный расчет с учетом движения молекул по всевозможным направлениям дает ту же формулу.
Учитывая, что n =N / V, получим
![]()
или
![]()
где Е — суммарная кинетическая энергия поступательного движения всех молекул газа.
Так как масса газа m=Nm0, то уравнение (43.4) можно переписать в виде
![]()
Для одного моля газа т=М (М — молярная масса), поэтому
![]()
где Vm — молярный объем. С другой стороны, по уравнению Клапейрона — Менделеева, pVm=RT. Таким образом,
![]()
30.Распределение Максвелла
Молекулы газа при своем движении постоянно сталкиваются. Скорость каждой молекулы при столкновении изменяется. Она может возрастать и убывать. Однако среднеквадратичная скорость остается неизменной. Это объясняется тем, что в газе, находящемся при определенной температуре, устанавливается некоторое стационарное, не меняющееся со временем распределение молекул по скоростям, которое подчиняется определенному статистическому закону. Скорость отдельной молекулы с течением времени может меняться, однако доля молекул со скоростями в некотором интервале скоростей остается неизменной.
Нельзя ставить вопрос: сколько молекул обладает определенной скоростью. Дело в том, что, хоть число молекул очень велико в любом даже малом объеме, но количество значений скорости сколь угодно велико (как чисел в последовательном ряде), и может случиться, что ни одна молекула не обладает заданной скоростью.
|
|
Основываясь
на опыте Штерна, можно ожидать, что
наибольшее число молекул будут иметь
какую-то среднюю скорость, а доля быстрых
и медленных молекул не очень велика.
Необходимые измерения показали, что
доля молекул ![]() ,
отнесенная к интервалу скорости Δv,
т.е.
,
отнесенная к интервалу скорости Δv,
т.е. ![]() ,
имеет вид, показанный на рис. 3.3. Максвелл
в 1859 г. теоретически на основании теории
вероятности определил эту функцию. С
тех пор она называется функцией
распределения молекул по скоростям
или законом Максвелла.
,
имеет вид, показанный на рис. 3.3. Максвелл
в 1859 г. теоретически на основании теории
вероятности определил эту функцию. С
тех пор она называется функцией
распределения молекул по скоростям
или законом Максвелла.
Аналитически она выражается формулой
|
|
|
где m – масса молекулы, k – постоянная Больцмана.
31. Барометрическая формула. Распределение Больцмана
При выводе основного уравнения молекулярно-кинетической теории газов и максвелловского распределения молекул по скоростям предполагалось, что на молекулы газа внешние силы не действуют, поэтому молекулы равномерно распределены по объему. Однако молекулы любого газа находятся в потенциальном поле тяготения Земли. Тяготение, с одной стороны, и тепловое движение молекул — с другой, приводят к некоторому стационарному состоянию газа, при котором давление газа с высотой убывает.

или
![]() (45.2)
(45.2)
Выражение (45.2) называется барометрической формулой. Она позволяет найти атмосферное давление в зависимости от высоты или, измерив давление, найти высоту: Так как высоты обозначаются относительно уровня моря, где давление считается нормальным, то выражение (45.2) может быть записано в виде
![]() (45.3)
(45.3)
где р — давление на высоте h.
32. Опыты Перрена. Воспользовавшись идеей распределения молекул по высоте (см. формулу (45.4)), французский ученый Ж. Перрен (1870—1942) экспериментально определил значение постоянной Авогадро. Исследуя под микроскопом броуновское движение, он убедился, что броуновские частицы распределяются по высоте подобно молекулам газа в поле тяготения. Применив к ним больцмановское распределение, можно записать
![]()
где т—масса частицы, т1—масса вытесненной ею жидкости; m=4/3r3, m1=4/3r31 (r — радиус частицы, — плотность частицы, 1 — плотность жидкости).
Если n1 и n2 — концентрации частиц на уровнях h1 и n2, a k=R/NA, то
![]()

Значение NA, получаемое из работ Ж. Перрена, соответствовало значениям, полученным в других опытах, что подтверждает применимость к броуновским частицам распределения (45.4).

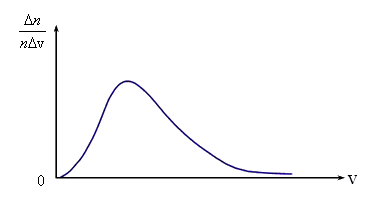 Рис.
3.3
Рис.
3.3 ,
,