
Ацетилениды
.docxАцетилени́ды — соли ацетилена и его производных, в котором один или два атома водорода замещены атомами элементов, более электроположительных, чем углерод. Углерод в ацетиленидах находится в sp-гибридизации. Синонимы: Ацетиле́нистые соедине́ния.
Ацетиленид меди(I) — красно-коричневые, иногда черные кристаллы. В сухом виде кристаллы детонируют при ударе или нагреве. При детонации в отсутствие кислорода не образуется газообразных веществ.
Ацетилениды состава МССН энергично реагируют с водой образуя ацетилен и гидроксид металла. Ацетилениды Mg, Na, Li часто используют в органическом синтезе для введения этинильной группы. При взаимодействии с алкилирующими агентами образуются алкилацетилены (например, метилацетилен, 1-бутин, 1-пентин):
RX + МССН → RCCH + MX.
Ацетилениды тяжёлых металлов обладают значительной химической неустойчивостью, при незначительных внешних воздействиях (удар, трение) разлагаются со взрывом. Наиболее известны как инициирующие взрывчатые вещества (ВВ) ацетилениды серебра Ag2C2 и меди Cu2С2. Также следует отметить сильнейшие взрывчатые способности ацетиленида ртути и диацетиленистых производных серебра, ртути и меди. Очень сильными взрывчатыми свойствами обладает ацетиленид золота.
Ацетилениды, как соли очень слабой кислоты — ацетилена (рКа = 25), атомы водорода в молекуле ацетилена способны замещаться на металл, так же могут быть получены при взаимодействии ацетилена с щелочными и щёлочноземельными металлами (при нагревании, легче — в жидком аммиаке) или металлоорганическими соединениями. В процессе реакции происходит замещение водорода в ацетилене металлами. При взаимодействии с магнийорганическими соединениями ацетилен легко образует магнийгалогенопроизводные (реактивы Иоцича). Двузамещённые ацетилениды Cu2С2 и Ag2C2 образуются при действии на ацетилен аммиачных растворов соответствующих солей меди(I) и серебра.
При реакции ацетилена с аммиачными растворами солей серебра и меди (I) образуются малорастворимые ацетилениды этих металлов. В сухом состоянии ацетилениды серебра и меди неустойчивы и взрываются при нагревании. Ацетиленид серебра также чувствителен к механическим воздействиям.
Образуется в виде осадка при пропускании ацетилена в аммиачные растворы солей меди(I).
![]()
Данная реакция используется для качественного обнаружения ацетилена.
Разлагается под действием кислот. В сухом виде взрывоопасен.
Катализатор и иногда промежуточный реагент в органическом синтезе.
Ацетилен и его гомологи с концевой тройной связью R–C≡C–H (алкины-1) вследствие полярности связи С(sp)-Н проявляют слабые кислотные свойства: атомы водорода могут замещаться атомами металла. При этом образуются соли – ацетилениды:

Ацетилениды щелочных и щелочноземельных металлов используются для получения гомологов ацетилена (раздел 6.5).
При взаимодействии ацетилена (или R–C≡C–H) с аммиачными растворами оксида серебра или хлорида меди (I) выпадают осадки нерастворимых ацетиленидов:
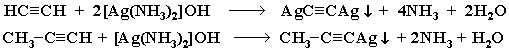
Образование серовато-белого осадка ацетиленида серебра (или красно-коричневого – ацетиленида меди RC≡CCu) служит качественной реакцией на концевую тройную связь.
В сухом состоянии ацетилениды тяжелых металлов неустойчивы и легко взрываются.
Ацетилениды разлагаются при действии кислот:
![]()
Если тройная связь находится не на конце углеродной цепи, то кислотные свойства отсутствуют (нет подвижного атома водорода) и ацетилениды не образуются:
![]()
АЦЕТИЛЕНИДЫ
-
щелочных металлов
-
Литий
-
Натрий
-
Калий
-
Рубидий
-
Цезий
-
Франций
-
унуненний
-
щёлочноземельных металлов
|
Группа → |
2 |
||||||||
|
↓ Период |
|
|
|
||||||
|
2 |
|
|
|
||||||
|
3 |
|
|
|
||||||
|
4 |
|
|
|
||||||
|
5 |
|
|
|
||||||
|
6 |
|
|
|
||||||
|
7 |
|
|
|
||||||
|
8 |
|
|
|
||||||
-
переходных металлов
Перехо́дные
мета́ллы (перехо́дные элеме́нты)
— элементы
побочных подгрупп Периодической
системы химических элементов Д. И.
Менделеева, в атомах
которых появляются электроны
на d- и f-орбиталях.[1]
В общем виде электронное строение
переходных элементов
можно представить следующим образом:
![]() .
На ns-орбитали содержится один или два
электрона,
остальные валентные
электроны находятся на
.
На ns-орбитали содержится один или два
электрона,
остальные валентные
электроны находятся на
![]() -орбитали.
Поскольку число валентных
электронов заметно меньше
числа орбиталей, то простые
вещества, образованные
переходными элементами,
являются металлами.
-орбитали.
Поскольку число валентных
электронов заметно меньше
числа орбиталей, то простые
вещества, образованные
переходными элементами,
являются металлами.
-
лёгких металлов
Согласно второму утверждению, переходные элементы имеют либо незаконченную d-подоболочку, либо имеют способность к формированию незаконченной d-подоболочки. В 2007-м году был синтезирован фторид ртути(IV)[6][7]. Это соединение содержит в себе атом ртути с незаконченной d-подоболочкой. По аналогии с этим коперницию предсказано существование такого же свойства, то есть у него предположительно должна формироваться аналогичная электронная конфигурация. В этом случае постпереходные металлы включают в себя только цинк и кадмий.
Существует определение, не данное ИЮПАК, которое приравнивает постпереходные металлы к элементам d-блока. В этом случае вся 12-я группа может содержать переходные элементы. Это определение не принято и не обговорено[8].
Сурьма считается металлоидом, металлом, а иногда и постпереходным элементом[8]. Алюминий не являестя ни переходным, ни постпереходным металлом, так как он не имеет d-подоболочки и расположен выше переходных элементов в таблице.
-
полуметаллов
Полумета́ллы (металлоиды, амфотерные металлы) — химические элементы, расположенные в периодической системе на границе между металлами и неметаллами. Для них характерно образование ковалентной кристаллической решётки и наличие металлической проводимости.
В физике твёрдого тела полуметаллами называются различные вещества, занимающие по электрическим свойствам промежуточное положение между металлами и полупроводниками.
К полуметаллам относят кремний, бор, германий, мышьяк, сурьма, теллур, иногда — висмут, полоний[1][2] и астат, а также олово, имеющее полупроводниковую форму, и аллотропную модификацию углерода — графит.
-
лантаноиды + лантан,
Лантано́иды (лантани́ды)[1] — семейство из 14 химических элементов III группы 6-го периода периодической таблицы. Семейство состоит из церия, празеодима, неодима, прометия, самария, европия, гадолиния, тербия, диспрозия, гольмия, эрбия, тулия, иттербия и лютеция. Лантан часто рассматривается вместе с этими элементами для удобства сравнения, хотя к лантаноидам он не относится.
|
* |
La |
Ce |
Pr |
Nd |
Pm |
Sm |
Eu |
Gd |
Tb |
Dy |
Ho |
Er |
Tm |
Yb |
Lu |
Ланта́н — химический элемент побочной подгруппы третьей группы шестого периода периодической системы химических элементов Д. И. Менделеева, с атомным номером 57, атомная масса 138,9055[1]. Обозначается символом La (лат. Lanthanum). Простое вещество лантан (CAS-номер: 7439-91-0) — блестящий металл серебристо-белого цвета, относится к редкоземельным элементам[1].
-
актиноиды (физические свойства изучены не у всех элементов) + актиний,
Актино́иды (актини́ды) — семейство, состоящее из 14 радиоактивных химических элементов III группы 7-го периода периодической системы с атомными номерами 90—103.
Данная группа состоит из тория, протактиния, урана, нептуния, плутония, америция, кюрия, берклия, калифорния, эйнштейния, фермия, менделевия, нобелия и лоуренсия. Актиний часто для удобства сравнения рассматривается вместе с этими элементами, однако к актиноидам он не относится[1]. Термин «актиноиды» был предложен Виктором Гольдшмидтом в 1937 году[2].
|
** |
Ac |
Th |
Pa |
U |
Np |
Pu |
Am |
Cm |
Bk |
Cf |
Es |
Fm |
Md |
No |
Lr |
Акти́ний — химический элемент с атомным номером 89, обозначается в периодической системе элементов символом Ac (лат. Actinium).
Методы получения
-
Ацетилен получаем действием воды на карбид кальция. Атомы водорода в молекуле ацетилена обладают большой подвижностью. Поэтому они легко могут быть замещены металлами. Пропустим через аммиачный раствор хлорида меди (I) ацетилен. Выпадает красный осадок ацетиленида меди (I) .СН СН + 2CuCI CuC CCu + 2HCIОборудование: колба Вюрца, делительная воронка, газоотводная трубка, стакан или пробирка, полипропиленовая воронка, фильтровальная бумага, штатив. Техника безопасности. Соблюдать правила работы с горючими газами. Получать только небольшие количества ацетиленида меди. Высушеный ацетиленид меди - очень опасное взрывчатое вещество. Его уничтожают обработкой концентрированной соляной кислотой.
-
2. Алкилированием ацетилена могут быть получены многие другие алкины (гомологи ацетилена). Реакция проводится в две стадии. Вначале получают ацетиленид щелочного металла:
НС=СН + NaNH2 (или СH3-Mg-J) a НС=СNa + NH3 (или НС=С-Mg-J + СH4).
Полученные металлорганические производные ацетилена алкилируютгалоидными алкилами:
НС=СNa (или НС=С-Mg-J) + СН3-J a HC=C-CH3 + NaJ (MgJ2).
Операции можно повторить, и заместить таким образом второй атома водорода у ацетилена, но обычно получить в чистом виде моноалкилацетилены невозможно, так как получается смесь моно- и дизамещенных ацетиленов.
-
Кислотность ацетилена, его соли. Генерация ацетиленид-иона, его реакции с различными электрофилами (галогены, алкилгалогениды, эпоксиды, карбонильные соединения). Симметричное и несимметричное сочетание алкинов в присутствии солей меди. Получение дианионов алкилацетиленов как метод синтеза 1-(трет-алкил)ацетиленов. Ацетилен-алленовая перегруппировка. Пропаргильный анион и миграция тройной связи внутри молекулы ("ацетиленовая молния"). Смещение тройной связи в терминальное положение.
-
Алкилгалогениды. Методы синтеза из алканов, алкенов, алкинов, алкилгалогенидов (реакция Финкельштейна), различных типов карбонильных соединений. Реакционная способность в процессах нуклеофильного замещения и элиминирования. Получение магний- и литийорганических соединений, синтез диалкилкупратов. Реакции металлоорганических соединений с алкилгалогенидами, алкинами, эпоксидами, диоксидом углерода, различными типами карбонильных соединений. Ацетиленид меди в реакциях с арил- и винилгалогенидами.
-
Реакции карбонильных соединений с металлоорганическими соединениями; побочные процессы, протекающие при взаимодействии карбонильных соединений с реактивами Гриньяра и литийорганическими соединениями. Цинкорганические соединения как нуклеофилы (реакция Реформатского). Ацетиленид-ион как нуклеофил (реакция Фаворского-Реппе).
-
Реакции нуклеофильного замещения, катализируемые переходными металлами. Взаимодействие солей диазония с галогенидами и псевдогалогенидами меди, реакции арилиодидов с ацетиленидом меди, синтез эфиров по Ульману и пр. Реакции кросс-сочетания в ароматическом ряду. Синтез арилацетиленов (реакция Соногашира). Синтез биарилов по Ульману. Получение несимметричных биарилов и производных стирола реакцией Судзуки. Синтез производных стирола по реакции Хека.
-
