
- •Федеральное государственное образовательное учреждение
- •Химия Задания для контрольной работы Ижевск 2010
- •Задание № 1. Основные классы неорганических соединений……………………4
- •Приложения…………………………………………………………………………25
- •Задание № 2 Тема: «Строение атома»
- •Задание № 3 Тема: «Ковалентная связь»
- •Задание № 4 Тема: «Энергетика химических реакций»
- •Задание № 5 Тема: «Кинетика химических реакций»
- •Задание № 6 Тема: «Способы выражения концентраций»
- •Задание № 7 Тема: «Растворы неэлектролитов»
- •Задание № 8 Тема: «Растворы электролитов»
- •Задание № 9 Тема: «Гидролиз солей»
- •Задание № 10 Тема: «Окислительно-восстановительные реакции»
- •Задание № 11 Тема: «Электрохимия. Гальванические элементы»
- •Задание № 12 Тема: «Электрохимия. Электролиз»
- •Задание № 13 Тема: «Электрохимия. Коррозия металлов»
- •Задание № 14 Тема: «Свойства металлов»
- •Приложения
- •Окончание таблицы 1
- •Электродные потенциалы металлов в различных средах
- •Перенапряжение выделения водорода и ионизации кислорода на разных электродах
- •Вопросы для подготовки к экзамену
- •Вариант №1
- •4. Реакция восстановления оксида меди (II) алюминием возможна
- •5. При взаимодействии 1 моль ортофосфорной кислоты с 1 моль гидроксидом натрия образуется:
- •6. Метилоранж становится желтым при растворении в воде каждой из двух солей:
- •7. При взаимодействии водных растворов солей сульфата алюминия и карбоната натрия, сумма коэффициентов в кратком ионном уравнении равна:
- •13.При электролизе раствора сульфата цинка с графитовым анодом и катодом на катоде выделится:
- •32.Дополните
- •41. С уменьшением концентрации соли степень диссоциации
- •76. Виды коррозии: Примеры:
- •77. Для защиты металла от коррозии
- •78. Вид коррозионных процессов: При контакте фаз:
- •79. Алюминий склёпан медью
- •Список литературы
- •Учебное издание
13.При электролизе раствора сульфата цинка с графитовым анодом и катодом на катоде выделится:
|
1) цинк 2) водород |
3) кислород 4) цинк и водород |
14. Рассмотрите электролиз раствора нитрата серебра, если:
а) графитовые электроды
б) серебряный анод
15. Протектором для железа может быть:
1) хром;
2) олово;
3) серебро;
4) золото.
16. Условно - графическая схема Г.Э. … в кислой среде, химизм процессов на электродах …
17. В системе при рН < 7
а )
если коррозирует железо:Cr
Pb
)
если коррозирует железо:Cr
Pb
1) Fe – A
2) Cr – K Fe
3) Pb – A
4) Pb – K
б) Г.Э. имеет условно-графическую схему …
в) химизм процессов на электродах: А…
К…
Часть В
Укажите номер правильного ответа:
1. Главное квантовое число (n) характеризует:
Вращение А.О. вокруг собственной оси;
Энергию электрона (номер Э.У.);
Форму А.О. (подуровень);
Расположение А.О. в магнитных осях атома.
2. Если n = 1, то l принимает значение:
О (s), 1(p);
O (s);
O (s), 1 (p), 2 (d);
O (s), 1 (p), 2 (d,) 3 (f)/
3. После 5 s – подуровня, согласно правилу Клечковского заполняется подуровень:
4 p 3) 3 p
3 d 4) 4 d
Электронная формула 4 s23 d6 соответствует атому:
1) Mn 3) Fe
2) Co 4) Ni
Две свободные 3 d – А.О. имеет атом:
V 3) Sc
Ti 4) Fe
Атому Fe в возбужденном состоянии соответствует электронная формула:
4 s14 p1 3) 3 d54 s14 p1
3 d54 s1 4) 3 d64 s14 p1
Электронная формула иона Э2+… 4 s03 d8 соответствует атому:
Sc 3) Mn
Fe 4) Ni
Явление провала (проскока) электронов у элементов IV n. наблюдаются:
1) Zn и Mn 3) Cr и Cu
2) Co и Ni 4) V и Ti
Высшая степень окисления атома элемента с электронной формулой … 4 s23 d5 равна:
(+6) 3) (+5)
(+7) 4) (+4)
Низшая степень окисления атома азота равна:
1) (-1) 3) (-2)
2) (-3) 4) (0)
Укажите номер правильного ответа. К гомогенной реакции относится:
С + О2
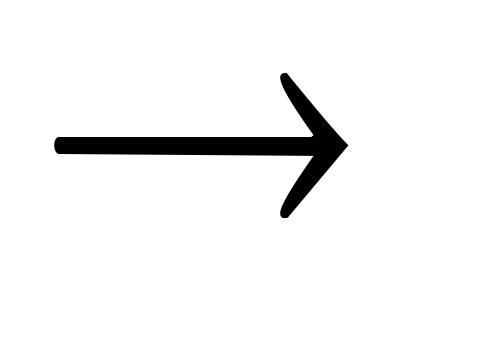 СО2
СО2S + O2
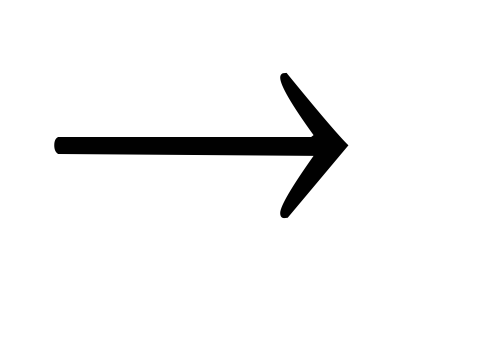 SO2
SO2N2 + O2
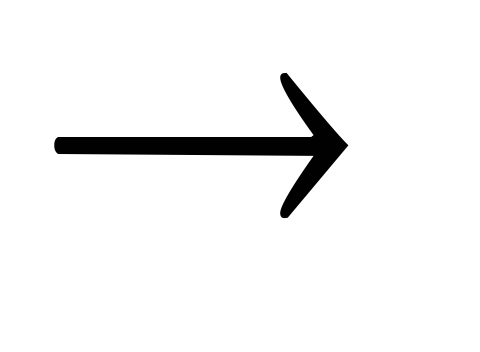 2NO
2NO2Al + 3Cl3
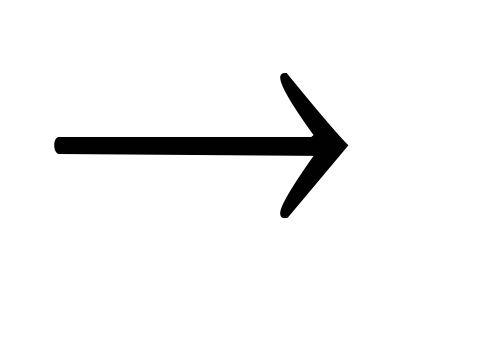 2AlCl3
2AlCl3
Дополните:
Ковалентная связь – это связь за счет … образуется между атомами элементов ….
Связь, образованная по линии, связывающей ядра атомов называется … связью, эта связь имеет особенности: 1 ………
2 ………
3 ………
Число
 связей
в молекулеSO2Cl2
равно …
связей
в молекулеSO2Cl2
равно …Укажите номер правильного ответа. Вещества с ковалентной полярной связью – это:
фтор 2) алмаз 3) кобальт 4) аммиак
Полярность ковалентной связи уменьшается в ряду:
HBr, HCl, HJ
CO2, CCL4, CF4
NH3, PH3, AsH3
ScO2, TeO2, SO2
Химическая связь в молекулах аммиака и брома соответственно:
Ковалентная полярная и ковалентная неполярная
Ионная и ковалентная полярная
Ковалентная неполярная и ковалентная полярная
Водородная и ковалентная неполярная
Математическое выражение средней скорости химической реакции mA+nB
 gC
имеет вид:
gC
имеет вид:
1)
![]() 2)
2)![]() 3)
3)![]() 4)
4)![]()
При увеличении концентрации SO2 в 4 раза скорость реакции 2SO2 + O2
 2SO3
увеличится в:
2SO3
увеличится в:
32 раза 3) 8 раз
16 раза 4) 4 раза
При повышении давления в 3 раза скорость реакции 2NO + O2
 2NO2
возрастет
в:
2NO2
возрастет
в:27 раз 3) 8 раз
9 раз 4) 6 раз
С повышением температуры (to
 )
химическое равновесие CO
+ H2O
)
химическое равновесие CO
+ H2O
 CO2
+ H2
(-
CO2
+ H2
(-
 H)
сместиться:
H)
сместиться:вправо
влево
Если повысить давление, то химическое равновесие H2 + Cl2
 2HCl
сместиться:
2HCl
сместиться:вправо
влево
равновесие не сместится
Оптимальные условия синтеза оксида серы (VI)
2SO2
+ O2
![]() 2SO3
(-
2SO3
(-![]() Hx.p.):
Hx.p.):
P
 ,
to
,
to 3)
P
3)
P ,to
,to
P
 ,to
,to 4)
P
4)
P ,
to
,
to
Математическое выражение Кр системы nA + mB
 gC
+ pD
имеет вид:
gC
+ pD
имеет вид:
1)
![]() ; 3)
; 3)![]() ;г
г
;г
г
2)
![]() ; 4)
; 4)![]() .
.
Равновесие химической реакции 4HCl + O2
 2Cl2
+ 2H2O
(-
2Cl2
+ 2H2O
(- H)
смещается в сторону продуктов при
г
г
г г
H)
смещается в сторону продуктов при
г
г
г гповышении температуры
повышении давления
наличие катализатора
понижении давления
Реакции, протекающие с выделением тепла называются …,
 Нх.р.
имеет знак ….
Нх.р.
имеет знак ….Химическая реакция не возможна, если ….
 Gх.р.
при н.у. рассчитывают по формуле …, а
при произвольных условиях: ….
Gх.р.
при н.у. рассчитывают по формуле …, а
при произвольных условиях: ….Если
 G
х.р. = 0, то в системе наступает ….
G
х.р. = 0, то в системе наступает ….Изменение энтропии системы рассчитывают по формуле:
1)
![]() Н
х.р
=
Н
х.р
=
![]() ;
;
2)
![]() ;
;
3)
![]() ;
;
4)
![]() .
.
Если
 G
х.р. <
0, то реакция ….
G
х.р. <
0, то реакция ….
Теория электролитической диссоциации
