
- •В.П. Падалка технологія виробництва чорних металів Навчально - методичний посібник
- •Технологія виробництва чорних металів Навчально - методичний посібник
- •Оглавление
- •1 Сырье и его подготовка к плавке
- •II методические указания
- •Введение
- •I.Лекционный материал
- •1.2 Классификация и виды железных и марганцевых руд
- •1.3 Флюсы для доменной плавки
- •1.4 Підготовка железной руды к плавке
- •1.4.1 Дробление руды – щековая, конусная, молотковая и валковая дробилки
- •1.4.2 Измельчение железной руды - работа шаровой мельницы
- •1.4.3 Грохочение и сортировка руды - вибрационный грохот
- •1.4.4 Обогащение руды - способы обогащения железных руд
- •2. Доменный процес
- •2.1 Общая схема и сущность доменного процесса
- •2.2 Распределение и движение газов и шихты в доменной печи
- •2.3 Восстановление оксидов металлов
- •2.4 Образование чугуна и шлака
- •2.5 Методы интенсификации доменного процесса
- •2.6 Продукты доменной плавки
- •3 Выплавка стали
- •3.1.Технология получения стали
- •3.1.1 Производство стали в конвертерах.
- •3.1.2 Производство стали в мартеновских печах
- •3.1.3 Производство стали в электропечах
- •4 Разливка стали
- •4.1 Способы разливки стали
- •4.1.1 Разливка стали в изложницы
- •4.1.2 Непрерывная разливка стали на мнлз
- •II.Методические указания
- •5.2. Cамостоятельная работа №2 Изучение технологии выплавка чугуна из железных руд
- •5.3. Самостоятельная работа №3 Получение железа и различных сортов (марок) стали
- •Основные способы производства стали
- •Техническая характеристика кислородно-конвертерного процесса
- •5.4. Cамостоятельная работа №4 Технология разливки и строение стального слитка
- •Рекомендуемая литература
5.3. Самостоятельная работа №3 Получение железа и различных сортов (марок) стали
Основные вопросы.. Принципиальная схема передела чугуна на сталь (основные этапы: окисление примесей, шлакование, рафинирование, раскисление); понятие спокойной Процесс прямого восстановления железа из руды с последующей плавкой и кипящей стали.
Основные способы получения стали (кислородно-конвертерный, мартеновский, в электропечах). Характеристика каждого из указанных способов:
исходные материалы;
- работа и устройство печи;
источники тепловой энергии;
химические особенности процесса (кислый и основной);
время плавки и технико-экономические показатели работы сталеплавильных печей; пути интенсификации мартеновской плавки, принцип работы двухваннового мартена.
Разливка стали (в изложницы сверху и снизу, непрерывная разливка); строение стального слитка спокойной и кипящей стали.
Пути повышения качества стального слитка (обработка синтетическими шлаками, вакуумная дегазация; электрошлаковый, вакуумно- дуговой, электронно-лучевой, плазменно-дуговой переплавы).
Основные способы производства стали
Сталь - сплав железа с углеродом, содержание которого в сплаве не превышает 2,14%. Сталь, основными компонентами которой являются железо и углерод, носит название углеродистой. Содержание в ней сопутствующих химических элементов (Si, Мп, S, Р) не должно превышать определенных значений (рис.5.13).
Рис.5.13.
Химический состав углеродистой
(нелегированной) стали

В отличие от углеродистой, легированная сталь обладает более высокими механическими свойствами (после термической обработки).
Легирование стали - процесс введения в ее состав химических элементов (Sі, Мп, Сг, Ni, Мо, Ті и др.) с целью придания ей определенных химических и механических свойств.
Способы производства стали представлены на рис.5.14. Основной метод получения стали - передел чугуна на сталь. Лишь незначительный процент всей получаемой стали производят, используя способ прямого восстановления железа из руды.
Рис.5.14.
Структура сталеплавильного производства
(принципиальная схема)

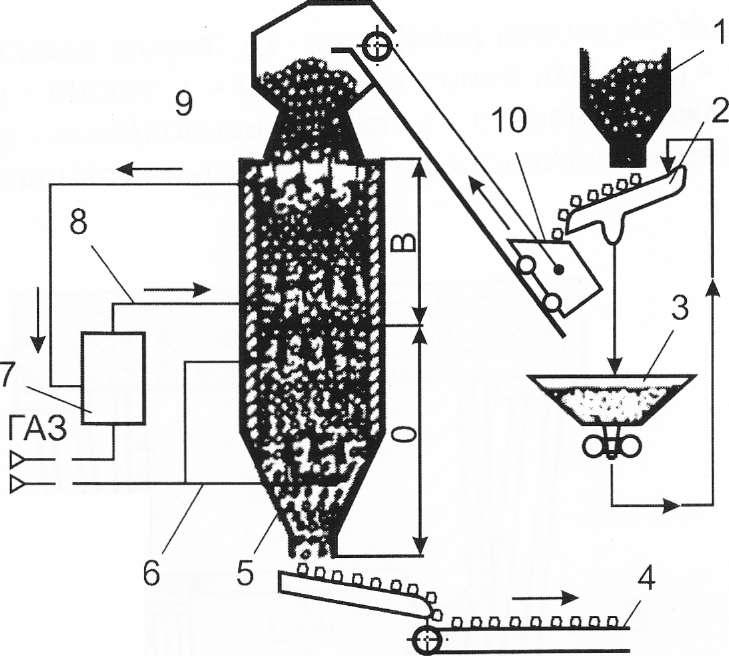
Рис.5.15. Схема установки для прямого восстановления железа из руды: 1 - бункер для окатышей; 2 - грохот; 3 - бункер для просеянной мелочи; 4 - конвейер; 5 - охлажденные окатыши; 6 - трубопровод; 7 - установка получения газов восстановителей (Н2, СО); 8 - трубопровод; 9 - шахтная печь; 10 - вагонетка.
В - восстановительная зона; 0 - зона охлаждения
В печах шахтного типа, работающих по принципу противотока, происходит восстановление железорудных окатышей до твердого губчатого железа (рис.5.15). Восстановителями являются водород и окись углерода - продукты конверсии природного и доменного газа. На рис.5.16 представлен алгоритм данного технологического процесса.

Рис. 5.16. Принципиальная схема технологического процесса производства стали методом прямого восстановления железа из руды
Принцип передела чугуна на сталь.
Состав
передельного чугуна и низкоуглеродистой
стали
Таблица
5.3
Материал
Химический
состав, %
С
Si
Мп
S
Б
Передельный
чугун
4,0-4,4
0,76-1,26
До
1,75
0,15-0,30
0,03-0,07
Сталь
низкоуглеродистая
0,14-0,22
0,12-0,3
0,4-0,65
0,05
0,055
Первый этап - это окисление примесей. Следует заметить, что источником О2 могут быть как чистый кислород, так и кислород воздуха, подаваемого в печь для сжигания топлива:
Fе+1/202=Fе0+Q; (5.5)
Si+02=Si02+ Q; (5.6)
Мп+1/2 02= Мп0+Q (5.7)
4Р+5 02=2Р205+Q; (5.8)
2С+02=2С0 +Q; (5.9)
S+02=S02 +Q. (5.10)
Элементы, обладающие большим сродством к кислороду, чем железо(Si, Мп), могут окисляться, отнимая кислород у оксидов железа, входящих в железную руду или окалину, которые добавляют в шихту:
2Fе0+Si=2Fе+SiO2+Q; (5.11)
Fе0+Мп=Мп0+Fе+Q. (5.12)
Реакции окисления - экзотермические. Выделение тепла приводит к повышению температуры расплава. В процессе протекания окислительных или окислительно - восстановительных химических реакций имеет место выделение газообразных веществ (СО, S02). Всплытие пузырьков газообразных веществ, образующихся в результате реакций окисления, вызывает «кипение» ванны расплавленного металла.
Удаление негазообразных оксидов происходит за счет процесса шлакования, общий принцип которого рассмотрен выше. Процесс идет как за счет взаимодействия оксидов с флюсом (кислым или основным), так и за счет взаимодействия образовавшихся оксидов между собой:
Si02+Са0Са0∙Si02; (5.13)
3(Fе0)+Р205(FeO)3∙ Р205. (5.14)
Процесс удаления вредных примесей серы и фосфора носит название «рафинирование». Важно отметить, что удаление серы и фосфора возможно лишь при использовании основного флюса (извести СаО). Сера в стали содержится в виде химического соединения FеS, а если сталь богата марганцем, то в виде МпS:
FеS+Са0Fе0+СаS ; (5.15)
шлак
МпS+Са0Мп0+СаS (5.16)
шлак
Удаление фосфора идет по типовой схеме взаимодействия кислого и основного оксида:
Р205+4Са04(Са0)∙( Р205) . (5.17)
шлак
Заключительным этапом любого сталеплавильного процесса является процесс раскисления. Он может происходить как в печи, так и в разливочном ковше, куда вводят раскислители либов виде ферросплавов (ферромарганиц, ферросилиций), либо в виде чистого алюминия. Цель этого этапа - восстановить окисленное на первом этапе железо. В общем виде химическую реакцию можно представить так:
Fе0+ХFе+Х0, (5.18)
где Х - элемент, обладающий большим сродством к кислороду, чем железо. В реальных сталеплавильных процессах - это Si, Мп, С, С0, А1 и др.
Процесс, протекающий по вышеприведенной схеме, носит название осаждающего раскисления. В результате данного процесса происходит восстановление железа и образование оксидов Мп0, SiO2, А1203 и др. Образующиеся малорастворимые в металле окислы легко отделяются от расплава и благодаря меньшей плотности, чем плотность жидкого металла, всплывают в шлак. Как было сказано выше, реакции, протекающие при раскислении, идут с выделением тепла.
При понижении температуры металла в изложнице (при разливке) течение реакций раскисления может продолжиться. Вновь образовавшиеся оксиды не успевают всплывать и удаляться из металла. В случае, когда требуется получить особо чистую от неметаллических включений сталь, применяют диффузионное раскисление. При данном методе раскислители подают на поверхность шлака. Восстанавливая железо из его оксидов, они тем самым понижают концентрацию Fе0 в шлаке. В соответствии с законом распределения оксиды железа переходят из металла в шлак. Процесс идет до тех пор, пока не установится равновесное распределение закиси железа в шлаке и металле, соответствующее данным внешним условиям (температура и др.). Преимуществом диффузионного раскисления является достижение высокой чистоты металла по неметаллическим включениям. Недостатком данного способа является высокий угар дорогостоящих раскислителей (вследствие их реакции с кислородом атмосферы печи). По этой причине метод диффузионного раскисления применяется реже.
Раскисление синтетическими шлаками по своему физико- химическому принципу схож с диффузионным. В ковш, на дне которого находится расплав шлака, не содержащего Ре0, с большой высоты заливают раскисляемую сталь. Струя металла дробится на капли, контакт металла со шлаками возрастает. Благодаря этому процесс раскисления идет с большой скоростью. При этом сталь не только раскисляется, но и снижается содержание в ней серы и фосфора, а также других неметаллических включений.
Сталеплавительное производство включает в себя конвертерный, мартеновский способы получения стали и плавку в электропечах.
В середине XIX века английский изобретатель Генри Бессимер предложил способ получения стали путем продувки жидкого чугуна в конвертере с кислой футеровкой.
Позднее Сидней Томас предложил вести процесс в конвертерах с основной футеровкой, что позволило получать сталь из жидких чугунов, содержащих большое количество фосфора. Способ, предложенный французским металлургом Пьером Мартеном (мартеновский), позволил использовать для плавки твердые шихтовые материалы (руду, лом, отходы машиностроительного производства). Разработка в середине ХХ века кислородно-конвекторного способа позволила получать сталь, не уступающую по качеству мартеновской. Применение электрической энергии в качестве источника тепла для плавки стали позволяет получать высокие температуры (до 35000С), которые при сжигании обычных видов металлургического топлива, получить не представляется возможным .
В настоящем методическом руководстве представлены лишь основные технологические параметры вышеуказанных процессов (табл.5.4-5.6, рис. 5.17-5.23).
Техническая
характеристика мартеновского процесса
Таблица
5.4
Исходные
шихтовые
Источник
нагрева
Время
плавки,
ч
Емкость
печи,
т
Произво
дитель
ность,
т/ч
Произво
димые
стали
материалы
(топливо)
Жидкий
Газооб-
чугун,
разное
100-150
Углеро
чушковый
(природ-
6-9
200-900
(10т/м2сут)
дистые
и
чугун,
сталь-
ный
газ),
легиро-
ной
лом
жидкое
ванные
(скрап),
(мазут)
стали
флюс
Рис.5.17.
Разновидности мартеновского
сталеплавильного процесса
Воздух


Рис.5.18.
Схема устройства
мартеновской
(пламенной регенеративной) печи: 1 -
регенератор; 2 - зона смешения топлива
с воздухом; 3 - кислородная фурма; 4 -
загрузочные окна; 5 - передняя стенка;
6 - шихта; 7 - пламя; 8 - дымовая труба; 9 -
лётка для выпуска стали; 10 - задняя
стенка; 11 - свод печи; 12 - подина

Недостатком мартеновского процесса является его низкая производительность (до 150 т/ч). По этой причине в ряде стран мира данный способ снят с производства. В нашей стране способ имеет место в силу исторически сложившихся причин.
Для интенсификации процесса плавки используют следующие приёмы. В период прогрева шихты с целью повышения температуры горения топлива в факел подаётся кислород. В период «кипения ме-
талла» кислород через специальные фурмы подаётся в ванну и процесс выгорания кислорода протекает интенсивнее.
Советскими металлургами был разработан способ плавки стали в двухванновых мартенах (рис.1.20). Две ванны располагаются под единым сводом. Процессы, протекающие в левой и правой ванне, идут синхронно.
Когда в левой ванне происходит «кипение металла» кислородные фурмы опущены вниз и химическая реакция 2С+02^-200|+0 протекает интенсивнее. В это время в правой ванне идет процесс прогрева шихты, требующий большого количество теплоты. Кислород подается в печное пространство, захватывая при этом выделившуюся в левой ванне окись углерода. Химическая реакция 2С0+02^2002+0 способствует росту температуры и тем самым экономии топлива.
Рис.
5.19.
Принципиальная схема двухваннового
мартена

Кислородно-конвертерный способ производства стали
Преимуществом кислородно-конверторного способа производства стали, безусловно, является высокая производительность процесса.
Благодаря использованию основной футеровки стали, полученные этим способом, содержат минимальное количество серы и фосфора.
Кислородный конвертер (рис.5.20) представляет собой сосуд грушевидной формы, сваренный из листовой стали и выложенный внутри основным огнеупорным кирпичом.
Таблиц 5.5
