
экстракция
.docxГосударственное образовательное учреждение
высшего профессионального образования.
Сибирский государственный индустриальный университет
Институт металлургии и материаловедения
Кафедра металлургии чёрных металлов
Экстракция чёрных металлов из природного и техногенного сырья.
Методические указания к практическим занятиям по дисциплине
“Экстракция чёрных металлов из природного и техногенного сырья”
Специальность 150100 “Металлургия чёрных металлов”
Новокузнецк 2012
Введение.
Современные условия успешного ведения хозяйственной деятельности предъявляют высокие требования к качеству выпускаемой продукции. Обеспечить же высокое или хотя бы приемлемой качество продукции возможно только при использовании предварительно подготовленного сырья. Особенностью металлургического способа получения металлов и сплавов является использования высоких температур, при которых сырые материалы испытывают самые различные превращения: плавление, испарение, термическую диссоциацию, окислительно-восстановительные процессы, образование сложных соединений и др. При этом существенно меняется фазовый и химический состав систем, значит изменяются качественные показатели этих систем.
На практике процессы извлечения и подготовки природного сырья для получения готового продукта многостадийны и на каждом этапе подготовки необходимо следить за составом материалов, то есть выполнять расчёты шихты, учитывая все изменения, происходящие в процессе её подготовки к количественном и качественном отношении.
Задачи и примеры, рассматриваемые в приведённых методических указаниях, сопровождаются краткими пояснениями, необходимыми для понимания сути решаемых задач.
Влажность природного сырья.
Одним из металлургических свойств сырья является влажность. Значение влажности неоднозначно. С одной стороны, выделяют понятие “естественная влажность”, обусловленную влажностью окружающей среды (воздуха), и естественными атмосферными осадками при транспортировке руды на большие расстояния (дождь, снег). Наличие избыточной влаги чаще всего приводит к негативным последствиям. Например, в зимний период влажная руда смерзается. Смерзание может серьёзно осложнить погрузочные и разгрузочные работы из вагонов, штабелей, что может привести к нарушению ритмичности работы цехов, а значит к уменьшению эффективности производства. Повышенная влажность может вызвать разрушение кусков руды при их сушке и нагревании, что приводит к увеличению содержания мелочи, а значит к ухудшению качества руды.
Наличие влаги снижает содержание извлекаемого компонента, уменьшается и стоимость руды. Если содержание влаги отличается от установленных норм, то производят переоценку поставок за каждый лишний процент влаги, или “потерянный” процент извлекаемого компонента.
В связи с этим устанавливаются предельные значения влажности для разных руд. Например, влажность магнетитов допускается до 4%, гематитов и мартитов до 5%, бурых железняков – 6%.
С другой стороны, в состав шихтовых материалов специально добавляют воду в качестве связующего вещества. При различных способах обогащения для более полного извлечения полезного компонента рудный материал предварительно дробят и измельчают. После обогащения получают концентрат с большим содержанием извлекаемого компонента и хвосты, которые не используются. Полученный концентрат в виде мелкого порошка использовать непосредственно в металлургических агрегатах невозможно, так как из-за наличия мелких фракций резко ухудшается газопроницаемость слоя шихты, возрастает улёт мелких фракций восходящим потоком печных газов, увеличивается запыленность окружающей среды. Необходимо увеличивать размер фракций, для чего выполняют процессы укрупнения концентрата - окускование. Окускование осуществляется путём брикетирования, окомкования и агломерации. Во всех этих случаях в концентрат добавляют специальные необходимые вещества, в том числе и воду, как достаточно хорошее связующее вещество. Свежеприготовленные брикеты или окатыши обладают малой прочностью, легко разрушаются, поэтому подвергаются сушке и обжигу. При этом происходит удаление влаги, другие процессы, в результате которых состав шихты изменяется.
Пример 1. При транспортировании руды, состав которой указан в таблице 1, в открытых вагонах по акту приёмки влажность её составляет 5%. Каков химический состав партии руды по прибытии на конечный пункт назначения?
Таблица 1. Химический состав железной руды.
|
Компонент |
Fe2О3 |
Р2О5 |
SiO2 |
Al2O3 |
CaO |
MgO |
S |
∑ 100 |
|
Содержание, % месс |
83,0 |
0,16 |
9,60 |
1,30 |
5,05 |
0,85 |
0,04 |
Решение. При решении задач, связанных с расчетами химического состава сначала проверяют условие, что бы сумма содержаний всех заданных компонентов была равна 100%. В противном случае производят корректировку заданного состава руды. В данном случае эта сумма составляет 100%.
Сведений о первоначальной влажности нет руда-сухая. После транспортировки влажность стала 5%.
Расчеты удобно вести исходя из общей массы руды 100г. Тогда 1% будет соответствовать 1г. В данном примере общая масса руды состоит 100г-сухой и 105г влажной, т.е. 105% от первоначальной.
Значит,
содержание Fe2O3
станет
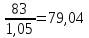 ,
т.е.
уменьшится
,
т.е.
уменьшится
Аналогично,
содержание P2O5
составит
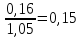 ,
и
т.д.
,
и
т.д.
Вновь рассчитанное содержание компонентов во влажной руде приведено в таблице 2.
Таблица 2-состав железной руды при влажности 5%
|
Компонент |
Fe2О3 |
Р2О5 |
SiO2 |
Al2O3 |
CaO |
MgO |
S |
∑
|
|
Содержание, % месс |
79,04 |
0,15 |
9,11 |
1,22 |
4,76 |
0,81 |
0,038 |
Пример 2. При приготовлении окатышей шихтовая смесь была составлена из следующих материалов:
-рудный концентрат-80г.
-тонкоизмельченная руда-15г.
-известняк-10г.
-вода-8г.
-связующее вещество (жидкое стекло)-1,5г.
Полученные окатыши предварительно сушили, а затем прокаливали при т-ре 160о С. Как измениться содержание железа, если рудный концентрат представлен магнетиком Fe2O3, а руда - гематитом Fe2O3?
Решение. Определяем общую массу компонентов шихты
m=80+15+10+8+1,5=114,5г.
Определяем процентное отношение каждого компонента
до
прокаливания:

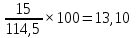
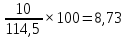
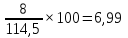 и
и
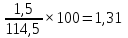 процентов
соответственно.
процентов
соответственно.
Проверим правильность вычислений.
∑%mмасс=69,87+13,10+8,73+6,99+1,31=100%
При нагревании и выдержки при 160оС происходит удаление гигроскопической влаги (физической). Общая масса шихтовых материалов уменьшится за счет потери влаги, до 114,5-8=106,5г.
Рассмотрим содержание железа до и после сушки. Массу железа в гематите определим из пропорции
1моль Fe2O3 содержит 2г атома Fe, т.е.
2×56+3×16=160г 2×56=112г
Рассчитаем процентный состав шихтовой смеси после сушки:
Концентрат
mk,%=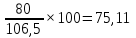
Руда
mр,%=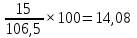
Известняк
mи,%=
Связующее
mсв,%=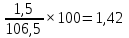 ; ∑100%
; ∑100%
Рассчитаем содержание железа в шихте до и после прокаливания. Массу железа в концентрате (Fe3O4) определим из пропорции
1г-моль Fe3O4 содержит 3г-атома Fe,
т.е.3×56+4×16=232г Fe3O4 содержит 3×56=168гFe,
Тогда 69,87г содержит Хг Fe
Из
пропорции Хг Fe= =50,6г
=50,6г
Так же рассчитаем содержание железа в соединении Fe2O3:
1г-моль Fe2O3 содержит 2г-моль Fe
2×56+3×16=160г – 112г Fe
13,10
- Х1г
Fe=
Всего железа в 114,5г смеси до прокаливания составляет:
Хг+Х1г=50,6+9,13=59,73г
Fe
или
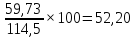
Аналогично рассчитываем содержание железа после сушки и прокаливания-магнетита
-количество железа после прокаливания: магнетита
1г-моль Fe3O4- 3г-атома Fe
232г-168г
х’=
75,11-х
-количество железа после прокаливания гематита
1г-моль Fe2O3 – 2г-атома Fe
160
- 112 x=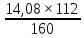 =9,86г
Fe
=9,86г
Fe
14,08 – x
Всего железа после прокаливания
Х’г+х=54,39+9,86=64,25г
Fe
или
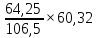
Таким образом, относительное содержание железа в шихтовой смеси для получения окатышей увеличилось на
60,32-52,20=8,12%
Расчеты состава шихтовых смесей при нагревании до высоких температур.
При нагревании для обжига и агломерации предварительно окомкованных шихтовых материалов в них происходят различные физико-химические превращения.
При температуре 120-160о С испаряется физическая влага шихты. При более высоких температурах начинаются процессы дегидратации гидроксидов железа, при которой происходит удаление кристаллизационной влаги(Fe2O3×nH2O), более сильно связанной с оксидом железа, чем влага гигроскопическая. Это наблюдается при температурах 700-800о С и даже 900о С. В области таких же температур начинают диссоциировать карбонаты FeCO3, MnCO3, CaCO3 и др. (около 1000о С). При 1200-1400о С разлагаются гипс (CaSO4) и барий (BaSO4).
Кроме реакций разложения происходят и процессы образования сложных соединений, играющих важную роль при формировании структуры обожженного материала. При температурах около 1000о С в шихтовой смеси образуется соединение 2FeO×SiO2, которое называют файялит. Особенностью его является низкая температура плавления -1205о С. Если в шихте присутствует CaO, то возможно образование ферритов кальция и других легкоплавких соединений. Например, CaO×2Fe2O3 плавится при температуре 1230о С, Ca-оливин (железокальциевый оливин (CaO)х×(FeO)2х×SiO2 имеет температуру плавления 1130о С).
Топливом во всех этих процессах является углерод в виде кокса, добавляемого в шихту. При его горении развиваются высоки (до 1500о С) температуры.
C+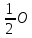 2=CO;
C+O2=CO2;
CO2+C=2CO.
2=CO;
C+O2=CO2;
CO2+C=2CO.
В то же время, углерод и его производное (CO) является восстановителем для многих оксидов
Hапример, оксиды железа восстанавливаются по реакциям
3Fe2O3+CO=2Fe3O4+CO2,
Fe3O4+CO2=3FeO+CO2,
Fe3O4+C=3FeO+CO.
Кроме этого происходит частичное удаление разных вредных примесей серы, цинка, мышьяка и др.
В результате всех этих процессов состав шихтовых смесей значительно изменяется.
Необходимость обогащения больших количеств руд, обладающих слабыми магнитными свойствами, таких как гематит-мартитовых, бурых железняков, сидеритов заставила искать пути обогащения их наиболее производительным и эффективным магнитным способом. Появился процесс, имеющий целью перевод слабомагнитных руд в магнитные, т.е. восстановление оксида железа Fe2O3 в магнитный оксид Fe3O4-магнетит. Этот, так называющий магнетизирующий обжиг, осуществляется в восстановительной среде.
Пример. Рассмотрим, как измениться состав руды, приведенный в таблице при её магнетизирующем обжиге. Будем считать, что вся руда Fe2O3 перейдет в магнетит Fe3O4. Остальные компоненты останутся без изменения.
Таблица 3. Состав исходной руды:
|
Компонент |
Fe2О3 |
CaO |
SiO2 |
Al2O3 |
P2O3 |
MgO |
S |
∑ 100 |
|
Содержание, % месс |
81,0 |
5,55 |
10,10 |
1,80 |
0,16 |
1,35 |
0,04 |
Решение. Реакцию восстановления Fe2O3 в Fe3O4 можно записать:
3Fe2O3+CO=2Fe3O4+CO2↑.
Образующийся при восстановлении диоксид CO2 уйдет из реакционной зоны в газовую фазу, а общая масса уменьшиться на массу ушедшего CO2. Учтем, что каждые три моля Fe2O3 дадут 2 моля Fe3O4, т.е. можно составить пропорцию
3(2×56+3×16) – 2(3×56+4×16)
3×160г - 2×232г
\
Примем массу руды 100г., тогда содержание Fe2O3 в этих 100г. Будет ровно 81г и пропорция будет следующей 480г Fe2O3 – 464г Fe3O4
81г – Хг
Отсюда
Х= =78,3г
=78,3г
Количество образовавшийся Fe3O4 составило 78,3г, масса руды уменьшилась на 81-78,3=2,7г, т.е. стала равной 100г-2,7г=97,3г
Массы остальных компонентов не изменились, но относительное (процентное) содержание их увеличилось и составило,
например,
%Fe3O4= ;
;
%CaO= и т.д.
и т.д.
Новый состав после магнетизирующего обжига приведен в таблице.
Таблица 4. Состав руды после обжига:
|
Компонент |
Fe2О3 |
CaO |
SiO2 |
Al2O3 |
P2O3 |
MgO |
S |
∑ 100% |
|
Содержание, % месс |
78,30 |
5,70 |
10,38 |
1,85 |
0,164 |
1,39 |
0,041 |
Оценим, как изменилось содержание железа до и после обжига.
3г-моля Fe2O3 содержит 3×112г=336г Fe
2г-моля Fe3O4 содержит 2×168=336г Fe
Содержание железа не изменилось, но за счет более полного извлечения железа в концентрат получим более обогащенный материал после обжига.
Содержание железа не изменилось, но изменился состав соединения, в котором оно находится. Гематит Fe2O3 не обладает магнитными свойствами, а магнетит магнитен и его можно отмагнитить от общей массы смеси и получить более богатый железом концентрат.
Примерю В качестве железосодержащих материалов в шихтовую смесь для получения окатышей взяты концентрат 50% и железная руда 30%. Составы их приведены в таблице 5.
Таблица 5. Состав железосодержащих материалов
|
Компонент |
Fe |
Fe3O4 |
CaO |
MgO |
SiO2 |
FeO |
Al2O3 |
S |
P |
|
Магнитный концентрат |
65,5 |
|
0,10 |
0,40 |
7,30 |
24,13 |
0,20 |
0,07 |
0,01 |
|
Магнитная руда |
47,0 |
|
6,40 |
3,00 |
14,90 |
|
4,30 |
2,07 |
0,10 |
Кроме того, в шихту добавили 10% известняка (CaCO3)-10%, для увеличения пластичности - жидкого стекла 1,5%. Влажность шихтовой смеси по данным химического анализа составила 8,5%.
Определить состав сырой шихтовой смеси, а также состав смеси после её обжига.
Решение. Сначала рассчитаем состав исходной сырой шихтовой смеси. Расчет ведем на 100г общей массы.
50% концентрата (50г) внесут:
Железа 65,5г×0,5=32,75г
Оксид кальция 0,10×0,5=0,05
И магния 0,40×0,5=0,20г и т.д.
30% железной руды внесут:
Железа 47г×0,3=14,10г
Оксид кальция 6,40×0,3=19,20г
Кремнезема 14,90×0,3=4,47г и т.д.
При расчетах шихты следует учитывать следующую особенность. Химическим анализом в лабораториях содержание оксидов железа обычно не определяют, а указывают общее содержание железа, либо общее содержание железа и содержание одного из оксидов, например Fe (или Fe3O4, или Fe2O3). Фактически в концентратах и в рудах железа находится в виде оксидов, поэтому при расчетах шихтовых смесей данные химического анализа (общее содержание железа) нужно пересчитывать на содержание оксидов железа.
В данном примере содержание железа вносимого концентратом составляет 32,75г. Часть этого железа находится в виде оксида FeO. Определим сколько железа связано с кислородом в виде FeO. Для этого составим пропорцию:
1г-моль FeO содержит 1г-моль Fe, т.е.
72г FeO содержит 56г Fe
24,13×0,5 содержит Хг Fe
Х=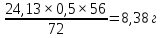 Fe
Fe
Будем считать, что остальное железо будет находиться в виде магнетита Fe3O4. Составляем аналогичную пропорцию и определяем содержание магнетита в 50г концентрата:
1г-моль Fe3O4 содержит 3г-моль Fe, т.е.
232г Fe3O4 содержит 168г Fe
Х содержит 65,5×0,5-8,38=24,37г Fe
Отсюда
Х=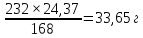 Fe3O4
Fe3O4
