
- •Кубанский государственный технологический университет Новороссийский Политехнический институт
- •«Поверхностные явления и дисперсные системы» Новороссийск
- •Общие методические указания
- •Список литератуРы
- •ТермодинамиКа и строение поверхностного слоя
- •1.1 Геометрические параметры поверхности зАдание № 1
- •ЗАдание № 2
- •Указания к выполнению заданий № 1 и 2
- •ЗАдание № 3
- •ЗАдание № 4
- •ЗАдание № 5
- •Указания к выполнению заданий № 3-5
- •При постоянных температуре и давлении поверхностная энергия Гиббса определяется произведением поверхностного натяжения (фактор интенсивности) на площадь поверхности (фактор емкости) s:
- •Вводя так называемую капиллярную постоянную а,
- •Предлагаемое в задании 4 поверхностное натяжение вещества а определяют исходя из уравнений (2) и ( 3).
- •ЗАдание № 6
- •ЗАдание № 7
- •ЗАдание № 8
- •Основные понятия
- •Указания к выполнению заданий № 6-8.
- •ЗАдание № 9
- •Указания к выполнению заданий № 9.
- •Решение. По формулам (5) и (6) рассчитывают -потенциал без учета и с учетом поверхностной проводимости. Результаты расчета записывают в таблице 13.
- •ЗАдание № 10
- •ЗАдание № 11
- •Указания к выполнению заданий № 10-11.
- •ЗАдание № 12
- •Указания к выполнению заданий № 12.
- •Задание 2. Тема: Адсорбция
- •Задание 4. Тема: Коагуляция и стабилизация дисперсных систем
- •Задание 5.Тема: Структурообразование в коллоидных системах
- •Задание 6. Тема: Свойства отдельных классов дисперсных систем
Указания к выполнению заданий № 6-8.
См. [1, стр. 81-153]; [2, стр. 32-44]; [3, стр. 37-68]; [4, стр. 51-81]; [5, стр. 319-322]; [6, стр. 27-57].
Величина адсорбции зависит от природы поверхности адсорбента, природы адсорбата и его концентрации (давления), температуры и др. графическая зависимость адсорбции от концентрации адсорбируемого вещества в объемной фазе при данной температуре называется изотермой адсорбции.
Адсорбция из предельно разбавленных растворов или смесей газов подчиняется закону Генри:
А = КГ . С или А = КГ . Р, (1)
где КГиКГ константа Генри;
Сконцентрация адсорбата в объемной фазе;
Рдавление пара адсорбата.
Аналитическим выражением изотермы мономолекулярной адсорбции при более высоких концентрациях и ровной поверхности является уравнение изотермы Ленгмюра:
![]() или
или
![]() , (2)
, (2)
где КиК константы адсорбционного равновесия, характеризующие энергию адсорбции;
А предельная мономолекулярная адсорбцияемкость монослоя, А = /NА;
число молекул на 1 м2 адсорбированного слоя при максимальной упаковке;
NА число Авогадро.
А
А
Рисунок
1 – изотерма
адсорбции Ленгмюра для уравнений типа
(2)




С(Р)
Константы А и К можно найти графически преобразовав уравнение (2), получим:
![]() ,
,
![]() (3)
(3)
или
![]() (4)
(4)
![]()


![]()


![]()
![]()


C 1/C
Рисунок 2 – Изотерма адсорбции в координатах линейной формы уравнения Ленгмюра.
1/A. К для уравнения (3) или 1/A для уравнения (4) находят как тангенс угла наклона прямой к оси С или 1/C, соответственно (как отношение стороны противолежащей к стороне прилежащей, см. пояснения к контрольным заданиям по физической хиии).
Если адсорбируется газ, то уравнение (3) может принимать вид:
![]() (5)
(5)
или
![]() (6)
(6)
где v объем адсорбированного газа;
vm объем адсорбированного газа, полностью, покрывающего поверхность 1 г адсорбента.
Если принять экспоненциальное распределение неоднородностей поверхности, то как показал Я. Б. Зельдович, в области средних заполнений получается ранее найденное эмпирически уравнение Фрейндлиха:
A = K. P1/n , (7)
где K и n постоянные.
Уравнение Фрейндлиха широко используется при обработке экспериментальных адсорбционных данных и инженерных расчетах, чаще оно применяется в логарифмической форме:
ln A = ln K + (1/n). ln P, (8)
позволяющей построить линейную зависимость ln A - ln P и графически определить оба параметра K и n. вместо А иногда пишут x/m, где х количество адсорбированного вещества; m масса адсорбента. Для растворов уравнения (7) и (8) принимают вид:
x/m = K. Cn (9)
или ln(x/m) = ln K + n ln C. (10)
график для уравнения (10) принимает вид, аналогичный приведенному на рисунке 2.
Предполагая многослойную адсорбцию, Брунауэр, Эммет и Теллер вывели уравнение изотермы адсорбции (БЭТ):
![]() ,
(11)
,
(11)
где v общий объем адсорбированного газа;
vmобъем адсорбированного газа, если вся поверхность адсорбента покрыта сплошным мономолекулярным слоем;
Рравновесное давление адсорбированного газа;
Рдавление насыщенного пара;
С константа при данной температуре.
Согласно уравнению (11) зависимость
![]() от
от![]() на графике дает прямую линию с тангенсом
угла наклона
на графике дает прямую линию с тангенсом
угла наклона![]() .
.
При выполнении задания № 8 можно воспользоваться примером решения аналогичной задачи.
Пример. Рассчитать удельную поверхность адсорбента по изотерме адсорбции бензола на его поверхности. Площадь, занимаемая молекулой бензола,S0= 49.10-20м2.
|
Р/PS |
0,024 |
0,08 |
0,14 |
0,20 |
0,27 |
0,35 |
0,46 |
|
A.103, моль/кг |
14,9 |
34,8 |
47,2 |
56,8 |
66,3 |
79,3 |
101,0 |
Решение. Проверяют применимость к экспериментальным данным теории БЭТ. С этой целью рассчитывают абсциссу и ординату уравнения изотермы адсорбции БЭТ в линейной форме, т. е.
![]() иx=P/PS.
иx=P/PS.
Результаты вычислений сводят в таблицу 9 и строят график зависимости y = f(x) (рисунок 3).
Таблица 9. Данные для проверки теории БЭТ
|
Р/PS |
0,024 |
0,08 |
0,14 |
0,20 |
0,27 |
0,35 |
0,46 |
|
y, кг/моль |
1,650 |
2,499 |
3,449 |
4,400 |
5,466 |
6,790 |
8,434 |
Для определения адсорбционной емкости монослоя А по графику зависимостиy = f(x)находят константы уравнения прямой линии: отрезок, отсекаемый на оси ординат приР/PS = 0,b0=1,24 кг/моль, и угловой коэффициент прямойb1 = 15,8 кг/моль. Для сравнения вычисляютb0 иb1, пользуясь методом наименьших квадратов. Данные для расчетаb0 иb1 приведены в табл. 10.
Константы b0 иb1 рассчитывают по формулам (12) и (13):
 (12)
(12)
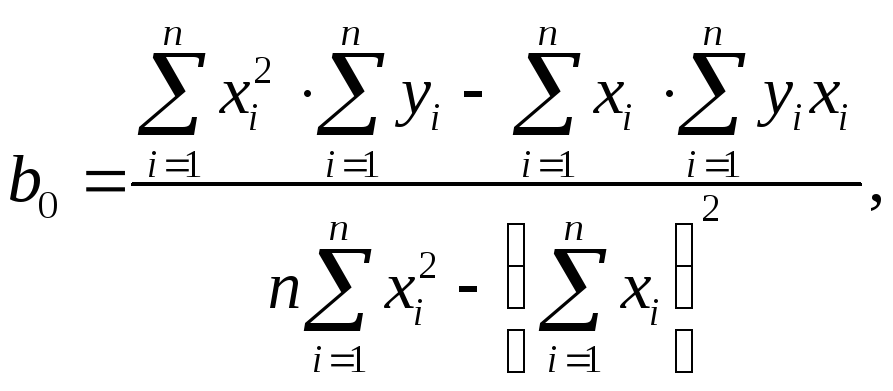 (13)
(13)
![]()
![]()

![]()

![]()
 P/PS
P/PS
Рисунок 3 – Изотерма адсорбции в координатах линейной формы уравнения БЭТ (14).
![]() (14)
(14)
Таблица 10 – Данные для вычисления констант b0 иb1.
|
n |
x |
y, кг/моль |
xy, кг/моль |
x2 |
|
1 |
0,024 |
1,650 |
0,0396 |
5,76.10-4 |
|
2 |
0,080 |
2,499 |
0,2000 |
6,4.10-3 |
|
3 |
0,140 |
3,449 |
0,4830 |
1,96.10-2 |
|
4 |
0,200 |
4,400 |
0,8800 |
4,00.10-2 |
|
5 |
0,270 |
5,456 |
1,4550 |
7,08.10-2 |
|
6 |
0,350 |
6,790 |
2,3765 |
0,123 |
|
7 |
0,460 |
8,434 |
3,8778 |
0,212 |
Решая систему уравнений
( AK)-1
= b0,
AK)-1
= b0,
(k-1) (AK)-1 = b1,
находят K = 13,65 иA = 0,0489 моль/кг.
По величине A, рассчитывают удельную поверхность адсорбента:
S = S0 ANA = 49 . 10-20.0,0489. 6,02.1023 = 14,4.103 м2/кг.
3 образование и строение двойного электрического слоя. электрокинетические явления в дисперсных системах
