
- •2. Теплоемкость газа.
- •4. Первый закон тд
- •5. Понятие об энтропии т-s диаграмма.
- •6. Понятие об энтальпии
- •7. Изохорный процесс и его изображение
- •8. Изобарный процесс
- •9. Изотермический процесс
- •10. Адиабатный процесс
- •14. Уравнение Ван-Дер-Ваальса для реального газа.
- •11. Политропный процесс
- •12. Расскажите процесс парообразования, пользуясь pv диаграммой.
- •13. Цикл Карно.
- •16. Дросселирование пара
- •18. Принципиальная схема паротурбинной установки. Цикл Ренкина
- •19. Термический кпд цикла Ренкина.
- •20. Теплофикационный цикл
- •22. Регенеративный цикл паротурбинной установки.
- •24. Конвективный теплообмен.
- •25. Критериальные уравнения.
- •26. Лучистый теплообмен.
- •27. Теплопередача через плоскую стенку. Однослойная плоская стенка.
- •Многослойная плоская стенка.
- •40. Принцип действия пс
- •41. Материалы используемые в печестроении
- •43. Тепловой расчет пс
- •44. Электрический расчет пс
- •51.Индукционные канальные печи
- •52. Индукционные тигельные печи.
- •53. Схема питания индукционных тигельных печей.
- •54. Индукционные нагревательные установки.
- •55.Установки диэлектрического нагрева.
- •56. Устройство и принцип действия дсп
- •57. Электрооборудование дсп
- •58. Электромагнитное перемешивание металла в дуговых эп
- •59. Эл. Хар-ки дуговой эп
- •60. Автоматическое регулирование мощности дуговой печи
- •63. Сварочные многопостовые агрегаты.
- •64. Однопостовые сварочные генераторы пост. Тока
- •65. Сварочные агрегаты переменного тока
- •67. Электроконтактная сварка
- •68. Нанесение гальванопокрытий
- •70. Анодно-механическая обработка
- •72. Электроискровая обработка металлов
- •73. Электроимпульсная сварка
2. Теплоемкость газа.
Для того чтобы повысить температуру любого вещества, необходимо подвести определенное количество теплоты. Выражение истинной теплоемкости:
C = dq / dt,
Где dq- элементарное количество теплоты.
dt – соответствующие изменения температуры вещества в данном процессе.
Выражение показывает удельную теплоемкость, то есть количество теплоты необходимое подвести единице количества вещества для нагревания его на 1 К (или 1 С). Различают массовую теплоёмкость (С) отнесенную к 1 кг. Вещества, необходимую (С’) отнесенную к 1 м3 вещества и киломольную (С) отнесенную к 1 кмолю.
Удельная теплоемкость – это отношение теплоемкость тела к его массе:
C = C / M = dq / dt; C` = C / V0 - объемная
3. Изобарная и изохорная теплоемкость.
Процессы с подводом теплоты при постоянном давлении называется изобарными, а с подводом теплоты при постоянном объеме – изохорным.
При теплотехнических расчетах в зависимости от процессов теплоемкости получают соответствующие названия:
Сv- изохорная теплоемкость,
Ср- изобарная теплоемкость.
Теплоемкость при изобарном процессе (p=const)
Cp =dqP / dt;
При изохорном процессе: Cν =dqν / dt;
Уравнение Майера: Ср - Сv = R
- показывает связь между изобарным и изохорным процессами.
В процессах V=const работа не совершается а полностью расходуется на изменение внутренней энергии dq=dU , при изобарном подворье теплоты имеет месть увеличение внутренней энергии и совершение работы против внешних сил, поэтому изобарная теплоемкость Ср всегда больше изохорной на величину газовой постоянной R.
4. Первый закон тд
Первый закон термодинамики является частным случаем общего закона сохранения энергии: «Энергия не создается из ничего и не исчезает бесследно, а превращается из одной формы в другую в строго определенных количествах» (Ломоносов).
В результате подвода теплоты тело нагревается (dt0) и увеличивается его объем, поэтому увеличение объема связано с наличием внешней работы:
dq = dU + dt или Q=U+ L
Где Q- общее количество тепла, приведенного к системе.
U- изменение внутренней энергии.
L-работа, направленная на изменение объема термодинамической системы.
Теплота, сообщаемая термодинамической системе идет на увеличение внутренней энергии и на совершение внешней работы.
Первый закон:
«невозможно создать машину производящую работу без того чтобы эквивалентное количество энергии другого вида не исчезала» (Вечный двигатель первого рода)
5. Понятие об энтропии т-s диаграмма.
Название энтропия происходит от греческого слова «энтропос»- что означает превращение, обозначается буквой S, измеряется Дж/К, а удельная энтропия Дж/кгК. В технической термодинамике является функцией, которая характеризует состояние рабочего тела, следовательно является функцией состояния: dS = dq / T,
Где dq/T- полный дифференциал некоторой функции состояния.
Формула применима для определения изменения энтропии, как идеальных газов, так и реальных может быть представлен в виде зависимости от параметров: dq = dS ∙T
Это означает, что элементарное количество подведенной (отведенной) удельной теплоты в равновесных процессах равно произведению термодинамической температуры на изменение удельной энтропии.
Понятие энтропии позволяет ввести чрезвычайно удобную для термодинамических расчетов TS - диаграмму, на которой, как и на PV- диаграмме состояние термодинамической системы изображается точкой, а равновесный термодинамический процесс линией
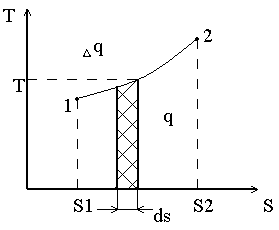 q
- Элементарное количество теплоты.
q
- Элементарное количество теплоты.
![]() ;
;
Очевидно, что в TS-диаграмме элементарная теплота процесса изображается элементарной площадкой с высотой Т и основанием dS, а площадь, ограниченная линиями процесса, крайними ординатами и осью абсцисс, эквивалентна теплоте процесса.
Если q0, то dS0 Если q0, то dS0 (отвод теплоты).
