- •Предисловие
- •Введение
- •1 Предмет курса "поверхностные явления
- •2 Классификация поверхностных явлений
- •3 Дисперсность, удельная поверхность
- •4 Классификация дисперсных систем
- •4.1 Классификация дисперсных систем по размерам частиц дисперсной фазы
- •4. 2 Классификация по агрегатному состоянию дисперсной фазы и дисперсионной среды
- •4.3 Классификация по интенсивности взаимодействия дисперсной фазы и дисперсионной среды
- •4.4 Классификация по интенсивности взаимодействия
- •5 Поверхностные явления на границе раздела фаз
- •5.1 Поверхностная энергия, поверхностное натяжение
- •5.2 Термодинамика поверхности раздела фаз
- •5.3 Пути понижения энергии Гиббса на границе раздела фаз
- •5.4 Когезия. Работа когезии
- •5.5 Адгезия, работа адгезии, термодинамические основы адгезии
- •5.6 Смачивание, краевой угол смачивания, теплота смачивания, гидрофилизация и гидрофобизация поверхностей.
- •5.7 Растекание, критерий растекания, поверхностные пленки, двумерный газ
- •5.8 Адсорбция
- •5.8.1 Общие положения, классификация изотерм адсорбции
- •5.8.2 Фундаментальное термодинамическое уравнение адсорбции Гиббса
- •5.8.3 Адсорбция газов и паров на поверхности твердых тел
- •5.8.4 Уравнение адсорбции Фрейндлиха. Его анализ и решение
- •5.8.5 Мономолекулярная теория (теория Ленгмюра)
- •5.8.6 Полимолекулярная теория (теория Поляни)
- •5.8.7 Теория полимолекулярной адсорбции бэт
- •Пористые адсорбенты, классификация пористых тел по Дубинину
- •5.8.10 Влияние природы и структуры адсорбента, природы и свойств газов и паров на адсорбцию. Адсорбция из смеси газов.
- •5.9 Адсорбция из раствора на границе с газом
- •5.8.10.1. Молекулярная адсорбция
- •5.8.11.2. Ионная адсорбция (адсорбция электролитов)
- •5.8.12 Ионобменная адсорбция
5.8.11.2. Ионная адсорбция (адсорбция электролитов)
Ионная адсорбция в отличие от молекулярной характеризуется избирательностью в отношении ионов одного и того же знака, которая зависит не только от природы иона, но и от свойств адсорбента. Ниже приведены правила ионной адсорбции в порядке значимости (старшинства): последующее выполняется лишь в том случае, если не применимо предыдущее.
2.1. Влияние природы адсорбента
Если адсорбция на поверхности адсорбента проходит из раствора, где имеется много различных ионов, то, согласно правилу Фаянса, адсорбироваться преимущественно будут те ионы, которые входят в состав кристаллической решетки твердого адсорбента. Силы, которые способствуют такой достройке, являются химическими, а ионы адсорбируются особенно прочно.
2.2. Влияние природы иона
а) если в растворе имеются ионы различной валентности, то в первую очередь идет адсорбция тех ионов, у которых больше валентность.
б) если все ионы, находящиеся в растворе, имеют одинаковую валентность, то преимущественно на твердой поверхности будут адсорбироваться ионы с большим радиусом.
При адсорбции электролитов процесс не заканчивается избирательной адсорбцией ионов, а идет дальше до образования двойного электрического слоя (ДЭС) следующим образом. Cогласно современной теории Штерна адсорбированные ионы (называются потенциалопределяющими) в результате адсорбционных сил прочно удерживаются твердой поверхностью и заряжают ее. За счет остаточных адсорбционных сил, а главное за счет кулоновских сил, потенциалопределяющие ионы начнут притягивать к себе ионы противоположного знака (противоионы), при этом противоионы могут быть любой природы, так как силы притяжения (кулоновские) неспецифичны. (Однако надо учитывать, что сила притяжения сильно возрастает с ростом степени окисления противоионов. Например, в ряду
K+<< Ca+2 << Al+3<< Tl+4
способность к притяжению противоионов резко возрастает.
В результате такого взаимодействия у поверхности твердого тела находятся потенциалопределяющие ионы и противоионы. За счет сил диффузии часть слабоудерживаемых противоионов удаляется от поверхности твердых тел и переходит в раствор (в так называемый диффузный слой). Особенно интенсивно этот процесс идет в водных растворах (так как вода имеет существенный дипольный момент). Поэтому количество разноименных зарядов у поверхности твердой фазы неодинаково и образуется ДЭС (двойной электрический слой).
Разберем закономерности ионной адсорбции на примере.
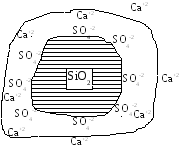
Пример. В воде растворены серная, соляная кислоты и хлорид кальция, а затем внесен измельченный песок. Какие процессы пойдут в системе?
Пойдет
ионная адсорбция, так как растворенные
в воде вещества являются электролитами.
Твердые частицы песка SiO2
из всех ионов (H+,
Cl-,
SO4-2,
Ca+2)
преимущественно будут адсорбировать
ионы SO4-2,
так как правило Фаянса не выполняется
(нет ионов, близких по природе к SiO2),
а из ионов, имеющих наибольшую валентность
(Ca+2,
SO4-2),
этот ион имеет наибольший радиус (![]() ).
).
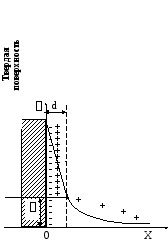
К потенциалопределяющим ионам SO4-2 будут притягиваться часть ионов Ca+2 , так как из всех положительно заряженных частиц только эти ионы имеют наибольший положительный заряд, остальная часть Ca+2 удаляется в раствор от твердой фазы в результате действия сил диффузии. И образуется ДЭС (рис. V.33), потенциал которого с удалением от твердой поверхности будет уменьшаться (рис. V.34)
Если адсорбент с уже сформировавшимся ДЭС соприкасается с раствором электролита, то в системе может наблюдаться вторичный процесс ионной адсорбции, т.е. обмен противоионов ДЭС на ионы того же знака, содержащихся в растворе. Обменная адсорбция идет лишь в следующих случаях:
а) если противоион ДЭС имеет валентность меньшую, чем ион того же знака заряда в растворе;
б) если противоион ДЭС имеет размер меньший, чем ион того же знака заряда в растворе;
г) если концентрация раствора электролита в растворе значительно выше концентрации противоионов ДЭС.
Рисунок
V. 33 – Схема образования
двойного электрического слоя
Рисунок
V.34
– ДЭС по Штерну и падение в нем потенциала
при удалении от твердой поверхности
на расстояние Х (d–толщина
ДЭС, –электрокинетический
или дзета–потенциал)