
- •Майкл Ферранте
- •Майкл
- •ЗНАЧИМОСТЬ ПРОБЛЕМЫ ПОСЛЕОПЕРАЦИОННОЙ БОЛИ
- •Распространенность проблемы по данным исследований
- •Распространенность проблемы по хирургическим данным
- •Аналгезия, контролируемая пациентом
- •Премедикация и техника анестезии
- •Недостаток рутинной количественной оценки
- •Побочное действие анальгетиков
- •Индивидуальные различия реакции на анальгетики
- •НАПРАВЛЕНИЯ И ПУТИ РЕШЕНИЯ
- •Микроскопическое строение
- •Таблица 2-2.
- •Категории ноцицепторов
- •Миелинизированные ноцицепторы
- •Немиелинизированные ноцицепторы
- •Роль ноцицепторов в перцепции боли
- •Сенсибилизация и гиперсенсибилизация
- •Фермент
- •Трансдукция в глубоких соматических тканях
- •Суставы
- •Кости
- •Трансдукция в висцеральных органах
- •Резюме по вопросам трансдукции
- •ЦЕНТРАЛЬНАЯ НЕРВНАЯ СИСТЕМА
- •Ультраструктура спинного мозга
- •Стволовая часть мозга
- •Таблица 2-4.
- •Главные структуры ствола мозга
- •Таламус
- •Первичные афферентные волокна в спинном мозге
- •Терминалы первичных афферентов
- •Нейротрансмиттеры первичных аффекторов
- •Центральная гиперсенсибилизация, или нервное перевозбуждение
- •Восходящие ноцицептивные проводящие пути
- •Вентральный спиноталамический путь
- •Дорсальный столб постсинаптической спинно-медуллярной системы
- •Проприоспинальная мультисинаптическая восходящая система
- •Таламус
- •Гипоталамус и лимбическая система
- •Кора мозга
- •Резюме по вопросам трансмиссии
- •МОДУЛЯЦИЯ
- •Аналгезия, возникающая при стимуляции
- •Аналгезия, обеспечиваемая опиоидами
- •Мост
- •Продолговатый мозг
- •Кора и промежуточный мозг
- •Серотонин
- •Эндогенные опиоиды
- •Резюме по вопросам модуляции
- •ПУТИ КОНТРОЛЯ ТЕОРИИ БОЛИ
- •ПЕРИФЕРИЧЕСКИЙ ОТДЕЛ АВТОНОМНОЙ НЕРВНОЙ СИСТЕМЫ
- •Гипоталамус
- •Субстанция Р
- •Эндокринные
- •Обменные
- •Обмен липидов
- •ЗАКЛЮЧЕНИЕ
- •СВЯЗКИ
- •1. Нет болей
- •Турникетный болевой тест
- •Карбохолиновые кислоты
- •Салициловые кислоты
- •Уксусная кислота
- •Пиролуксусная кислота
- •Фенилацетиловые кислоты
- •Пропионовые кислоты
- •Нафтипропионовые кислоты
- •ПОБОЧНЫЕ ДЕЙСТВИЯ
- •Кожные реакции
- •СООТНОШЕНИЕ СТРУКТУРЫ И АКТИВНОСТИ
- •Опиоидные рецепторы
- •Прототипы
- •Связывание рецепторов и их реакция: истинная активность
- •Типы рецепторов
- •Пути поступления препаратов
- •С помощью общей абсорбции
- •Проникновение к рецепторам
- •Таблица 8-8. Аналгезические эквиваленты опиоидов
- •ЗАКЛЮЧЕНИЕ
- •Список литературы
- •Химическая структура
- •Дозировка
- •Добавки
- •Смеси
- •Беременность
- •ФАРМАКОКИНЕТИКА
- •Абсорбция
- •Распределение
- •Метаболизм и выведение
- •ТОКСИЧНОСТЬ
- •Общая токсичность
- •Токсичность для центральной нервной системы
- •Токсичность для сердечно-сосудистой системы
- •Различные системные эффекты
- •Аллергические реакции
- •Местное токсическое воздействие
- •ОСЛОЖНЕНИЯ РЕГИОНАЛЬНОЙ АНЕСТЕЗИИ
- •Эпидуральная анестезия
- •Уровень блокады
- •Доза препарата
- •Особенности локального анестетика
- •Дополнительное введение вазоконстрикторов
- •Волемическое состояние, объем циркулирующей крови
- •Спинальная анестезия
- •Кокаин
- •Хлоропрокаин
- •Тетракаин
- •Прилокаин
- •Бупивакаин
- •Этидокаин
- •Бензокаин
- •ЗАКЛЮЧЕНИЕ
- •Определение методов АКП и параметры дозировок
- •Инфузионная технология АКП
- •Характеристика прибора
- •Шприц
- •Безопасность
- •Неблагоприятные реакции и побочное действие
- •Взаимодействие прибора и пользователя
- •Образец (парадигма) АКП
- •Непрерывная инфузионная аналгезия для преодоления острой боли
- •Индивидуализация требований аналгезии
- •Вопросы фармакокинетики
- •Факторы фармакодинамики
- •Психологические факторы
- •ПОДКОЖНАЯ АНАЛГЕЗИЯ, КОНТРОЛИРУЕМАЯ ПАЦИЕНТОМ
- •ЭПИДУРАЛЬНАЯ АНАЛГЕЗИЯ, КОНТРОЛИРУЕМАЯ ПАЦИЕНТОМ
- •ЗАКЛЮЧЕНИЕ
- •Список литературы
- •Механизм действия
- •Значение растворимости в липидах
- •Наступление аналгезии
- •Продолжительность аналгезии
- •Ростральная миграция в ЦСЖ
- •Место инъекции
- •Интермитткрующие инъекции или продолжительные инфузии?
- •Показания к применению
- •СУБАРАХНОИДАЛЬНОЕ ВВЕДЕНИЕ ОПИОИДОВ В КЛИНИКЕ
- •Замечания
- •ПОБОЧНОЕ ДЕЙСТВИЕ СПИНАЛЬНЫХ ОПИОИДОВ
- •Угнетение дыхания
- •Таблица 11-5. Побочное действие спинальных опиоидов
- •Тошнота
- •Задержка мочи
- •Активация латентной герпетической инфекции
- •Угнетение функции желудочно-кишечного тракта
- •Неврологические эффекты
- •МОНИТОРИНГ
- •ЗАКЛЮЧЕНИЕ
- •БАЛАНСИРОВАННАЯ АНАЛГЕЗИЯ
- •ЭПИДУРАЛЬНОЕ ВВЕДЕНИЕ ЛОКАЛЬНЫХ АНЕСТЕТИКОВ
- •Влияние эпидуральной блокады на сердечно-сосудистую систему
- •Интермиттирующие инъекции
- •Дозирующие
- •Продолжительные инфузии
- •Тахифилаксия
- •Общие сведения
- •Механизм тахифилаксии
- •Фармакокинетические
- •Фармакодинамические
- •Нейропластические
- •Синергизм аналгезии
- •Угнетение тахифилаксии
- •Угнетение ноцицептивной трансмиссии: афферентный «барраж»
- •Продолжительность действия
- •Клинические исследования
- •Выявление нарушений
- •Осложнения и побочное действие
- •ЗАКЛЮЧЕНИЕ
- •АНАТОМИЯ
- •МЕХАНИЗМ ДЕЙСТВИЯ
- •Противопоказания
- •ПРИМЕНЕНИЕ В КЛИНИКЕ
- •ЗАКЛЮЧЕНИЕ
- •Список литературы
- •АНАТОМИЯ
- •Симпатическая иннервация верхней конечности
- •МЕТОДИКА
- •Межскаленный подход
- •Подключичный периваскулярный доступ
- •Подключичный (инфраклавикулярный) доступ
- •ПРИМЕНЕНИЕ В КЛИНИКЕ
- •ОСЛОЖНЕНИЯ
- •Токсическое действие локальных анестетиков
- •Повреждение нерва
- •ЗАКЛЮЧЕНИЕ
- •АНАТОМИЯ
- •МЕХАНИЗМ ДЕЙСТВИЯ
- •Выполнение процедуры
- •Возможные технические трудности
- •Варианты методики
- •Выбор локального анестетика и его дозировка
- •Интервалы между повторными введениями
- •ПРИМЕНЕНИЕ В КЛИНИКЕ
- •Пневмоторакс
- •Повреждение сосудов
- •Токсическое действие локального анестетика
- •Повреждение нерва
- •ЗАКЛЮЧЕНИЕ
- •АНАТОМИЯ
- •МЕХАНИЗМ АНАЛГЕЗИИ
- •Положение пациента и ориентиры
- •Выполнение процедуры
- •Объем вводимого раствора
- •Другие локальные анестетики
- •Адреналин
- •Длительные внутриплевральные инфузий
- •ПРИМЕНЕНИЕ В КЛИНИКЕ
- •Продолжительная внутриплевральная инфузия
- •ОСЛОЖНЕНИЯ
- •Пневмоторакс
- •Токсическое действие локального анестетика
- •Противопоказания к внутриплевральной региональной аналгезии
- •ПЛЕВРАЛЬНЫЙ ВЫПОТ
- •СИНДРОМ ГОРНЕРА
- •БЛОКАДА ДИАФРАГМАЛЬНОГО НЕРВА
- •ПРОТИВОПОКАЗАНИЯ
- •ЗАКЛЮЧЕНИЕ
- •АНАТОМИЯ
- •МЕХАНИЗМ ДЕЙСТВИЯ
- •МЕТОДИКА
- •Положение пациента и ориентиры
- •Выполнение
- •Варианты методики
- •ПРИМЕНЕНИЕ В КЛИНИКЕ
- •Пневмоторакс
- •Прокол твердой мозговой оболочки
- •Гипотензия
- •Повреждение сосудов
- •Повреждение нервов
- •ЗАКЛЮЧЕНИЕ
- •Список литературы
- •АНАТОМИЯ
- •МЕТОДИКА
- •Мониторинг и подготовка
- •Положение пациента и ориентиры
- •Выполнение процедуры
- •Околосрединный подход
- •Подход по средней линии
- •Контроль проникновения в эпидуральное пространство
- •Потеря сопротивления
- •Ощущение прокола желтой связки
- •Легкость введения катетера
- •Физиологические реакции
- •Выбор анальгетиков и их дозировка
- •Снижение артериального давления
- •Потребность миокарда в кислороде
- •ПРИМЕНЕНИЕ В КЛИНИКЕ
- •ОСЛОЖНЕНИЯ
- •Прокол твердой мозговой оболочки
- •Прокол вены
- •Парестезия
- •Задержка мочи
- •Тошнота
- •Седация
- •Гипотензия
- •Снижение сердечного резерва
- •ЗАКЛЮЧЕНИЕ
- •ЭПИДУРАЛЬНАЯ ГЕМАТОМА
- •Клинические признаки и патофизиология
- •Эпидуральная гематома после субарахноидальной пункции
- •Имеются явные факторы риска
- •Эпидуральная гематома после эпидуральной анестезии
- •ОРИЕНТИРЫ ДЛЯ КРИТИЧЕСКОГО РЕШИТЕЛЬНОГО АНАЛИЗА
- •Предоперационная оценка
- •Нестероидные противовоспалительные препараты
- •Ведение больного в операционном и послеоперационном периодах
- •Время полувыведения
- •Послеоперационный мониторинг
- •ЗАКЛЮЧЕНИЕ
- •Список литературы
- •ИСТОРИЧЕСКАЯ СПРАВКА
- •МЕХАНИЗМ ДЕЙСТВИЯ
- •ТЕХНИЧЕСКИЕ АСПЕКТЫ
- •Продолжительность импульса
- •Постоянный поток или постоянный вольтаж
- •Форма волн
- •Частотность
- •Амплитуда
- •Установка электродов и множественные каналы стимуляции
- •Электроды
- •Сроки стимуляции
- •Побочное действие
- •Противопоказания
- •Методологические аспекты
- •Абдоминальная хирургия
- •ЧЭСН
- •Ортопедичесчик операции
- •Кардиоторакальная хирургия
- •Разные операции
- •Кардиоторакальные операции
- •Различные операции
- •Ортопедические операции
- •Акушерские операции
- •Операции на сердце и на органах грудной клетки
- •Состояние после ампутации
- •ЗАКЛЮЧЕНИЕ
- •Обучение
- •Гипноз
- •Введение в транс
- •Погружение в транс
- •Гипнотическая работа
- •Завершение
- •Релаксационная реакция
- •Достижение релаксационной реакции
- •ЗАКЛЮЧЕНИЕ
- •ПРЕДОПЕРАЦИОННЫЕ ФАКТОРЫ И ПОДГОТОВКА
- •ОЦЕНКА СТЕПЕНИ ВЫРАЖЕННОСТИ БОЛИ
- •Боль у ребенка, не умеющего говорить
- •Оценка степени боли
- •Неопиоиды
- •Опиоиды
- •Опиоиды
- •Внутримышечное введение
- •Интермиттирующее внутривенное введение опиоидов
- •Продолжительное внутривенное введение опиоидов
- •Региональная анестезия/аналгезия
- •Каудальный блок
- •Эпидуральная аналгезия в поясничном и грудном отделах
- •Блокада подвздошно-пахового и подвздошно-подчревного нервов
- •Блокада дорсального нерва полового члена
- •Блокада бедренного и бокового кожного нервов бедра
- •Блокада отсека подвздошной фасции
- •Внутриплевральная региональная аналгезия
- •Инфильтрационная аналгезия операционной раны
- •ЗАКЛЮЧЕНИЕ
- •Внутривенное введение опиоидов
- •Эпидуральное введение опиоидов
- •Морфин
- •Субарахноидально
- •Меперидин
- •Фентанил
- •Суфентанил
- •Буторфанол
- •Бупренорфин
- •Сочетанное применение препаратов
- •Субарахноидальное введение опиоидов
- •Морфин
- •Фентанил
- •Суфентанил
- •Эпидуральное введение клофелина
- •АНАЛГЕЗИЯ ОПИОИДАМИ И ГРУДНОЕ ВСКАРМЛИВАНИЕ
- •ВЫБОР АНАЛГЕЗИИ ПОСЛЕ КЕСАРЕВА СЕЧЕНИЯ
- •Список литературы
- •Артропластика и протезирование тазобедренного сустава
- •Осложнения, % в группе
- •Тазобедренный сустав
- •Субарахноидальное введение опиоидов
- •Эпидуральное введение опиоидов и локальных анестетиков
- •Тазобедренный сустав
- •Коленный сустав
- •Оба сустава
- •Операции со вскрытием коленного сустава
- •Общее назначение опиоидов
- •Субарахноидальное введение опиоидов
- •Эпидуральное введение опиоидов
- •Эпидуральное введение локального анестетика
- •Комбинированная аналгезия
- •Невральная блокада поясничного сплетения
- •Внутрисуставное введение морфина
- •Блокада плечевого сплетения
- •Эпидуральная анестезия/аналгезия в области шеи
- •Ампутация
- •Открытое вправление и внутренняя фиксация переломов лодыжки
- •Невральная блокада седалищного нерва в подколенной области
- •ЗАКЛЮЧЕНИЕ
- •Межреберная невральная блокада
- •Внутриплевральная региональная аналгезия
- •Паравертебральная невральная блокада
- •Криоаналгезия
- •Чрескожная электростимуляция нерва
- •Субарахноидальное введение опиоидов
- •Эпидуралыюе введение локальных анестетиков и опиоидов
- •Введение локальных анестетиков
- •Введение опиоидов
- •Установка эпидурального катетера в грудном или поясничном отделе
- •Комбинированное применение локальных анестетиков и опиоидов
- •Влияние на дыхание
- •ОСОБЫЕ ПРОБЛЕМЫ АНАЛГЕЗИИ ПОСЛЕ ТОРАКОТОМИИ
- •ЗАКЛЮЧЕНИЕ
- •Сенсибилизация ноцицепторов
- •Глубокая соматическая боль
- •Трансмиссия
- •Иррадиирующая боль
- •Предполагаемые механизмы иррадиирующей боли
- •Последовательные рефлекторные реакции
- •Кортикальные реакции
- •Нарушения функции легких
- •Осложнения со стороны желудочно-кишечного тракта
- •Тромбоэмболия
- •Аналгезия, контролируемая пациентом
- •Межреберная невральная блокада
- •Внутриплевральная региональная аналгезия
- •Аналгезия при ВПА
- •Субарахноидальное введение опиоидов
- •Эпидуральное введение локальных анестетиков и опиоидов
- •Операции на нижнем отделе брюшной полости
- •Аппендэктомия
- •Операции на толстом кишечнике
- •Опорожнение желудка и подвижность тонкого кишечника
- •Моторика толстого кишечника
- •ЗАКЛЮЧЕНИЕ
- •ДВА МНЕНИЯ: АНАЛГЕЗИЯ ПРОТИВ ДИАГНОСТИКИ
- •ФИЗИОЛОГИЧЕСКИЕ НАРУШЕНИЯ, СВЯЗАННЫЕ С ТРАВМОЙ
- •Региональная анестезия/аналгезия
- •Подкожная инфильтрационная анестезия
- •Бупивакаин
- •Фоновая блокада
- •Периферическая невральная блокада
- •Блокада сплетения
- •Внутриплевральная региональная аналгезия
- •Эпидуральная аналгезия
- •Субарахноидальная аналгезия
- •ТРАВМЫ ГОЛОВЫ
- •ТРАВМЫ ГРУДНОЙ КЛЕТКИ
- •ПОВРЕЖДЕНИЯ СКЕЛЕТА
- •ЗАКЛЮЧЕНИЕ
- •КОММУНИКАЦИЯ
- •ВРАЧЕБНЫЙ ВКЛАД
- •КОНЦЕПЦИЯ «ГЛОБАЛЬНОГО ГОНОРАРА»
- •Администрация госпиталей
- •Приобретение оборудования
- •Маркетинг
- •ЗАКЛЮЧЕНИЕ
- •Цели
- •Группа задач, связанных с АКП
- •Распределение препаратов
- •Участие медицинских сестер в переориентировке целей
- •Доза АКП, мг
- •Объекты проведения целевых усилии
- •АЛЬТЕРНАТИВНЫЕ МЕТОДЫ КОНТРОЛЯ БОЛИ
- •Поза, позиционная установка
- •Сон, релаксация
- •Тошнота, рвота
- •Стимуляция активности пациента
- •Психологический статус
- •Дополнительные медикаментозные назначения
- •ЗАКЛЮЧЕНИЕ
- •АНАЛГЕЗИЯ, КОНТРОЛИРУЕМАЯ ПАЦИЕНТОМ
- •Аналгезия, контролируемая пациентом
- •Общие указания
- •Обучение пациента/родственников
- •ПЕРСОНАЛЬНЫЙ ФАКТОР
- •Анестезиолог
- •Сестринская помощь
- •Фармакологическая служба
- •ОБОРУДОВАНИЕ
- •Простота и легкость в обращении
- •Ограничитель скорости потока
- •Приборы для эпидуральной инфузии
- •Вход для инъекций
- •Безопасность
- •Мониторы
- •ПРОЦЕДУРЫ, ПРОВОДИМЫЕ СЛУЖБОЙ ОСТРОЙ БОЛИ
- •Документация
- •ПРОБЛЕМЫ, СТОЯЩИЕ ПЕРЕД СЛУЖБОЙ ОСТРОЙ БОЛИ
- •Проблемы, стоящие перед СОБ
- •МОЛЕКУЛЯРНАЯ ФАРМАКОЛОГИЯ
- •Нейроэндокринная система
- •Сердечно-сосудистая система
- •Дыхательная система
- •Почки
- •Пищеварительная система
- •Центральная нервная система
- •МЕХАНИЗМ АНАЛГЕЗИИ
- •Нейроэндокринные
- •Сердечно-сосудистые
- •Респираторные
- •Желудочно-кишечные
- •Центральная нервная система
- •Эпидуральное назначение
- •Субарахноидальное введение
- •ЗАКЛЮЧЕНИЕ
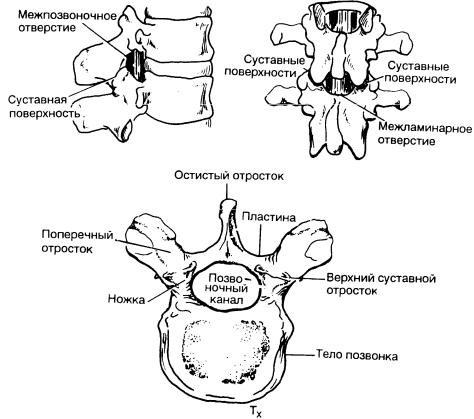
Рис. 5-1. Типичный позвонок(грудной) и сочленованные поясничные позвонки.
Размеры и форма позвонков в каждом из отделов позвоночника -раз личны (рис. 5-2). Шейные позвонки имеют самые малые, а поясничные - самые большие размеры. Значительно варьирует и угол наклона остистых отростков. В шейном отделе позвоночника, в нижнегрудном и в поясничном отделах остистые отростки проходят почти горизонтально. В среднегрудном отделе остистые отростки наклонены в каудальном направлении(максимальный - от TIII до ТVII). Угол наклона остистых отростков определяет ход иглы при выполнении спинальной пункции и соответственно трудность этой процедуры.
СВЯЗКИ
Дужки соседних позвонков соединены между собой с помощью трех связок (рис. 5-3). Пластины, объединяющие дужки позвонков, соединяются между собой и вливаются в состав желтой связки. Эта связка формирует значительную часть задней стенки позвоночного канала и заднюю границу эпидурального пространства. Остистые отростки соединяются между собой межостистыми связками, проходящими от нижнего края одного отростка до верхнего края соседнего. Надостистая связка проходит поверхностно между верхушками остистых отростков, объединяя их.
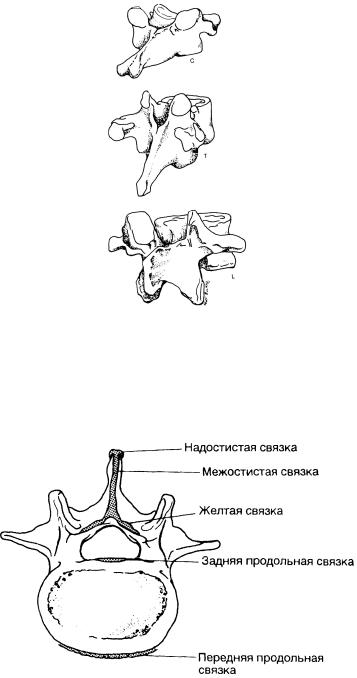
Рис. 5-2. Типичные позвонки в косом положении.
Нижний шейный (С), среднегрудной (Т), среднепоясничныи (L). Остистый отросток в средне-грудном отделе наклонен, что затрудняет выполнение эпидуральной пункции. Максимальный наклон имеют остистые отростки от ТIII до ТVII. В шейном, нижнегрудном и в поясничном отделах остистые отростки расположены почти горизонтально.
Рис. 5-3. Связки позвоночного столба.
Передняя и задняя продольные связки скрепляют тела позвонков от С
II
до крестца. Передняя продольная связка прикрепляется к межпозвоночным дискам и к прилежащим поверхностям тел позвонков. Задняя продольная связка соединяет задние поверхности тел позвонков и формирует часть -пе редней стенки позвоночного канала.
СТРУКТУРЫ, РАСПОЛОЖЕННЫЕ В ПОЗВОНОЧНОМ КАНАЛЕ Спинной мозг
Спинной мозг простирается от большого затылочного отверстия до уровня II поясничного позвонка. Его каудальный конец постепенно сужива-
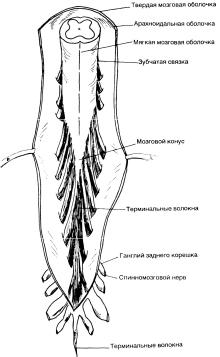
ется и образует мозговой конус, а далее вплоть до копчика продолжаются тонкие, так называемые терминальные волокна(рис. 5-4). Поясничные крестцовые и копчиковые нервы последовательно выходят из мозгового конуса, образуя «конский хвост». Он заключен в мешок из твердой мозговой оболочки, заполненной цереброспинальной жидкостью (ЦСЖ).
Спинной мозг образует два веретенообразных утолщения: в шейном и поясничном отделах. Шейное утолщение расположено на уровне позвонков от СIII до TII и соответствует нервам, обеспечивающим иннервацию верхней конечности. Поясничное утолщение простирается от уровня позвонкаTIX до верхнего края LI и содержит нервные структуры, формирующие затем поясничное сплетение.
Спинной мозг как бы свешивается из большого затылочного отверстия, предотвращающего каудальное смещение более широкого продолговатого мозга. В нижележащих отделах спинной мозг удерживается в своем положении корешками спинномозговых нервов, зубчатой связкой и терминальными волокнами. Зубчатая связка представляет собой утолщение мягкой мозговой оболочки, имеющееся на каждой из сторон нервных корешков, она прикрепляется к арахноидальной и к твердой мозговой оболочкам.
Рис. 5-4. Нижний конец спинного мозга и конский хвост в мешке из твердой мозговой оболочки.
У взрослых спинной мозг короче позвоночного столба, поэтому расположение его сегментов не совпадает с соответствующими позвонками(рис. 5-5). Принято рассматривать спинной мозг как бы состоящим из сегментов в соответствии с отходящими от него спинномозговыми нервами, хотя морфологически в нем нет поперечной сегментации. Таким образом, восьмой шейный сегмент спинного мозга располагается на уровнеVI шейного позвонка. Шесть верхних сегментов грудного отдела спинного мозга лежат на уровне от СVII до верхнего края TIV. Нижние шесть сегментов грудного отдела спин-
ного мозга соответствуют уровням от Т до TIX. Пять поясничных сегментов
V
находятся против ТX-ТXII, а пять крестцовых и один копчиковыйпротив позвонков ТXII- LI.
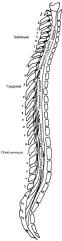
Рис. 5-5. Соотношение позвоночного столба и спинного мозга у взрослого индивида (вид сбоку). Расположение сегментов спинного мозга не соответствует нумерации ближайших позвонков. Восемь сегментов шейного отдела спинного мозга лежат против шести верхних шейных позвонков. Верхние
шесть сегментов грудного отдела спинного мозга расположены от Сдо
VII
верхнего края TIV. Нижние шесть сегментов грудного отдела спинного мозга расположены на уровне позвонков ТV-TIX. Пять поясничных сегментов лежат против позвонков TX-TXII. Пять крестцовых и один копчиковый сегменты спинного мозга лежат против позвонков TXII и LI.
Мозговые оболочки
Выделяют три оболочки, обволакивающие структуры центральной нервной системы. Мягкая мозговая оболочканежная сосудистая пленка, тесно прилежащая к спинному мозгу и к его корешкам. Арахноидальная оболочка бессосудистая мембрана, плотно связанная с твердой мозговой оболочкой. Между ними находится небольшой слой жидкости, который потенциально способен сформировать так называемое субарахноидальное -про
странство. Благодаря последнему возможны - субду экстраарахноидальные инъекции. Арахноидальная оболочка простирается до второго поясничного позвонка вместе с твердой мозговой оболочкой. Твердая мозговая оболочка является самым наружным покровом, окутывающим спинной мозг и его корешки и проникающим в межпозвоночные отверстия, где окружает также и смешанные нервы. Спинномозговые нервы пронизывают твердую мозговую оболочку, поэтому каждый передний и задний их корешки в своих боковых участках имеют как бы«рукава» из этой оболочки. Твердая мозговая оболочка на большом своем протяжении соприкасается с эпиневрием спинномозговых нервов. Поэтому всегда существует опасность
интрадуральной инъекции во время выполнения региональной анестезии вблизи позвоночного канала. Твердая мозговая оболочка сверху прикреплена к краям большого затылочного отверстия, а каудально заканчивается на уровне II крестцового позвонка.
Субарахноидальное пространство
Субарахноидальное пространство расположено между арахноидальной и мягкой мозговой оболочками, оно содержит ЦСЖ. В спинальном субарахноидальном пространстве и в вентрикулярной системе находится около150 мл ЦСЖ, но только 30 мл омывают спинной мозг и конский хвост.
ЦСЖ продуцируется сосудистыми сплетениями в латеральных отделах III и IV желудочков. Она представляет собой ультрафильтрат плазмы крови.
К спинному мозгу ЦСЖ попадает из желудочков через отверстия Лушки и Мажанди. Обратно в кровь ЦСЖ поступает через грануляции на арахноидальной оболочке, выделяющие эту жидкость в интракраниальные венозные синусы. Арахноидадьные грануляции имеются также на твердой мозговой оболочке в области манжеток эпидурального пространства (см. ниже).
Эпидуральное пространство
Эпидуральное пространство локализовано между твердой мозговой оболочкой, с одной стороны, и соединительнотканным покрытием позвонков и желтой связкой – с другой (рис. 5-6). Эпидуральное пространство отделяет твердую мозговую оболочку от надкостницы, выстилающей изнутри позвоночный канал. Оно целиком заполнено соединительной тканью, жировой клетчаткой, а также сосудами, в том числе и венозными сплетениями. Поэтому его описывают как потенциальное пространство. Оно простирается от большого затылочного отверстия вдоль всего спинного мозга вплоть до входа в крестец.
Поперечные размеры пространства между желтой связкой и твердой мозговой оболочкой варьируют (рис. 5-7). Самая узкая часть эпидурального пространства расположена в области шейного и поясничного утолщений спинного мозга. Поскольку спинной мозг заканчивается на уровнеLII, то в этих участках эпидуральное пространство расширяется. В нижнем шейном отделе расстояние между желтой связкой и твердой мозговой оболочкой может составлять 2 мм и менее. В среднегрудном отделе оно достигает3-5 мм,
а ниже окончания спинного мозга на уровне LII возрастает до 5-7 мм (см. рис. 5-7). Поэтому количество локального анестетика, требующееся для анестезии спинального сегмента, прямо пропорционально величине поперечного сечения эпидурального пространства: 0,5 мл в торакальных сегментах, 1,5 мл – в поясничных и 3 мл – в крестцовых сегментах.
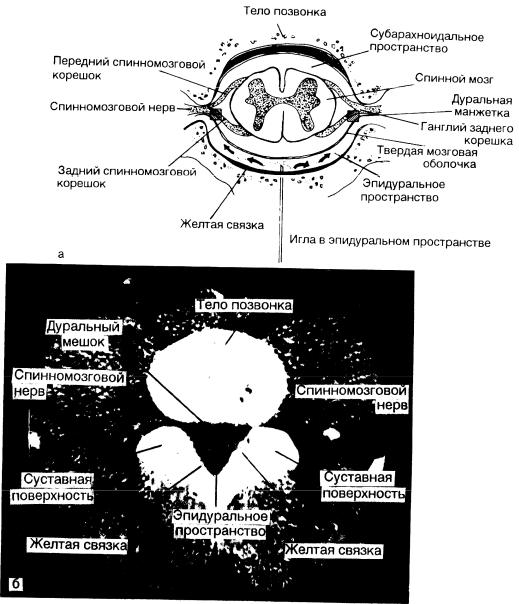
Рис. 5-6. Позвоночный канал.
а-диаграмма поперечного сечения позвоночного канала;
б – соответствующая компьютерная томограмма на уровне LIII-LIV. Препарат, введенный в эпидуральнос пространство, будет диффундировать в дуральную манжетку. Арахноидальные грануляции в ее области обеспечивают его поступление в ЦСЖ.
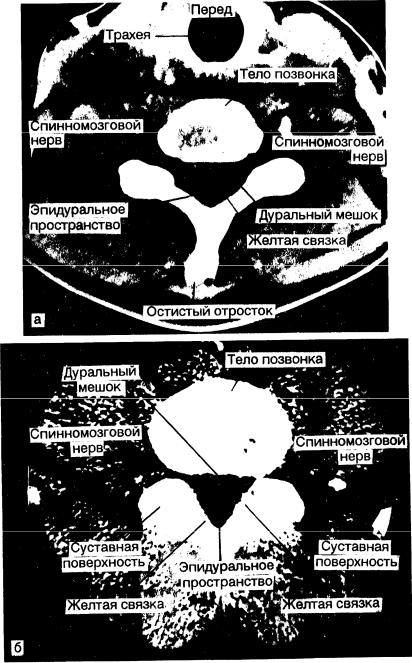
Рис. 5-7. Компьютерная томограмма на уровне CVI-CVII (а) и LIII-LIV (б). Заметно увеличение поперечника эпидурального пространства в поясничной области. В нижнешейном отделе расстояние между желтой связкой и твердой мозговой оболочкой может составлять 2 мм и менее.
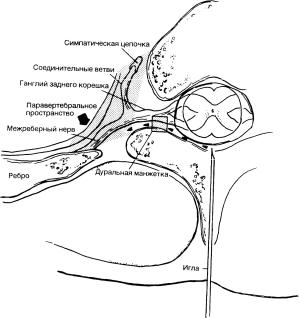
Рис. 5-8. Поперечное сечение на уровне межпозвоночного отверстия. Локальный анестетик, введенный в эпидуральное пространство, будет диффундировать латерально в дуральную манжетку. Дальнейшая латеральная диффузия приводит к проникновению анестетика через межпозвоночное отверстие в паравертебральное пространство(заштрихованная треугольная зона). Таким образом, эпидуральная анестезия обеспечивается двумя механизмами: блокадой спинномозговых нервов и паравертебральной спинальной блокадой.
При инъекциях в эпидуральное пространство введенный анальгетик должен распространяться в латеральные участки(см. рис. 5-6). Диффузия в область манжеток обеспечивает доступ к ЦСЖ через арахноидальные грануляции. Этот механизм имеет важное значение для проникновения введенных эпидурально опиоидов к месту расположения рецепторов в спинном мозге. Дальнейшая диффузия в латеральном направлении происходит через межпозвоночные отверстия и позволяет анальгетику проникнуть в паравертебральное пространство (рис. 5-8). Таким образом, эпидуральная анестезия/аналгезия локальным анестетиком может обеспечиваться двумя механизмами: блокадой корешков спинномозговых нервов(в области дуральной манжетки) и паравертебральной невральной блокадой(проникновение анестетика через межпозвоночные отверстия).
КРОВОСНАБЖЕНИЕ ПОЗВОНОЧНОГО КАНАЛА Артерии
Кровоснабжение спинного мозга, его корешков и мозговых оболочек осуществляется передней спинномозговой артерией и двумя задними спинномозговыми артериями. Первая из указанных артерий спускается по передней срединной борозде на передней поверхности спинного мозга(рис. 5-9) и заканчивается артериолами на уровне терминальных волокон. Она образует-
ся из разных источников. Верхняя часть передней спинномозговой артерии формируется при слиянии конечных ветвей позвоночных артерий и анастомозов от ветвей щитовидно-шейной и реберно-шейной артерий. Эта система обеспечивает артериальное кровоснабжение спинного мозга до уровняTIV. Передняя спинномозговая артерия среднегрудного отдела образуется межреберными артериями, отходящими от аорты на уровнеTIV-TIX. Нижележащие участки спинного мозга питаются единственным сосудом(a. radicularis magna, артерия Адамкевича). Эта артерия отходит от аорты на участке отTIX до LII. Передняя спинномозговая артерия обеспечивает кровью всю переднюю часть спинного мозга или почти 2/3 его объема (см. рис. 5-9).
Задние спинномозговые артерии отходят от задних нижних ветвей мозжечковых артерий и опускаются по задней поверхности спинного мозга.
Эти артерии располагаются чуть медиальное соответствующих заднихко решков, они обеспечивают артериальной кровью1/3 объема спинного мозга. Весьма значительные анатомические вариации в прохождении передней спинномозговой артерии имеют большое клиническое значение. Между отдельными участками спинного мозга не всегда имеются достаточные анастомозы, поэтому в определенных зонах спинного мозга, снабжаемой единственной артерией (артерия Адамкевича), может развиться ишемия. Сегментарные артерии обеспечивают спинной мозг с обеих сторон, тем не менее в терминальных зонах может присутствовать всего одна концевая артерия с какой-либо из сторон. Нарушение кровотока в ней ведет к ишемии и к развитию синдрома передней спинномозговой артерии, характеризующегося ослаблением двигательной способности при сохранении чувствительности.
Игла, введенная в эпидуральное пространство косым доступом при проколе желтой связки, может травмировать область дуральной манжетки, где в позвоночный канал входят«питающие» ветви спинномозговых артерий. Они могут быть повреждены при выполнении спинальной анестезии/аналгезии. Однако современные достижения техники эпидуральной анестезии сводят к минимуму число осложнений типа синдрома передней спинномозговой артерии.
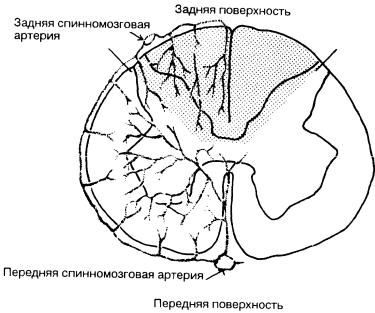
Рис. 5-9. Артериальное обеспечение спинного мозга.
2
Передняя спинномозговая артерия снабжает передние/3 спинного мозга. Ишемия в системе этой артерии вызывает двигательные нарушения.
Вены
Сложная система эпидуральных венозных сплетений окружает дуральный мешок на всем его протяжении в позвоночном канале. Через венозные сплетения дренируется кровь от спинного мозга, от структур позвоночного канала и в небольшом количестве отводится ЦСЖ, поступающая через арахноидальные грануляции. В верхнем отделе эпидуральные венозные сплетения соединяются с мозговыми венозными синусами. Кровь от самого спинного мозга оттекает через систему непарной и полунепарной вен. В нижних
отделах кровь из эпидуральных венозных сплетений попадает в систему нижней полой вены через крестцовые и тазовые венозные сплетения.
Список литературы
1.Covino ВС. Scott DB: Handbook of Epidural Anaesthesia and Analgesia. Grune & Stratton, Orlando. FL, 1985
2.Kutz J, Renck H: Handbook ofThoraco-abdominal Nerve Block. Grune & Siratton, Orlando, FL, 1987
3.Scott DB: Techniques of Regional Anaesthesia. Appleton & Lange/Mediglobc, Norwalk, CT, 1989
Клиническое измерение боли
Роберт H. Джеймисон (Robert N. Jamison)
Характеристика боли и ее измерение привлекают все большее внимание. Боль остается субъективным ощущением, тем не менее ее количественная оценка приобретает возрастающее значение. Первоначально попытки измерить боль фокусировались только на колебаниях ее интенсивности. Как
известно, ощущение боли у человека отражает сложный комплекс- фи зиологических и патофизиологических процессов, конечным результатом которых и являются качественные особенности боли.
К сожалению, проблема измерения боли все еще находится в зародышевом состоянии, отсутствует даже единая теоретическая база для этого. В общем существуют две основные модели возникновения боли:
1)медицинская модель, по которой боль рассматривается как патология или следствие повреждения;
2)поведенческая модель, по которой боль представляет собой ощущение, регулируемое сознанием, поведением и персональными предрасполагающими факторами.
Первая из этих моделей более традиционна и основана на объективных данных патологии. Поведенческая модель ориентирована на субъективные факторы, например на предшествующий опыт и воспитание. Эти фундаментальные различия характеризуют некоторые из типичных затруднений, возникающих при попытках точно оценить боль.
Важно остановиться на некоторых трудностях, присущих измерению боли. Так как боль - это субъективное ощущение, каждый человек воспринимает ее по-своему. В количественной оценке боли обнаружены непреодолимые индивидуальные различия. Например, одни пациенты никогда не оценят свои боли в 10 баллов (по шкале от 0 до 10), пока они не достигнут такой степени, что больные почти начнут терять сознание. Другие пациенты, наоборот, оценивают боль в 10 баллов, хотя при этом остаются спокойными и расслабленными. Следовательно, все цифровые системы оценки боли имеют пределы надежности. Если пациент характеризует боль как«10-балльную», то говорить о дальнейшем нарастании боли уже нельзя.
Сравнивать болевые ощущения очень сложно из-за большого числа индивидуальных различий. Больные по-разному сообщают о локализации, характере и продолжительности своих болей. Кроме того, само восприятие боли в данный момент зависит от предшествующего опыта больного в этом от-
ношении. На индивидуальное восприятие боли влияют демографические факторы, пол, возраст, этнические особенности. Сведения, сообщаемые пациентом о своих болях, изменяются в зависимости от проводимого лечения, от нарушений сна и от аффектации. Так, в состоянии депрессии и возбуждения пациенты склонны преувеличивать свои боли.
Все эти факторы проливают свет на трудности, свойственные оценке интенсивности болей у человека. Однако, несмотря на эти ограничения, раз-
работано и применяется много методов клинической оценки боли. В данной главе приведен обзор мекоторых из них, кратко описаны их преимущества и недостатки.
САМООЦЕНКА ВЫРАЖЕННОСТИ БОЛИ
Самым обычным методом количественной характеристики боли является ее оценка самим пациентом. Он может использовать множество слов и определений, чтобы описать интенсивность своих болей. Некоторые системы учета основаны на фиксации различных признаков боли, но большинство принимают во внимание лишь один из них.
Наиболее простой способ характеризовать больэто спросить пациента, имеются ли у него боли(да/нет). Этот действительно простейший метод не дает представления о интенсивности боли. Одна из первых схем систематизации боли была предложена Melzack и Torgerson [1]. В ней предусматривалось пять разных определений степени болевых ощущений - от «легкой» до «мучительной». Однако эту шкалу критиковали, так как она недостаточно отражала ощущения больного. Некоторые из методов измерения боли были признаны более реальными и значимыми по сравнению с другими.
Цифровая рейтинговая (оценочная) шкала
Цифровая рейтинговая шкала используется для определения интенсивности боли. Впервые применили ее Budzynski и сотр. [2] и Melzack [3]. Пациентам предлагали оценить свои болевые ощущения цифрами от 0 (нет болей) до величины максимальной ее интенсивности(до 10 или 100). Эта методика позволяла оценивать динамику болевых ощущений, была проста в употреблении и более демонстративна, чем другие способы измерения боли[4]. Пациенты легко обучались применению этой схемы, особенно когда цифровые обозначения связывались с определенной интенсивностью болей. Шкала быстро усваивалась, была наглядной и удобной в заполнении. Из разных в цифровом масштабе значений шкалы наиболее распространенной стала шкала из 11 пунктов (от 0 до 10). Можно рекомендовать также более детальную шкалу с большим числом цифр, позволяющую подробнее характеризовать вариабильность болевых ощущений.
Некоторые клиницисты предлагали своим пациентам оценивать боли ежечасно все время лечения. Подобная периодическая оценка обеспечивает информацию о динамике боли, что не удается получить при однократном определении ее интенсивности. Сопоставляя предыдущие и последующие показатели болевых ощущений, можно судить об эффективности проводимого лечения. Однако частые измерения требуют сотрудничества со стороны пациента, что иногда становится серьезной проблемой. Более того, настороженность больного в отношении восприятия боли, сопряженная с ее мониторингом, может привести к усилению раздражительности, ощущению недостатка внимания, чувству заброшенности, беспомощности [5]. Это особенно

нежелательно, если боли постоянные или даже усиливающиеся. Следовательно, частые измерения боли могут привести к неточности в ее оценке и к преувеличению болевых ощущений.
Несмотря на указанные недостатки, цифровая система оценки боли часто довольно успешно используется в клинических условиях. Возможно, она является наиболее доступным методом при обслуживании большого числа пациентов, страдающих от болей в послеоперационном периоде.
Было высказано предположение, что пациенты, проводящие мониторинг собственных болевых ощущений, могут испытывать чувство усиливающегося контроля [7]. Уже сам по себе факт мониторинга они воспринимают как активное вмешательство[8]. Однако последние исследования подтвердили, что ежечасный контроль интенсивности болей потенциально полезен в клинике [5]. Пациенты, не справлявшиеся с продолжительной оценкой своих болей, обычно были склонны к эмоциональным нарушениям. Это обстоятельство удавалось объяснить, выдвинув предположение, что пациенты, предварительно настроенные на контроль за своими болями, чувствуют себя более защищенными. В то же время больные, не справляющиеся с регистрацией болей, либо же пациенты со стабильно удерживающимися болями, не проходящими при лечении, чувствуют себя заброшенными. Выдвинуто предположение, что эти ощущения усиливают состояние возбуждения. Последнее само по себе способно усилить перцепцию боли.
Визуальная аналоговая шкала
Визуальная аналоговая шкала (ВАШ) - это прямая линия длиной 10 см, концы которой соответствуют крайним степеням интенсивности боли(«нет боли» на одном конце, «мучительная нестерпимая боль» - на другом) (рис. 6- 1). Линия может быть как горизонтальной, так и вертикальной [9]. Пациенту предлагают сделать на этой линии отметку, соответствующую интенсивности испытываемых им в данный момент болей. Расстояние между концом линии («нет болей») и сделанной больным отметкой измеряют в сантиметрах и округляют. Помощь в оценке боли могут оказать пояснения, вписанные вдоль линии (например, «слабые, умеренные, тяжелые»). Различные вариации ВАШ называют графической рейтинговой шкалой[10]. Пациенты склонны группировать свои ответы в местах подобных подписей, поэтому графическая рейтинговая шкала считается менее точной.
Перед тем как пациент начнет пользоваться ВАШ(или любой другой оценочной шкалой), врач или производящий исследование должен все подробно объяснить пациенту.
Рис. 6-1. Визуальная аналоговая шкала, используемая для измерения интенсивности боли.
Применение ВАШ имеет следующие преимущества:
1)метод позволяет определить действительную интенсивность болей (проведенные исследования выявили хорошую корреляцию между данными ВАШ и другими методами измерения силы болей) [11];
2)большинство пациентов, даже дети (в возрасте 5 лет и старше) легко усваивают и правильно используют ВАШ [12];
3) использование ВАШ позволяет изучить распределение рейтинга
[13];
4)результаты исследований воспроизводимы во времени [9];
5)более адекватная оценка эффекта лечения по сравнению со словесной характеристикой боли [14].
ВАШ успешно использовали во многих исследованиях при изучении эффективности терапии.
Однако ВАШ имеет и определенные недостатки по сравнению с другими методиками. Во-первых, пациенты могут весьма произвольно ставить отметки на шкале. Часто подобные отметки не отражают действительности и не соответствуют устным оценкам болей, даваемым самими больными. Вовторых, расстояние до сделанной отметки должно быть измерено, что требует времени и точности, возможны также ошибки при измерении. В-третьих, ВАШ трудно объяснить пожилым пациентам, не улавливающим связи между линией и положением своей отметки на ней[15]. Наконец, фотокопирование иногда приводит к искажению линии, что отражается на измерении. Поэтому
ВАШ не считают оптимальным методом измерения интенсивности боли у взрослых и у пожилых больных, но рекомендуют как успешный у детей [10].
Словесная рейтинговая шкала
Словесная рейтинговая шкала представляет собой другой способ оценки вариантов и интенсивности болей. Эта шкала выглядит как список слов, из которых пациент выбирает наиболее точно отражающие его боль(«жгучие, режущие, судорожные боли»). Пациенты также обычно используют многообразные описания при объяснении степени дискомфорта. Поэтому сло-
весная рейтинговая шкала одинаково нужна как работникам медицинских учреждений, так и пациентам.
Словесная рейтинговая шкала, как и линейная цифровая шкала, облегчает оценку степени боли. В литературе описаны разные типы словесной рейтинговой шкалы, в том числе состоящие из 4 пунктов [16, 17], 5 [18, 19], 6 [3], 12 [20] и даже из 15 пунктов [21]. Слова обычно выстраивают в ряды по степени нарастания тяжести боли и последовательно нумеруют от меньшей тяжести к большей (рис. 6-2).
Использование словесной рейтинговой шкалы имеет ряд преимуществ. Ее легко применять, просто ставить отметки, она адекватно отражает состояние пациента и эффективность проводимой терапии. Данные словесной шкалы хорошо совмещаются с результатами других измерений интенсивности
