
PRKT
.pdfПри построении графиков необходимо правильно выбрать размеры листа бумаги. Обе координатные оси не должны сильно различаться в размерах. Вместе с тем всё поле графика должно быть использовано, т.е. если первое значение координаты точки сильно отличается от нуля, разметку соответствующей оси необходимо начинать с ближайшего меньшего целого значения. При этом точка пересечения координатных осей не будет соответствовать нулям на осях координат.
Координаты изображаемых точек не записываются на осях координат, где необходимо указать лишь целые значения изображаемой величины, т.е. построить шкалу этих значений. На осях должны быть указаны обозначения величин и их размерность.
Точки на графике должны быть выделены отчётливо. Если изображается несколько зависимостей, то точки каждой из них необходимо изображать разными символами. Кривую проводить плавно так, чтобы число точек, не попадающих на кривую, по разные её стороны было одинаково. Используя для построения графиков компьютер, следует не соединять точки между собой, а аппроксимировать зависимость плавной кривой, подобрав соответствующую функциональную зависимость.
Одной из наиболее удобных и распространённых программ для построения графиков функций и их обработке является компьютерная программа Origin. В настоящее время доступна седьмая версия этой программы, которая имеет незначительные отличия от предыдущей шестой версии. Изменения коснулись в основном стиля работы программы, он стал более приближен к стилю, принятому в программах Microsoft Excel и Microsoft Word. Несмотря на то, что работа в программе Origin рассматривается в курсах «Информатика» и «Новые информационные технологии» есть смысл кратко напомнить основные моменты работы с данной программой, её возможности, ограничившись при этом лишь самыми необходимыми функциями.
Программа Origin позволяет строить различные двухмерные графики в декартовой или полярной системе координат, кроме того, имеется возможность построения треугольных диаграмм (используются для описания поведения трехкомпонентных систем) и трехмерных (3D) поверхностей.
При запуске Origin сначала открывается новое окно в виде рабочего листа в рабочем пространстве Origin. Рабочий лист (рис. 1) является одним из типов окон, доступных в этой программе. В самом верху окна в строке заголовка указывается версия Origin 7 и имя проекта (в начальный момент UNTITLED – без имени), в правом верхнем углу расположены стандартные для WINDOWS элементы управления, позволяющие свернуть окно в кнопку на панели задач, свернуть в окно и закрыть приложение.
Ниже расположена стандартная для WINDOWS строка меню: File, Edit, View, Plot, Column, Analysis, Statistics, Tools, Format, Window, Help, элементы которого раскрываются после щелчка по ним мышью. Пе-
11
речень меню меняется в зависимости от того, какое окно активно. Под строкой меню расположены кнопки быстрого доступа к определенным функциям программы, например, сохранить проект (кнопка с изображением дискеты), распечатать (кнопка с изображением принтера) и т.д. Узнать назначение той или иной кнопки можно, поместив на неё указатель мыши; при этом рядом с кнопкой появляется соответствующее пояснение. Количество выводимых кнопок может меняться, в зависимости от настройки конкретной программы, а доступ к соответствующим функциям может быть осуществлен через общее меню программы.
Ещё ниже находится панель форматирования, позволяющая выбрать шрифт надписей, его начертание и размер, толщину линий.
Рис.1. Вид окна программы Origin
В основном поле окна находится Окно рабочий лист – пустая таблица со столбцами A[X] и B[Y], в каждую строку которых попарно вносятся результаты измерений. При необходимости количество столбцов может быть добавлено, для чего необходимо открыть меню Column и щелкнуть мышью по пункту Add New Columns… или, не заходя, в меню нажать комбинацию клавиш Ctrl + D (плюс в данном случае означает одновре-
12

менное нажатие указанных клавиш). В поле открывшегося окна Add New Columns указать необходимое количество добавляемых колонок.
При наборе данных с клавиатуры или их копировании из других приложений (например, Excel) необходимо помнить, что разделителем целой и дробной части числа в программе Origin является точка, а не запятая, как во многих русифицированных программах. Набор запятой в числе в качестве разделителя приводит к тому, что введенные данные воспринимаются программой как текстовые, а не числовые, без какой либо диагностики. Ввод каждого числа в ячейку заканчивается нажатием клавиши “Enter”, при этом происходит переход к следующей ячейке.
После ввода всех исходных данных необходимо построить график, для чего следует войти в меню Plot и выбрать в открывшемся перечне вариант построения графика: только линии (Line), только точки – маркеры (Skatter) или маркеры, соединенные линиями (Line + Symbol). Если планируется аппроксимировать экспериментальные данные методом наименьших квадратов, то целесообразно строить только маркеры. Если под таблицей в нижней части рабочего окна Origin открыта панель кнопок 2D Graphs, то для построения графика достаточно щелкнуть указателем мыши по соответствующей кнопке.
Открывается окно Select Columns for Plotting, в котором необходимо выбрать, какая колонка будет аргументом (ось X), какая функцией (ось Y). Для этого, щёлкнув в окне по названию колонки значений аргумента (например, A[X]), щёлкнуть по кнопке <–>X , находящейся рядом справа. Затем выбрать щелчками колонку функции (например, B[Y]) и кнопку <–>Y .После нажатия на кнопку “OK” мышью появляется окно
Graph, в котором будет построен график. Один из вариантов построения представлен на рис.2.
В рабочем окне Origin одновременно может быть отображено несколько окон, но активным может быть только одно. Для того, чтобы сменить активное окно, необходимо щелкнуть мышью по нужному окну. Любое окно может быть свернуто кнопкой и тогда оно не заслоняет другие окна, либо развернуто во всю площадь окна Origin (соответствующие элементы управления находятся в правом верхнем углу). В тех случаях, когда на одном графике представлено несколько зависимостей, для редактирования, аппроксимации, сглаживания и других типов обработки, необходимо выделить активный набор данных, для чего нужно зайти в меню “Data”, если активно окно Graph и выбрать из представленных там наборов данных.
Для аппроксимации экспериментальных данных методом наименьших квадратов необходимо выделить активный набор данных (если их несколько) и зайти в меню “Analysis”, где из списка выбрать подходящую функцию из набора, либо задать пользовательскую функцию. После выполнения расчётов выдается отчёт, в котором указывается вид функции и
13
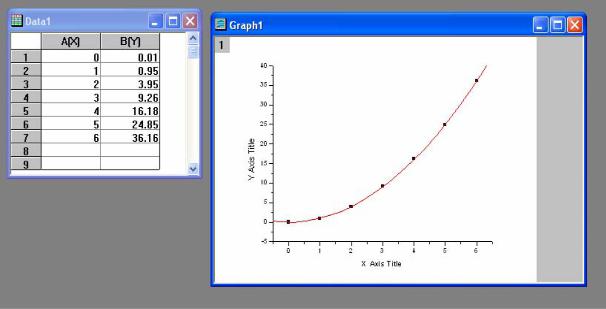
значения всех её коэффициентов. Сама аппроксимирующая кривая обычно строится красным цветом, который может быть изменен пользователем.
Рис.2
График функции, построенный в Origin, не имеет подписей под координатными осями (точнее, там указано, что это соответственно ось X и ось Y). Для изменения подписей необходимо щелкнуть по ним указателем мыши, при этом становится активной панель форматирования. После чего можно набирать на клавиатуре название осей. Необходимо помнить, что в программе Origin для перехода на русский язык недостаточно переключить клавиатуру, надо выбрать шрифт, поддерживающий кириллицу (типа “Courier New Cyr“ или другой, но обязательно Cyr). Origin позволяет в произвольном месте графика выполнить любую надпись, для этого необходимо щелкнуть по кнопке с буквой T на панели Tools и набрать текст, который можно перетащить мышью в любое место.
При сохранении информации вся работа в данной секции сохраняется, как проект Origin. Он включает в себя все окна на экране (включая также свернутые окна) а также все файлы, связанные с информацией в окнах. Кроме сохранения проектов, можно также сохранить окно или шаблон как отдельный файл.
14

1. ХИМИЧЕСКАЯ ТЕРМОДИНАМИКА
Лабораторная работа № 1.1
КАЛОРИМЕТРИЯ
Краткое теоретическое введение
Тепловым эффектом процесса называется количество теплоты Q, которое выделяется или поглощается в результате процесса, протекающего без совершения работы1. В изохорных и изобарных процессах тепловой эффект выражается соответственно через изменение внутренней энергии ∆U и энтальпии ∆Н системы. В таких случаях применим закон Гесса, в соответствии с которым тепловой эффект процесса (в том числе и химической реакции) не зависит от промежуточных стадий, а определяется лишь природой и агрегатным состоянием исходных и конечных веществ при условии, что начальная и конечная температуры одинаковы. Поскольку чаще процессы происходят при постоянном давлении, обычно тепловые эффекты выражаются через ∆Н, что и будет подразумеваться в дальнейшем.
Теплоёмкостью системы называется количество теплоты, поглощаемое системой при нагревании её на один градус. Изобарная и изохорная теплоёмкости выражаются соответственно как
Cp = ∆H |
∆T |
и CV = ∆U |
∆T |
. |
(1.1) |
|
|
|
|
Теплоёмкость, отнесённая к одному молю вещества, называется молярной (Ср и СV), а к одному грамму – удельной (ср и сV).
Теплоёмкости, теплоты фазовых переходов, теплоты реакций определяются обычно опытным путём. Если тепловой эффект прямым экспериментом определить нельзя (например, теплоты образования соединений из простых веществ), то его вычисляют, пользуясь результатами вспомогательных калориметрических опытов, на основании закона Гесса и его следствий.
Тепловой эффект процесса измеряют в специальном приборе – калориметре, наблюдая вызванное этим процессом изменение температуры ∆Т. Для измерений применяют калориметр с воздушной изотермической оболочкой. Выбор такого типа прибора связан с тем, что для него при наличии воздушного термостата не требуется никаких специальных установок и обеспечивается точность в определении тепловых эффектов до 2% (относительная погрешность) при изменении температуры в калориметре на 0,5 °Сиболее.
Калориметр состоит из калориметрического сосуда, в который помещается исследуемое вещество, и защитной оболочки, уменьшающей тепловое взаимодействие калориметра и исследуемого вещества с окружающей
1 Следует иметь ввиду, что термины «тепловой эффект» и «теплота процесса» не являются синонимами. Если изобарный процесс сопровождается полезной работой, то она входит в состав теплового эффекта и последний равен сумме теплоты процесса и полезной работы.
15
средой. Способы изолирования калориметра от теплового воздействия различны. Для определения тепловых эффектов при температуре от –20 до +50 °С рекомендуется применять калориметр с воздушной изотермической оболочкой, представляющий собой ящик-термостат, снабженный мотором с вентилятором, электрической лампой в качестве нагревателя, термохимическим термометром, контактным термометром и электронным реле для поддержания постоянной температуры.
Для определения тепловых эффектов при комнатной температуре допустимо использование калориметра без термостата. Однако при этом калориметрическая установка должна размещаться в помещении с постоянной температурой без сквозняков и воздействия на прибор тепловых излучений. Простейший калориметр представляет собой сосуд (стакан) помещенный в достаточно массивный блок с небольшим воздушным зазором, для уменьшения теплообмена. Сверху сосуд закрывается крышкой, через которую проходит мешалка и термометр.
В калориметре температура воды вследствие испарения последней обычно ниже температуры воздуха.
Вследствие протекающих в калориметре процессов, сопровождающихся выделением или поглощением тепла, температура изменяется на величину ∆Т. Тепловой эффект процесса рассчитывается по уравнению
∆H = K∆T , |
(1.2) |
в котором К – постоянная калориметра – количество тепла, которое необходимо подвести к участвующей в теплообмене части калориметра, чтобы поднять его температуру на 1 °С. Её величина определяется массой составных частей калориметра и их удельной теплоёмкостью.
Для определения тепловой постоянной измеряют понижение температуры при растворении КCl в воде и, зная теплоту растворения этой соли, рассчитывают величину К по уравнению теплового баланса :
∆H =[(G + g)c + K ] |
M∆T |
(1.3) |
|
g |
|||
|
|
где ∆Н – молярная интегральная теплота растворения КCl (или исследуемого вещества); G – навеска воды; g – навеска КCl (или исследуемого вещества); c – теплоёмкость раствора ≈ 4,1 кДж/(град кг) , М – молекулярная масса растворяемого вещества; ∆Т – действительное изменение температуры в процессе растворения, которое находят графически.
Для определения изменения температуры служит термометр Бекмана. Особенностями этого термометра являются большая длина шкалы (примерно 5 см на 1°С) и наличие в верхней части термометра запасного резервуара с ртутью, позволяющего изменять количество ртути в рабочей части термометра и, тем, самым температурные интервалы измерения.
16
Длина капилляра от верхнего деления шкалы до запасного резервуара соответствует примерно 1,5 – 2,0 °С. Шкала термометра разделена на 5 °С (иногда на 6 °С), а каждый градус на десятые и сотые доли. Тысячные доли могут быть приближенно отсчитаны при наблюдении в лупу.
При измерении эндотермического теплового эффекта наиболее высокой будет начальная температура жидкости в калориметре. В этом случае ртуть в термометре должна находиться между третьим и пятым градусами шкалы. При измерении экзотермических тепловых эффектов низшей будет начальная температура жидкости в калориметре. При этой температуре ртуть в термометре должна находиться между нулём и вторым градусом.
Опыт начинают с подготовки термометра, погрузив его в жидкость с температурой, равной температуре жидкости в калориметре при калориметрическом измерении. Если ртуть в капилляре примет указанное выше положение, то термометр готов к работе, в ином случае он должен быть отрегулирован. Для этой цели термометр нагревают в водяной бане с температурой на 2 – 3 °С выше температуры жидкости в калориметре при измерении эндотермических тепловых эффектов или на 6 – 7 °С выше температуры калориметрической жидкости при измерении теплот экзотермических процессов. При этом ртуть не только заполнит весь капилляр термометра, но и войдёт в верхнюю часть запасного резервуара. Выдержав термометр в бане 2–3 мин, вынимают его и резким толчком отрывают излишнюю ртуть от верхней части капилляра. Встряхивание термометра для отрыва ртути нужно производить осторожно, чтобы не разбить термометр. При последующем охлаждении до температуры жидкости в калориметре уровень ртути окажется в нормальном для работы положении.
Если при погружении термометра в баню, имеющую температуру калориметрической жидкости, уровни ртути в капилляре будут ниже третьего или нулевого делений, то это означает, что в рабочей части термометра содержится недостаточное количество ртути.
Для переноса недостающего количества ртути из запасного резервуара в рабочую часть термометр переворачивают запасным резервуаром вниз и, встряхнув его, переводят часть ртути из нижнего резервуара в верхний к соединительному капилляру. Здесь она при осторожном возвращении термометра в нормальное положение удерживается силами поверхностного натяжения. Затем, нагревая шарик термометра (рукой или в бане), соединяют ртутный столбик термометра с ртутью в верхнем резервуаре. После этого термометр погружают в баню с соответствующей температурой и производят установку, как описано выше.
Определение действительного изменения температуры
вкалориметрических опытах
Входе калориметрического опыта, проводимого в изотермическом калориметре, происходит теплообмен с окружающей средой, следствием чего являются тепловые потери в окружающую среду. Поэтому разница
17
между температурами начала и конца изучаемого процесса обычно отличается от изменения температуры процесса, определённого в условиях, исключающих тепловые потери. Определить действительное значение по данным, полученным в результате калориметрического опыта, проведённого в изотермическом калориметре, можно двумя способами: аналитическим и графическим. Графический метод определения более прост, по точности не уступает аналитическому и позволяет с большей наглядностью судить об особенностях протекания процесса.
Получение температурных данных В калориметре, подготовленном для проведения измерений, создают
равномерную скорость изменения температуры (ход температуры калориметра), не превышающую 0,02 град/мин, нагрев (или охладив) его до температуры, близкой к температуре термостата и обеспечив быстрое выравнивание температуры во всех точках прибора перемешиванием. После этого начинают запись температур с точностью до 0,002 °С через каждые 30 секунд. Производят десять – одиннадцать отсчётов (начальный период). На одиннадцатом отсчёте начинают термохимический опыт, не прерывая записи температур (главный период).
По окончании главного периода опыта, когда ход температуры снова станет равномерным, делают ещё десять – одиннадцать отсчётов (конечный период), после чего считают опыт законченным. Если во время проведения опыта не был произведён отсчёт очередного показания термометра, то следует прочеркнуть пропущенный отсчёт и записать следующий не вместо пропущенного, а на своё место, под своим порядковым номером. Это необходимо для правильного вычисления изменения температуры с учётом теплообмена с окружающей средой.
Обработка полученных данных На миллиметровой бумаге в масштабе 1 мин в 1 см на оси абсцисс
откладывают время, а температуру – на оси ординат, выбор масштаба которой зависит от величины ∆Т. При ∆Т < 1°С один градус соответствует 10 см и 5 см при ∆Т > 1°С (рис. 1.1). Если ∆Т велико, то на оси температур в интервале главного периода можно сделать разрыв.
После того как на график нанесены все экспериментальные точки, получается кривая АСВD. Участок АС соответствует начальному периоду, ВС – главному, ВD – конечному. Чтобы определить действительное изменение температуры ∆Т, не искажённое тепловым обменом, происходящим в течение главного периода, продолжают линии АС и ВD до пересечения с вертикальной прямой ЕF. Положение линии ЕF находится построением. Для этого точки С и В, отвечающие начальной и конечной температуре главного периода, проецируют на ось ординат. Через середину полученного отрезка тп проводят прямую линию kp. Пересечение этой линии с кривой ВС даёт точку l, определяющую положение вертикальной прямой EF.
18
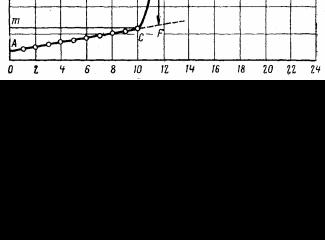
Отрезок EF и будет действительным изменением температуры системы. Характер линии ВС зависит от условий протекания теплового процесса (например, от размешивания), наклон линий АВ и СD зависит от характера теплообмена с окружающей средой. Таким образом, по виду кривой ABCD можно судить о качестве проведённого опыта.
Рис. 1.1. Определение действительного изменения температуры в ходе калориметрического опыта
Для получения надёжных результатов калориметрические опыты следует повторять три – четыре раза, причём желательно, чтобы
начальные температуры всех повторных опытов различались не более, чем на 0,1 °С (при ∆Т ≥ l °С).
Выполнение работы
Тепловой эффект, сопровождающий растворение твёрдого или газообразного вещества в жидкости, отнесённый к 1 моль растворяемого вещества, называют молярной теплотой растворения. Тепловой эффект, отнесённый к 1 г вещества, называется удельной теплотой растворения. Различают интегральную теплоту растворения – тепловой эффект, сопровождающий процесс растворения одного моля (молярная) или одного грамма (удельная) вещества в данном количестве растворителя, и дифференциальную теплоту растворения – тепловой эффект, сопровождающий процесс растворения одного моля вещества в бесконечно большом количестве раствора. Дифференциальные теплоты растворения определяют методом расчёта, а интегральные теплоты растворения – экспериментально.
В данной работе следует определять тепловую постоянную калориметра при данной температуре термостата и теплоту растворения CuSO4٠xH2O в400 млводыпритойжетемпературе.
Определение тепловой постоянной калориметра
1.Отвесить в калориметрический стакан около 400 г дистиллированной воды с точностью до 0,01 г.
2.Установить отрегулированный термометр Бекмана таким образом, чтобы ртутный резервуар термометра был закрыт водой, но находился выше лопастей мешалки.
19
3.Пустить мешалку, постепенно увеличивая скорость вращения, но не доводя до разбрызгивания воды. Скорость вращения должна быть одинакова во всех опытах.
4.Не дожидаясь установления режима всей калориметрической установки, взвесить в пробирке на аналитических весах 4 г кристаллов KCl с
точностью до 0,001 г. Осторожно! Пробирка имеет очень тонкое дно!
5.После взвешивания пробирку вставить в отверстие в крышке калориметрической установки так, чтобы дно пробирки с кристаллами KCl находилось в воде. Подождать 10 – 15 минут, пока температура кристаллов не сравняется с температурой воды в калориметрическом стакане.
6.Проверить скорость изменения температуры воды в калориметре, которая не должна превышать 0, 02 град/мин. Если же скорость изменения температуры не превышает 0,02 град/мин, то следует начать калориметрические измерения, не прекращая записи температуры и времени.
7.Записывать показания термометра Бекмана с точностью 0,002 °С через каждые 30 сек. После одиннадцатого отсчёта пробойником разбить ампулу. В процессе растворения КСl (главный период) температура воды в калориметрическом сосуде падает, а затем начинает равномерно расти, приближаясь к температуре окружающей среда. Отсчётом температуры, с которой начинается её равномерное повышение, кончается главный период опыта и начинается конечный. Для конечного периода сделать ещё десять измерений температуры. Нанести на график полученные данные и, опре-
делив графически значение ∆Т, рассчитать величину К калориметрического сосуда из уравнения (1.3).
После того как найдена величина К, можно приступить к определению теплоты растворения кристаллогидрата с целью определения содержания кристаллизационной воды.
Определение содержания кристаллизационной воды в CuSO4 xH2O
Сульфат меди CuSO4 образует три формы кристаллогидратов: CuSO4٠H2O, CuSO4٠3H2O, CuSO4٠5H2O:
CuSO4٠H2O CuSO4 + H2O |
(1.А) |
||
CuSO4 |
٠3H2O CuSO4 |
٠H2O + 2H2O |
(1.В) |
CuSO4 |
٠5H2O CuSO4 |
٠3H2O + 2H2O |
(1.С) |
Если безводный CuSO4 соприкасается с влажным воздухом, то в системе устанавливаются равновесия (1.А), (1.В) или (1.С), в зависимости от давления водяных паров в системе. Количество воды в твёрдом CuSO4٠xH2O или соотношение количеств гидратов разных форм можно установить калориметрически. Для этого нужно знать (из справочника) теплоты растворения безводного CuSO4 и всех форм гидратов и определить экспериментальную теплоту растворения 1 г исследуемого образца.
20
