
Лекція № 8. Фізико-хімічні методи очистки стічних вод
План
Загальні положення
Коагуляція і флокуляція
Флотація
Адсорбція
Іонний обмін
Екстракція
Зворотній осмос і ультрафільтрація
Загальні положення
До фізико-хімічних методів очищення стічних вод належать коагуляція, флотація, адсорбція, іонний обмін, екстракція, ректифікація, випарювання, дистиляція, зворотний осмос і ультрафільтрація, кристалізація, десорбція й ін. Ці методи використовують для видалення зі стічних вод тонкодисперсних плаваючих частинок (твердих і рідких), розчинних газів, мінеральних і органічних речовин.
Застосування фізико-хімічних методів для очищення стічних вод порівняно з біохімічними має ряд переваг:
можливість видалення зі стічних вод токсичних, біохімічних органічних забруднень, що не окисляються;
досягнення більш глибокого і стабільного ступеня очищення;
менші розміри споруд;
менша чутливість до змін навантажень;
можливість повної автоматизації;
більш глибока вивченість кінетики деяких процесів, а також питань моделювання, математичного опису й оптимізації, що важливо для правильного вибору і розрахунку апаратури;
методи, не пов’язані з контролем за діяльністю живих організмів;
можливість рекуперації різних речовин.
Вибір того або іншого методу очищення (або декількох методів) роблять з урахуванням і технологічних вимог, пропонованих до очищених виробничих стічних вод з метою подальшого їхнього використання, а також з урахуванням кількості стічних вод і концентрації забруднень у них, наявності необхідних матеріальних і енергетичних ресурсів і економічності процесу.
Коагуляція і флокуляція
Коагуляція - це процес укрупнення дисперсних частинок в результаті їхньої взаємодії й об’єднання в агрегати. В очистці стічних вод її застосовують для прискорення процесу осадження тонкодисперсних домішок і емульсійних речовин.
Коагуляція найбільш ефективна для видалення з води колоїдно-дисперсних частинок, тобто частинок розміром 1-100 мкм. Коагуляція може відбуватися самовільно або під впливом хімічних і фізичних процесів. У процесах очищення стічних вод коагуляція відбувається під впливом добавок до них спеціальних речовин - коагулянтів. Коагулянти у воді утворюють пластівці гідроксидів металів, що швидко осідають під дією сили ваги. Пластівці мають здатність вловлювати колоїдні і плаваючі частинки. Оскільки колоїдні частинки мають слабкий негативний заряд, а пластівці коагулянтів - слабкий позитивний заряд, то між ними виникає взаємне притягання. Для колоїдних частинок характерне утворення на їх поверхні подвійного електричного шару. Одна частина подвійного електричного шару фіксована на поверхні поділу фаз, а інша створює хмару іонів, тобто одна частина подвійного шару є нерухливою, а інша - рухливою (дифузійний шар). Різниця потенціалів, що виникає між нерухливою і рухливою частинами шару (в об’ємі рідини), називається дзега-потенціалом або електрокінетичним потенціалом, відмінним від термодинамічного потенціалу Е, який являє собою різницю потенціалів між поверхнею частинок і рідиною. Дзета-потенціал залежить як від Е, так і від товщини подвійного шару. Його значення визначає величину електростатичних сил відштовхування частинок, які запобігають злипанню частинок одна за одною. Малий розмір колоїдних частинок забруднень і негативний заряд, розподілений на поверхні цих частинок, обумовлюють високу стабільність колоїдної системи.
Щоб викликати коагуляцію колоїдних частинок, необхідно знизити величину їхнього дзета-потенціалу до критичного значення додаванням іонів, що мають позитивний заряд. Таким чином, при коагуляції відбувається дестабілізація колоїдних частинок внаслідок нейтралізації їхнього електричного заряду. Ефект коагуляції залежить від валентності іона коагулянта, що несе заряд, протилежний знаку заряду частинок. Чим вища валентність, тим ефективніше відбувається коагуляція [27].
Для початку коагуляції частинки повинні наблизитися одна до одної на відстань, при якій між ними діють сили взаємопритягання і хімічної спорідненості. Зближення частинок відбувається в результаті броунів- ського руху, а також при ламінарному або турбулентному русі потоку води.
Дія солей, які коагулюють, є результатом гідролізу, що відбувається слідом за розчиненням.
Процес гідролізу коагулянтів і утворення пластівців відбувається за наступними стадіями:

Ме3 + + НОН ↔Ме(ОН)з+ ЗH+ . (8.4)
Насправді процес гідролізу протікає значно складніше, іон металу утворює ряд проміжних сполук у результаті реакцій з гідроксидами- іонами і полімеризації. Сполуки, що утворюються, мають позитивний заряд і легко адсорбуються негативно зарядженими колоїдними частками.
Як коагулянти використовують солі алюмінію, заліза або їхньої суміші. Вибір коагулянта залежить від його сполуки, фізико-хімічних властивостей і вартості, концентрації домішок у воді, від рН і сольової сполуки води.
Як коагулянти використовують сульфат алюмінію Аl2(S04)3 ∙ 18НгО; алюмінат натрію NаАl2; гідроксохлорид алюмінію Аl2(ОН)5Сl; тетра- оксосульфати алюмінію-калію й алюмінію-амонію [квасці - алюмок- лейові КА1(S04)2-12Н20 і аміачні NН4Аl(S04)2 - 12Н20]. Найбільш розповсюджений з них сульфат алюмінію, що ефективний в інтервалі значень рН 5-7,5. Він добре розчинний у воді і має відносно низьку вартість. Його застосовують у сухому вигляді або у вигляді 50 %-го розчину. При коагулюванні сульфату алюмінію він взаємодіє з гідрокарбонатами, що є у воді:
A12(S04)з + 3Са(НС03)2 ↔ 2АІ(ОН)3 ↓ +3СаSО4 + 6С02. (8.5)
Алюмінат натрію застосовують у сухому вигляді або у вигляді 45 %-го розчину. Він є лужним реагентом, при рН 9,3-9,8 утворить швидкоосаджені пластівці. Для нейтралізації надлишкової лужності можна використовувати кислоти або димові гази, що містять С02:
2NaAl2 + С02 + 3Н20 ↔ АІ(ОН)3 + NaС03 (8.6)
У більшості випадків використовують суміш NаАl2 + А1(S04)3 у співвідношенні (10:1)—(20:1):
6NаАl2 + Al2(S04)з +12H2О↔ 8АІ(ОН)3 + 3Na2SO4. (8.7)
Спільне вживання цих солей дає можливість підвищити ефект освітлення, збільшити щільність і швидкість осадження пластівців, розширити оптимальну область рН і середовища.
Оксихлорид алюмінію має меншу кислотність і тому придатний для очищення слаболужних вод; через високий вміст у ньому водорозчинного алюмінію прискорюється пластоутворення і осадження коагульованої суспензії, яка відбувається за реакцією:
2А12(ОН)5Сl + Са(НСО3)2 ↔ 4АІ(ОН)3 + СаС12 + 2СО2 (8.8)
Із солей заліза як коагулянти використовують сульфати заліза Fе2(304)∙2Н20, Fe(S04)3ЗH2O і FeS04 -7НгО, а також хлорне залізо FеС13. Найбільше освітлення відбувається при використанні солей трьохвалентного заліза. Хлорне залізо застосовують у сухому вигляді або у вигляді 10-15 %-х розчинів. Сульфати використовують у вигляді порошків. Доза коагулянту залежить від рН стічних вод. Для Fе3 + рН дорівнює 6-9, а для Fе2+ рН 9,5 і вище. Для підлужування стічних вод використовують NaОН і Са(ОН)2. Утворення пластівців протікає за реакціями:
FeClз + ЗН20 → Fе(ОН)з + ЗНСІ, (8.9)
Fe2 (S04)3 +6Н20→ 2Fе(ОН)3 + ЗH2S04, (8.10)
при підлужуванні:
2FеС13 + ЗСа(ОН)2 → 2Fе(ОН)3+ЗСаС12, (8.11)
Fе2(S04)3+ЗСа(0Н)2 → 2Fе(ОН)3 +ЗСаS04. (8.12)
Солі заліза як коагулянти мають ряд переваг перед солями алюмінію: краща дія при низьких температурах води; ширша область оптимальних значень рН-середовища; велика міцність і гідравлічна грубість пластівців; можливість використовувати для вод з більш широким діапазоном сольової сполуки; здатність усувати шкідливі запахи і присмаки, обумовлені присутністю сірководню. Однак наявні і недоліки: утворення при реакції катіонів заліза з деякими органічними сполуками сильного зафарбовування розчинних комплексів; сильні кислотні властивості, що підсилюють корозію апаратури; менш розвинута поверхня пластівців [26].
При використанні сумішей Аl2(SО4)3 і FеСl3 у співвідношеннях від 1:1 до 1:2 досягається кращий результат коагулювання, ніж при роздільному використанні реагентів. Відбувається прискорення осадження пластівців. Крім названих коагулянтів, для обробки стічних вод можуть бути використані різні глини, алюміновмісні відходи виробництва, правильні розчини, пасти, суміші, шлаки, що містять діоксид кремнію.
Оптимальну дозу реагенту встановлюють на підставі пробного коагулювання.
Швидкість коагуляції залежить від концентрації електроліту. У загальному вигляді ця залежність показана на рис. 8.1.
При малих концентраціях електроліту ефективність зіткнень частинок, тобто відношення числа зіткнень, що закінчилися злипанням, до загального числа зіткнень, близька до нуля (ψ = 0). У міру росту концентрації швидкість коагуляції збільшується, але не всі зіткнення ефективні - таку коагуляцію називають повільною. При ψ = 1 настає швидка коагуляція, при якій усі зіткнення частинок закінчуються утворенням агрегатів.
Рис.
8.1. Залежність відносної швидкості
коагуляції від концентрації електроліту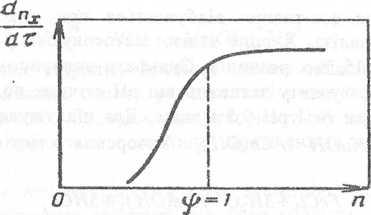
У полідисперсних системах коагуляція відбувається швидше, ніж у монодисперсних, тому що великі частинки при осіданні захоплюють за собою дрібніші. Форма частинок також впливає на швидкість коагуляції. Наприклад, подовжені частинки коагулюють швидше, ніж кулясті. Схема установки для очищення вод коагуляцією показана на рис. 8.2.

Рис.
8.2. Схема установки для очищення вод
коагуляцією: 1
- ємність для приготування розчинів; 2
- дозатор;
З
- змішувач; 4
- камера; 5 - відстійник
Флокуляція. Це процес агрегації плаваючих частинок при додаванні в стічну воду високомолекулярних сполук, названих флокулянтами.
На відміну від коагуляції, при флокуляції агрегація відбувається не тільки при безпосередньому контакті частинок, але й в результаті взаємодії молекул адсорбованого на частинках флокулянта.
Флокуляцію проводять для інтенсифікації процесу утворення пластівців гідроксидів алюмінію і заліза з метою підвищення швидкості їхнього осадження. Використання флокулянтів дозволяє знизити дози коагулянтів, зменшити тривалість процесу коагуляції і підвищити швидкість осадження утворених пластівців.
Для очищення стічних вод використовують природні і синтетичні флокулянти. До природних флокулянтів відносять крохмаль, декстрин ефіри, целюлози й ін. Активний діоксид кремнію хSі2O-уН20 є найбільш розповсюдженим неорганічним флокулянтом. Із синтетичних, органічних флокулянтів найбільше застосування в нашій країні одержав поліакриламід [СН2-СН-СОNН3]п, технічний (ПАА) і гідролізований поліакриламід (ГПАА). Технічний поліакриламід ПАА одержують при взаємодії акрилонітрилу із сірчаною кислотою з наступною полімеризацією акриламіду. Гідролізований поліакриламід одержують омиленням технічного ПАА лугом.
При виборі сполуки і дози флокулянта враховують властивості його макромолекул і природу дисперсних частинок. Оптимальна доза ПАА для очищення промислових стічних вод коливається в межах 0,4-1 г/м3. ПАА діє в широкому діапазоні рН середовища. Однак швидкість осадження сфлокульованих пластівців при рН > 9 зменшується.
Механізм дії флокулянтів заснований на наступних явищах:
адсорбції молекул флокулянта на поверхні колоїдних частинок ретикуляції (утворення сітчастої структури) молекул флокулянта;
злипанні колоїдних частинок за рахунок сил Ван дер Вальса.
При дії флокулянтів між колоїдними частинками утворюються тривимірні структури, здатні до більш швидкого і повного відділення від рідкої фази. Причиною виникнення таких структур є адсорбція макромолекул флокулянта на декількох частинках з утворенням між ними полімерних містків. Колоїдні частинки заряджені негативно, що сприяє процесу взаємної коагуляції з гідроксидом алюмінію або заліза. При додаванні активованого силікату в 2-3 рази збільшується швидкість осадження і підвищується ефект освітлення.
Поліакриламід випускається у вигляді 7-9 %-го гелю, який твердне при температурі нижче 273 °К. При додаванні ПАА до води її в’язкість різко зростає.
Процес очищення стічних вод коагуляцією і флокуляцією складається з наступних стадій: дозування і змішування реагентів зі стічною водою; пластівцеутворення й осадження.
Для змішування коагулянтів з водою застосовують гідравлічні і механічні змішувачі. У гідравлічних змішувачах змішування відбувається внаслідок зміни напряму руху і швидкості потоку води. Схема одного зі змішувачів показана на рис. 8.3.
У механічних змішувачах-апаратах зі змішувачем процес перемішування повинен бути рівномірним і повільним, щоб частки при зближенні утворювали пластівці, що не руйнувалися б при обертанні змішувача.
Після змішування стічних вод з реагентами воду спрямовують у камери пластівцеутворення. Використовують перегородчасті, вихрові і з механічними змішувачами камери. Утворення пластівців у камерах відбувається за 10-30 хв.
Вона являє собою резервуар, розділений перегородками на ряд послідовни коридорів, через які проходить вода. Швидкість води в коридорах приймають за 0,2-0,3 м/с.
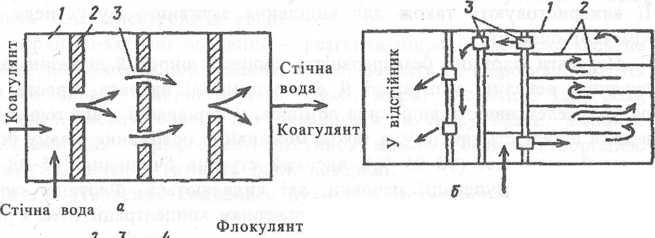
Рис. 8.3. Апарати для коагуляції: а - перегородчастий змішувач: 1 - коридор; 2 - перегородка; З - вікно; б - перегородчаста камера для утворення пластівців: 1 - коридор; 2 - перегородки; 3 - вікно; в - коагулятор-освіт- лювач: 1 - корпус; 2 - жолоб; 3 - отвір для видалення освітленої води; 4 - повітровідділювач; 5 - центральна труба; б - розподільні труби
Осадження пластівців відбувається у відстійниках і освітлювачах, конструкції яких описані у сьомому розділі. Часто стадії змішування, коагулювання й осадження проводять в одному апараті.
Стічна вода, змішана з коагулянтом, по трубі надходить у повітро- розподілювач. Потім вода рухається по центральній трубі до розподільних труб, що закінчуються соплами для розподілу й обертання води в кільцевій зоні, куди вводять флокулянт. Пластівці коагулянта утворюються в кільцевій зоні.
Плаваючі з пластівцями частки осідають на дно і видаляються з апарата. Освітлена вода через отвір потрапляє в жолоб, звідкіля її направляють на використання.
