
Laboratorki_po_khimii / 10
.doc
4 Лабораторная работа №10
Гидролиз солей
Цель работы: изучить свойства водных растворов солей, связанные с реакцией гидролиза.
Оборудование и реактивы: штативы с пробирками, спиртовка, держатель для пробирок, индикаторы: фенолфталеин, метиловый оранжевый, лакмус, универсальная индикаторная бумага с цветной шкалой значений рН, 0,1М растворы NaCl, Na2SO4, Na2CO3, Na2SO3, CH3COO(NH4), (NH4)2SO4; 1н. растворы ZnCl2, Al2(SO4)3, FeCl3, дистиллированная вода, цинк.
4.1 Теоретические пояснения
Гидролиз соли – это обменная реакция между водой и растворенной в ней солью, в результате которой образуются слабые электролиты.
Необходимо сделать следующее замечание. Малорастворимые гидроксиды, такие как Al(OH)3, Cu(OH)2, Ni(OH)2 и другие, в строгом смысле слова отнести к слабым электролитам нельзя. Из-за малой растворимости их водные растворы сильно разбавлены, и растворенные частицы подвергаются полной диссоциации. Но и к сильным электролитам эти вещества также нельзя отнести из-за ничтожной концентрации ионов в растворе. Однако, для простоты, при рассмотрении гидролиза солей говорят, например, что соль ZnCl2 образована катионом слабого основания и анионом сильной кислоты.
Плохо растворимые соли гидролизу практически не подвергаются.
В большинстве случаев гидролиз – это обратимая реакция. Необратимо гидролизуются соли, образованные катионом очень слабого основания и (или) анионом очень слабой кислоты, когда продукты гидролиза уходят из сферы реакции, например
Al2S3 + 6 H2O 2Al(OH)3 + 3 H2S.
Гидролиз – это реакция, обратная реакции нейтрализации: а) слабой кислоты сильным основанием, б) слабого основания сильной кислотой, в) слабого основания слабой кислотой.
Соли, образованные катионом сильного основания (гидроксиды щелочных и щелочноземельных металлов) и анионом сильной кислоты (HCl, HBr, HI, H2SO4, HNO3, HClO4 и другие) в обычных условиях гидролизу не подвергаются, так как не происходит образования слабого электролита, и реакция нейтрализации сильной кислоты сильным основанием необратима.
При составлении ионно-молекулярных уравнений гидролиза следует помнить, что малодиссоциированные, малорастворимые и газообразные вещества записываются в молекулярной форме, а сильные электролиты в виде составляющих их ионов. Уравнения реакций гидролиза солей слабых многоосновных кислот и слабых многокислотных оснований записываются по ступеням.
Гидролиз солей часто, но не всегда, сопровождается изменением реакции среды раствора, которая характеризуется значением водородного показателя рН, равного взятому с обратным знаком десятичному логарифму от концентрации (более строго,от активности) водородных ионов, выраженной в моль/л:
рН= - lgH+ (4.1)
В нейтральных растворах рН=7, в кислых - рН 7, в щелочных - рН 7.
Если соль гидролизу не подвергается, то реакция среды ее водного раствора нейтральная.
Для определения рН раствора используются кислотно-основные индикаторы или их смеси (универсальный индикатор), изменяющие свою окраску в зависимости от рН среды. Сведения о некоторых наиболее распространенных индикаторах приводятся в таблице 4.1.
Таблица 4.1 – Кислотно-основные индикаторы
|
Индикатор |
рН |
Окраска индикатора |
|
Метиловый оранжевый |
менее 3,1 3,1 – 4,4 более 4,4 |
красный оранжевый желтый |
|
Лакмус |
менее 6,0 6,0 – 8,0 более 8,0 |
красный фиолетовый синий |
|
Фенолфталеин |
менее 8,2 8,2 – 10,0 более 10,0 |
бесцветный розовый малиновый |
Индикаторный метод определения рН – ориентировочный. Его нельзя использовать, если растворы мутные или окрашенные. Кроме того, возникают индикаторная, солевая, температурная ошибки. Более точно измерить рН раствора можно при помощи прибора рН-метра. Он представляет собой разновидность потенциометра. Определение рН раствора основано на измерении ЭДС гальванического элемента, составленного из стеклянного электрода (его потенциал зависит от рН среды) и, чаще всего, хлорсеребряного электрода, помещенных в исследуемый раствор. ЭДС системы регистрируется милливольтметром. Так как ЭДС зависит от рН раствора, то шкалу прибора градуируют непосредственно в единицах рН.
Различают три случая гидролиза солей.
-
Соли, образованные катионом сильного основания и анионом слабой кислоты, подвергаются гидролизу по аниону. Так, например, гидролизуются соли: KCN, Na2SO3, K2CO3, CH3COONa, NaClO и другие. В результате гидролиза появляется избыточное количество ионов ОН--. В растворах таких солей щелочная реакция среды.
-
Соли, образованные катионом слабого основания и анионом сильной кислоты, гидролизуются по катиону, например, MgCl2, AlCl3, NH4NO3, CuSO4 и другие. В водных растворах таких солей кислая реакция среды.
-
Соли, образованные катионом слабого основания и анионом слабой кислоты, гидролизуются как по катиону, так и по аниону. Реакция среды в растворах таких солей может быть либо нейтральной, либо слабокислой, либо слабощелочной в зависимости от соотношения величин констант диссоциации образующихся в результате гидролиза слабой кислоты и слабого основания.
Кислые соли слабых кислот также подвергаются гидролизу. Однако в этом случае наряду с гидролизом происходит диссоциация кислотного остатка. Если константа гидролиза (смотри далее) больше константы диссоциации кислотного остатка, то преобладает гидролиз, и реакция среды щелочная (раствор NaHCO3). Если константа диссоциации кислотного остатка больше константы гидролиза, то преобладает диссоциация, и реакция среды кислая (раствор NaHSO3).
Рассмотрим количественные характеристики гидролиза. К ним относятся константа и степень гидролиза.
Запишем в общем виде сокращенное ионно-молекулярное уравнение реакции гидролиза соли, образованной сильным основанием и слабой кислотой (гидролиз идет по аниону):
А-- + Н2О→НА + ОН--
Принимая для упрощения, что в разбавленных растворах активность ионов мало отличается от их концентрации, запишем константу равновесия для этого процесса:
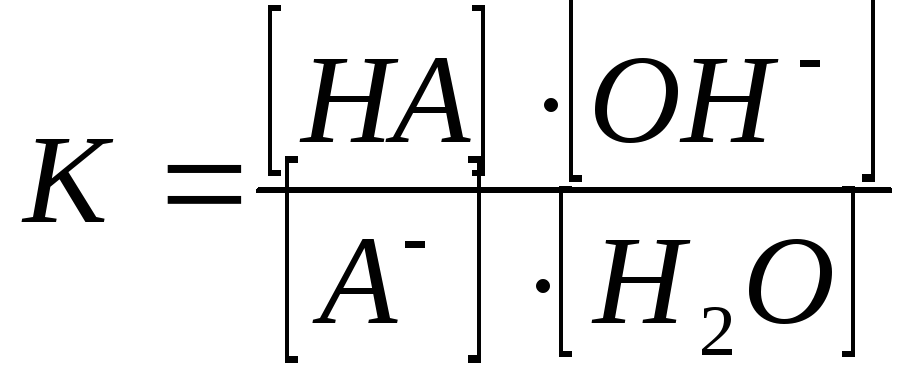 .
.
Так как концентрация воды при гидролизе изменяется очень мало, то, принимая ее постоянной и умножив на ее величину константу равновесия К, получим другую постоянную, называемую константой гидролиза КГ:
![]() . (4.1)
. (4.1)
Умножив числитель и знаменатель этого выражения на равновесную концентрацию ионов водорода, получим:
![]() , (4.2)
, (4.2)
где ![]() – ионное произведение воды, равное
10-14
при 220С;
– ионное произведение воды, равное
10-14
при 220С;
Ккис. – константа диссоциации слабой кислоты.
Аналогичным образом выводятся выражения для констант гидролиза и при других случаях гидролиза солей.
Чем больше константа гидролиза, тем сильнее гидролизуется соль.
Степенью гидролиза называется величина, равная отношению концентрации прогидролизованной соли к исходной концентрации соли, выраженной в моль/л:
![]() . (4.3)
. (4.3)
Таблица 4.2 – Количественные характеристики гидролиза
|
Тип соли |
КГ |
h |
Н+ |
|
Соль образована слабым основанием и сильной кислотой |
|
|
Ссолиh |
|
Соль образована слабой кислотой и сильным основанием |
|
|
|
|
Соль образована слабым основанием и слабой кислотой |
|
более точно
|
|
|
Кислая соль слабой двухосновной кислоты |
|
|
|
В обычных условиях преобладает гидролиз по первой ступени. Для более глубокого протекания гидролиза необходимо повысить температуру (гидролиз, как правило, эндотермический процесс, и при повышении температуры константа гидролиза возрастает); ввести в раствор соли реактив, связывающий образующиеся в результате гидролиза ионы Н+ или ОН-; разбавить раствор.
При сливании растворов солей, одна из которых гидролизуется по катиону, а другая по аниону, происходит связывание ионов:
Н+ + ОН-- = Н2О.
Это приводит к смещению равновесия гидролиза в сторону продуктов гидролиза. Происходит взаимное усиление гидролиза солей вплоть до образования конечных продуктов гидролиза. Например,
2 CrCl3 + 3 Na2CO3 + H2O = 2 Cr(OH)3 + 6 NaCl + 3 CO2
2Cr3+ + 3 CO32-- + 3 H2O = 2 Cr(OH)3+ 3 CO2
Ортогидроксид хрома тут же теряет воду, превращаясь в метагидроксид:
Cr(OH)3 = CrO(OH) + H2O.
Таблица 4.3 – Константы электролитической диссоциации некоторых слабых электролитов в водных растворах при 25 0С
|
Электролит |
К |
Электролит |
К |
|
Cu(OH)2
HNO2
Pb(OH)2
NH4OH
H2CO3
HCN |
K2=10-7
K=4,610-4
K2=310-8
K=1,810-5
K1=4,510-7 K2=4,710-11
K =7,910-10 |
H3PO4
H2S
Zn(OH)2
CH3COOH |
K1=7,110-3 K2=6,310-8 K3=5,010-13
K1=10-7 K2=410-14
K1=10-5 K2=510-7
K=1,810-5
|
4.2 Методика проведения опытов
4.2.1 Налить в пробирки по 2 мл 0,1М растворов хлорида натрия, сульфата натрия, карбоната натрия, сульфита натрия, ацетата аммония, сульфата аммония, хлорида цинка. Какие из перечисленных солей будут подвергаться гидролизу? Написать молекулярные и ионно-молекулярные уравнения реакций гидролиза по всем ступеням. Сделать заключение о реакции среды в растворах указанных солей. Выбрав нужный индикатор, проверить правильность заключения на опыте.
Пользуясь величинами соответствующих констант диссоциации (см. таблицу 4.3), вычислить константу и степень гидролиза, а также рН 0,1 М растворов карбоната натрия и хлорида цинка (рассмотреть гидролиз только по первой ступени).
Результаты наблюдений и расчетов занести в таблицу 4.4.
Таблица 4.4 – Результаты опыта 4.2.1
|
Вещество и его концент-рация в растворе |
Результаты наблюдений |
Результаты вычислений для Na2CO3 иZnCl2 |
|||
|
Индикатор и его окраска |
Реакция среды |
КГ |
h |
pH |
|
|
|
|
|
|
|
|
4.2.2 Налить в пробирку 2 мл 1н. раствора хлорида цинка. Какова реакция среды раствора? В раствор поместить кусочек цинка, содержимое пробирки нагреть. Какой газ выделяется? Какова роль нагревания? Написать уравнения реакций.
4.2.3 К 2 мл 1н. раствора сульфата алюминия добавить такой же объем 1н. раствора карбоната натрия. Какой осадок образуется? Обратить внимание на выделение пузырьков газа. Написать уравнение процесса с учетом взаимного усиления гидролиза при смешивании растворов указанных солей.
4.2.4 Налить в пробирку 2 мл 1н. раствора хлорида железа (III). Нагреть раствор до кипения. Что наблюдается? Как влияет нагревание на глубину протекания гидролиза? Написать уравнения гидролиза в молекулярной и ионно-молекулярной форме по трем ступеням.
4.3 Примеры решения задач
Пример 1
Написать молекулярные и ионно-молекулярные уравнения гидролиза сульфита калия K2SO3.
Ответ
Соль образована катионом сильного основания и анионом слабой двухосновной кислоты. Гидролиз идет по аниону. В растворе щелочная реакция среды.
1 ступень: K2SO3 + H2OKHSO3 + KOH
SO32- + H2OHSO3-- + OH—
2 ступень: KHSO3 + H2OH2SO3 + KOH
HSO3-- + H2OH2SO3 + OH--
Пример 2
Написать молекулярные и ионно-молекулярные уравнения гидролиза нитрата свинца (II).
Ответ
Соль образована катионом слабого двухкислотного основания и анионом сильной кислоты. Гидролиз идет по катиону. Раствор имеет кислую реакцию среды.
1 ступень: Pb(NO3)2 + H2O (PbOH)NO3 + HNO3
Pb2+ + H2OPbOH+ + H+
2 ступень: (PbOH)NO3 + H2O Pb(OH)2 + HNO3
PbOH+ + H2OPb(OH)2 + H+
Образовавшийся гидроксид затем может полимеризоваться с одновременным отщеплением части воды:
6Pb(OH)2 →Pb6O4(OH)4 + 4H2O.
Пример 3
Написать уравнение гидролиза цианида аммония NH4CN. Какова реакция среды в водном растворе этой соли?
Ответ
Соль образована катионом слабого основания и анионом слабой кислоты, поэтому гидролиз идет как по катиону, так и по аниону:
NH4CN + H2ONH4OH + HCN
NH4+ + CN-- + H2ONH4OH + HCN.
Для оценки реакции среды необходимо сравнить константы диссоциации NH4OH и HCN (см. таблицу 4.3). Так как константа диссоциации гидроксида аммония больше, чем константа диссоциации синильной кислоты, то гидроксид аммония является более сильным электролитом. В растворе будут преобладать ионы ОН--, следовательно, реакция среды щелочная.
Пример 4
Учитывая только первую ступень гидролиза 0,5М раствора Na2S, рассчитайте константу гидролиза, степень гидролиза и рН среды при 220С.
Решение
Гидролизу по первой ступени соответствует следующее ионно-молекулярное уравнение:
S2-- + H2OHS-- + OH--
Константа гидролиза Na2S по первой ступени есть отношение ионного произведения воды к константе диссоциации слабой кислоты HS--:
КГ=![]() .
.
Константа диссоциации гидросульфид-иона представляет собой константу диссоциации H2S по второй ступени, ее значение можно взять из таблицы 4.3.
КГ=![]()
Степень гидролиза можно рассчитать по формуле:
h=![]() .
.
Для нахождения рН среды рассчитаем концентрацию водородных ионов:
H+=![]() .
.
![]()
4.4 Требования к уровню подготовки студентов
-
Знать понятия: гидролиз солей, константа гидролиза, степень гидролиза.
-
Уметь связывать склонность соли к гидролизу с силой кислот и оснований, образующих данную соль.
-
Иметь представление о факторах, влияющих на степень гидролиза.
-
Уметь выражать процесс гидролиза с помощью молекулярных и ионно-молекулярных уравнений, оценивать рН среды в водном растворе соли, рассчитывать величины константы и степени гидролиза.
4.5 Задания для самоконтроля
4.5.1 При хранении растворов солей гидролиз нежелателен. Что нужно сделать, чтобы ослабить гидролиз сульфата кобальта (II)?
-
Какие из перечисленных ниже солей будут подвергаться гидролизу? Написать соответствующие молекулярные и ионно-молекулярные уравнения. Рассчитать для 0,2М растворов константу гидролиза, степень гидролиза и рН среды, учитывая только первую ступень гидролиза.
а) K2SO4; NaClO4; Na2S; CuSO4
б) KNO3; Pb(NO3)2; (NH4)2CO3; KNO2
-
При сливании растворов Al2(SO4)3 и Na2S выпадает белый осадок и ощущается неприятный запах. Объясните причину этого, приведя соответствующие уравнения реакций.
-
Почему раствор NaH2PO4 имеет слабокислую, а раствор Na3PO4 – щелочную реакцию? Ответ мотивировать соответствующими уравнениями реакций и расчетами. Воспользоваться данными таблицы 4.3.
-
При смешивании каких растворов: а) FeCl3 и Na2CO3; б) Na2CO3 и BaSO4; в) FeCl3 и Na2SO4; г) FeCl3 и CuSO4 – произойдет образование малорастворимого гидроксида за счет взаимного усиления гидролиза солей?
-
Какое вещество образуется на второй ступени гидролиза (NH4)3PO4?
-
Какие из перечисленных солей гидролизуются по аниону: а) K2SiO3; б) KI; в) CaCO3; г) KCN?
-
Какое вещество образуется на второй ступени гидролиза Cr(NO3)3?
-
Для какой из перечисленных солей: а) FeCl2; б) Ba(NO3)2; в) (NH4)2CO3; г) K2S – в формулу константы гидролиза по второй ступени входит константа диссоциации основания по первой ступени?
-
Какие из перечисленных солей гидролизуются как по катиону, так и по аниону: а) SrSO4; б) CdCl2; в) K2CO3; г) (NH4)2CO3?
-
Какова величина рН среды в 0,06 М растворе HCOO(NH4), если константы диссоциации HCOOH и NH4OH равны соответственно 1,8∙10–4 и 1,8∙10–5?
-
Какие из перечисленных солей не подвергаются гидролизу: а) ZnCl2; б) KBr; в) (NH4)2S; г) AgCl?
-
Какова степень гидролиза K2Se по первой ступени в 0,02 М растворе, если константы диссоциации H2Se по первой и по второй ступени равны соответственно 1,7∙10–4 и 10–11?
-
Для какой из перечисленных солей: а) CuSO4; б) KCN; в) NaNO3; г) ZnCl2 – степень гидролиза увеличивается при добавлении в раствор кислоты?
4.6 Список рекомендуемой литературы
4.6.1 Коровин Н.В. Общая химия: Учебник для технических направ. и спец. вузов. – М.: Высш. шк., 1998. – С. 234 – 240.
4.6.2 Глинка Н.Л. Общая химия: Учебное пособие для вузов/ Под ред. А.И.Ермакова. – М.: Интеграл-Пресс, 2002. – С. 254 – 258.
4.6.3 Глинка Н.Л. Задачи и упражнения по общей химии: Учебное пособие для вузов/ Под ред. В.А.Рабиновича и Х.М.Рубиной. – М.: Интеграл-Пресс, 2002. – С. 130 – 138.
