
- •280100 Природообустройство и водопользование,
- •Рецензент:
- •Содержание
- •Введение
- •1 Лабораторная работа №1
- •Техника безопасности при работе в лаборатории общей химии
- •2 Лабораторная работа №2
- •3 Лабораторная работа №3
- •3.2 Методика проведения опытов
- •4 Лабораторная работа №4
- •4.2 Методика проведения опытов
- •5 Лабораторная работа №5
- •Пример 3
- •Решение
- •6 Лабораторная работа №6
- •Пример 1 Как повлияет на равновесие реакции
- •Решение
- •Пример 2 Вычислить константу равновесия реакции
- •Решение
- •Пример 3
- •7 Лабораторная работа №7 Приготовление растворов заданной концентрации
- •7.2.1 Опыт №1. Приготовление раствора с заданной массовой долей соли
- •Пример 1
- •Решение
- •Пример 2
- •Решение
- •Числа 2 и 6 показывают, что для приготовления 110 мл 2% раствора необходимо взять 2 весовые части 8% раствора и 6 весовых частей воды.
- •8 Лабораторная работа №8
- •10 Лабораторная работа №10
- •11 Лабораторная работа №11
- •12 Лабораторная работа №12
- •13 Лабораторная работа №13 Электрохимический ряд напряжений металлов. Коррозия металлов
- •14 Лабораторная работа №16
- •15 Лабораторная работа №15.
- •Заключение
- •Использованная литература
12 Лабораторная работа №12
Окислительно-восстановительные реакции
Цель работы: ознакомление с окислительно-восстановительными свойствами металлов, неметаллов и их соединений; освоение методики составления уравнений окислительно-восстановительных реакций.
Оборудование и реактивы: 0,1М раствор Н2SO4, 0,5н. раствор СuSO4, разбавленные растворы KMnO4 и К4[Fe(CN)6], имеющие не очень интенсивную окраску, 2М растворы КОН и NaOH, кристаллические Na2SO3 и иод, Zn, Mg, Fe (опилки), Cu (стружки), металлическая скрепка (кнопка), штатив, пробирки, держатель для пробирок, дистиллированная вода, спиртовка, спички, бромная вода.
12.1 Теоретические пояснения
Реакции, протекание которых связано со смещением или полным переходом электронов от одних атомов или ионов к другим, называются окислительно-восстановительными. Число электронов, смещенных от атома (иона) данного элемента к другим атомам (ионам) в соединении, называют степенью окисления. Степень окисления может быть положительной (электроны смещены от атома или иона) и отрицательной (электроны смещены к атому или иону).
Процесс отдачи электронов называют окислением. Степень окисления элемента при этом повышается. Вещества, отдающие электроны, называют восстановителями.
К типичным восстановителям относятся простые вещества, атомы которых характеризуются невысокой электроотрицательностью (металлы, водород, углерод), некоторые анионы (CI-, S2-, SO32- и другие), катионы, у которых степень окисления может возрастать (Fe2+, Sn2+ и другие), некоторые соединения углерода, азота, бора и другие.
Процесс присоединения электронов, то есть понижение степени окисления, называют восстановлением, а вещества, принимающие электроны, называют окислителями.
К окислителям относятся простые вещества, атомы которых характеризуются высокой электроотрицательностью (элементы VI и VII групп главных подгрупп), катионы с высокой степенью окисления (Pb+4, Cr+6, Ge+4), анионы, в которых электроположительный элемент имеет высокую степень окисления (NO3-, Cr2O72-, MnO4- и другие), высшие оксиды, а также пероксиды.
Окислительно-восстановительные реакции – это единство одновременно протекающих процессов окисления и восстановления. Реакции, в которых окислители и восстановители представляют собой разные вещества, называют межмолекулярными. Если окислителем и восстановителем служат разные атомы или ионы в составе одного и того же вещества, то такие реакции называют внутримолекулярными. В реакциях диспропорционирования (самоокисления-самовосстановления) атомы одного и того же элемента в составе одного и того же вещества выполняют функции окислителя и восстановителя.
Направление окислительно-восстановительных реакций определяется вторым законом термодинамики. Если процесс протекает при изобарно-изотермических условиях, то прямая реакция возможна при условии, что ее энергия Гиббса меньше нуля, ΔGреакции<0.
Окислительно-восстановительную способность вещества определяет величина окислительно-восстановительного потенциала (редокс-потенциал) для полуреакции восстановления. Окислительная способность веществ тем выше, чем больше положительное значение окислительно-восстановительного потенциала.
В общем виде полуреакцию восстановления можно записать в виде
![]() ,
,
где Ox – окисленная форма веществ;
Red – восстановленная форма веществ;
n – число электронов, принимающих участие в полуреакции.
Если реакция протекает в условиях, отличных от стандартных, то для расчета окислительно-восстановительного потенциала используют уравнение Нернста, которое при температуре 298К имеет следующий вид:
![]() (12.1)
(12.1)
где ![]() – стандартный окислительно-восстановительный
потенциал (справочная величина);
– стандартный окислительно-восстановительный
потенциал (справочная величина);
![]() ,
,
![]() – произведения активностей соответственно
окисленной и восстановленной форм
веществ в степенях, равных стехиометрическим
коэффициентам в уравнении полуреакции.
– произведения активностей соответственно
окисленной и восстановленной форм
веществ в степенях, равных стехиометрическим
коэффициентам в уравнении полуреакции.
Если в окислительно-восстановительных реакциях участвуют ионы водорода или гидроксид-ионы, то окислительно-восстановительные потенциалы зависят от величины рН. Например, для полуреакции
NO3- + 3H+ + 2e- = HNO2 + H2O
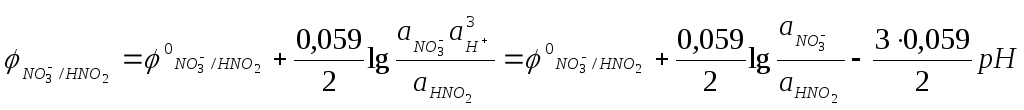
Окислительно-восстановительная реакция может протекать в заданном направлении самопроизвольно лишь тогда, когда потенциал окислителя больше потенциала восстановителя. Только в этом случае выполняется условие ΔGреакции<0.
Действительно, если процессы окисления и восстановления разъединить в пространстве, проводя их у электродов гальванического элемента, то будет совершаться электрическая работа
![]() ,
,
где n – число электронов, участвующих в реакции;
F – постоянная Фарадея;
![]() –ЭДС
гальванического элемента.
–ЭДС
гальванического элемента.
Итак,
чтобы
![]() ,
необходимо, чтобы
,
необходимо, чтобы![]() ,
то есть
,
то есть![]() .
.
12.2 Методика проведения опытов
12.2.1 Опыт №1. Восстановительные свойства металлов
12.2.1.1 Восстановление катионов Н+ металлами
В три пробирки налейте по 2-3 мл 0,1 М раствора серной кислоты. В одну пробирку внесите магний или цинк, во вторую – железо, в третью – медь.
Запишите наблюдения, составьте уравнения протекающих реакций и объясните результаты опыта. Укажите окислитель и восстановитель.
12.2.1.2 Восстановление катионов меди металлическим железом
Прилейте в пробирку 3-5 мл 0,5н. раствора сульфата меди (II) и погрузите в него металлическую скрепку (кнопку). Через 2 минуты выньте скрепку. Что образовалось на ее поверхности? Для каких практических целей служит данная реакция? Какими химическими свойствами обладают все металлы? Приведите три примера катионов металлов с наиболее выраженными окислительными свойствами.
12.2.2 Опыт №2. Влияние pH среды на окислительно-восстановительные реакции
12.2.2.1 Восстановление перманганата калия сульфитом натрия
В три пробирки налейте по три миллилитра раствора перманганата калия. В первую пробирку прилейте 2 мл 1М раствора серной кислоты, во вторую 2 мл Н2О, в третью 2 мл 2М раствора КОН.
В каждую пробирку добавьте несколько кристалликов сульфита натрия. Запишите наблюдения, составьте уравнения окислительно-восстановительных реакций и объясните результаты опыта. Учтите, что фиолетовая окраска характерна для ионов MnO4–, слабо-розовая (бесцветная) – для ионов Mn2+, бурый цвет имеют осадки МnО2 и Мn(ОН)2, манганат-ионы MnO42– имеют зеленую окраску.
12.2.2.2 Окисление Fe2+ до Fe3+ в кислой и щелочной среде
К свежеприготовленному раствору FeSO4, полученному растворением взятых в избытке опилок железа в разбавленной серной кислоте, прилейте раствор гидроксида натрия. Что наблюдается? Что происходит после взаимодействия полученного осадка с кислородом воздуха? Составьте уравнения реакций и объясните результаты опыта.
К свежеприготовленному раствору FeSO4 добавьте 2 мл 1М раствора серной кислоты и несколько капель бромной воды. В пробирку добавьте 2 капли раствора К4[Fe(CN)6]. Запишите наблюдения, составьте уравнение окислительно-восстановительной реакции и объясните результаты опыта.
12.2.3 Опыт №3 Реакции диспропорционирования
Кристаллик иода обработайте небольшим количеством 2М раствора гидроксида натрия при слабом нагревании. Полученный раствор подкислите.
Запишите наблюдения, составьте уравнение окислительно-восстановительной реакции, учитывая, что образуется иодат и иодид натрия.
12.3 Примеры решения задач
Пример 1
Определите степень окисления серы в соединениях: Н2S, Na2S2O3, H2SO3, H2SO4.
Решение
При определении степени окисления элемента в соединении исходят из предпосылок:
молекула в целом электронейтральна;
все связи в молекуле между разными по природе элементами – ионные;
из двух соседствующих атомов отрицательный заряд приобретает тот, который более электроорицателен;
степень окисления элементов в простых веществах равна нулю;
атом водорода в соединениях имеет степень окисления +1, кроме гидридов, где водород имеет степень окисления -1;
степень окисления кислорода в соединениях, кроме перекисных соединений и соединений с фтором, всегда равна -2;
степень окисления фтора в соединениях равна -1;
степень окисления щелочных металлов в соединениях равна +1;
степень окисления щелочноземельных металлов в соединениях равна +2
Определим степень окисления серы в перечисленных соединениях.
(Н+12Sх)0
2(+1) + х = 0
х = -2.
(Na+12Sх2O-23)0
2(+1) + 2х + 3(-2) =0,
х= +2.
(H+12SхO-23)0
2(+1) + х + 3(-2) =0
х= +4.
(H+12SхO-24)0
2(+1) + х + 4(-2) =0,
х= +6.
Пример 2
Методами электронного баланса и полуреакций (метод электронно-ионного баланса) расставить коэффициенты в межмолекулярной окислительно-восстановительной реакции
FeSO4 + KMnO4 + H2SO4 Fe2(SO4)3 + MnSO4+ K2SO4 + H2O
Решение
Определив степени окисления элементов в составе соединений, участвующих в ОВР можно убедиться, что железо (II) окисляется до железа (Ш), а марганец (VII) восстанавливается до марганца (II).
Fe+2 – 1е- " Fe+3, Mn+7 + 5е- " Mn+2
Метод
электронного баланса предусматривает
уравнивание количества электронов в
процессах окисления и восстановления.
Так как в продуктах реакции имеем два
атома железа, то это необходимо учесть
в электронном балансе.
2Fe+2 – 2е- " 2Fe+3 5
M n+7
+ 5е-
"
Mn+2 ´
2
n+7
+ 5е-
"
Mn+2 ´
2
10Fe+2 + 2Mn+7 " 10Fe+3 + 2Mn+2
Перенеся соответствующие коэффициенты в уравнение реакции, получим:
10FeSO4 + 2KMnO4 + H2SO4 " 5Fe2 (SO4)3 + 2MnSO4+ K2SO4 + H2O
Коэффициент перед серной кислотой можно вычислить как разницу между количеством сульфат-анионов в продуктах и исходных веществах:
(3´5 + 2 + 1) – 10 = 8
10FeSO4 + 2KMnO4 + 8H2SO4 " 5Fe2 (SO4)3 + 2MnSO4+ K2SO4 + H2O
Коэффициент для воды, равный 8, получим, исходя из числа катионов водорода в серной кислоте.
Таким образом, можно написать окончательное уравнение окислительно-восстановительной реакции:
10FeSO4 + 2KMnO4 + 8H2SO4 " 5Fe2 (SO4)3 + 2MnSO4+ K2SO4 + 8H2O
Теперь применим к указанной реакции метод полуреакций, он еще называется методом электронно-ионного баланса.
Для составления уравнений окислительно-восстановительных реакций, протекающих в водных растворах, предпочтительно использовать именно этот метод. В нем рассматриваются частицы, реально существующие в растворе, видна роль среды, не обязательно знать все образующиеся вещества, недостающие продукты реакции сами появляются при выводе уравнения реакции.
При составлении уравнений окислительно-востановительных реакций методом электронно-ионного баланса рекомендуется придерживаться определенного алгоритма.
- На основании знания свойств веществ, вступающих в реакцию, определяются окислитель, восстановитель и продукты их превращения.
- Составляются схемы полуреакций окисления и восстановления, в которых указываются реально существующие в растворе частицы.
- Уравнивается число атомов элементов в схемах полуреакций. При необходимости для этого используются частицы, существующие в водных растворах: Н2О, Н+, ОН –.
Необходимо учитывать, что в кислых растворах избыток кислорода связывается ионами водорода с образованием молекул воды, а в нейтральных и щелочных – молекулами воды с образованием гидроксид-ионов.
Присоединение недостающего кислорода в кислых и нейтральных средах происходит за счет молекул воды и приводит к образованию ионов водорода, в то время как в щелочной среде присоединение кислорода идет за счет гидроксид-ионов с образованием молекул воды.
- Учитывается правило электронейтральности: сумма зарядов в левой и правой части полуреакции должна быть одинакова. Для этого нужно прибавить или отнять от левой части полуреакции соответствующее число электронов. Оно определяется как разность между суммарными зарядами в левой и правой части полуреакции.
- Уравнивается число электронов, отданных восстановителем и принятых окислителем. Для этого вводятся соответствующие коэффициенты для полуреакций.
- Складываются левые и правые части полуреакций. Таким образом, получают ионно-молекулярное уравнение окислительно-восстановительной реакции.
- Записывается уравнение реакции в молекулярной форме. При этом учитываются частицы, не принимавшие участия в окислительно-восстановительном процессе, но присутствующие в растворе.
2 Fe2+
– 2е-
"
2Fe3+ ´5
Fe2+
– 2е-
"
2Fe3+ ´5
(MnO4)2 - + 8Н+ + 5е- " Mn2+ + 4 H2O ´2
1 0Fe2+
+ 2(MnO4)2
-
+ 16Н+
"
10Fe3+
+
5
Mn2+
+ 8H2O
0Fe2+
+ 2(MnO4)2
-
+ 16Н+
"
10Fe3+
+
5
Mn2+
+ 8H2O
10FeSO4 + 2KMnO4 + 8H2SO4 " 5Fe2(SO4)3 + 2MnSO4+ K2SO4 + 8H2O
Пример 3
Закончите реакцию и расставьте коэффициенты методом электронного баланса.
Na2SO3 + KMnO4 + KOH " Na2SO4 + …
Решение
В данной реакции Na2SO3 является восстановителем, так как
S+4 -2е- " S+6,
KMnO4 – окислитель.
Известно, что в зависимости от рН среды Mn+7 может восстанавливаться по-разному, а именно:
р
 Н
>7 (MnO4)2– (зеленая
окраска раствора)
Н
>7 (MnO4)2– (зеленая
окраска раствора)
M
 n+7
рН=7 MnO2 (бурый
осадок)
n+7
рН=7 MnO2 (бурый
осадок)
р Н<
7 Mn2+ (обесцвечивание
первоначального раствора)
Н<
7 Mn2+ (обесцвечивание
первоначального раствора)
Так как в нашем случае реакция протекает в присутствии щелочи, то есть рН>7, то продуктами реакции будут К2MnO4 и вода.
Na2SO3 + KMnO4 + KOH " Na2SO4 + К2MnO4 + H2O
Расставим коэффициенты методом электронного баланса:
M n+7
+
1е-
"
Mn+6 ´2
n+7
+
1е-
"
Mn+6 ´2
S+4 - 2е-" S+6 ´1
Na2SO3 + 2KMnO4 + 2KOH " Na2SO4 + 2К2MnO4 + H2O
12.4 Требования к уровню подготовки студентов
Знать понятия: степень окисления элемента, окислитель, восстановитель, окислительно-восстановительная реакция.
Знать наиболее распространенные окислители и восстановители.
Уметь связывать окислительно-восстановительные свойства веществ со степенью окисления образующих их атомов элементов.
Уметь составлять уравнения окислительно-восстановительных реакций и расставлять в них коэффициенты, используя метод электронного баланса и метод полуреакций.
12.5 Задания для самоконтроля
12.5.1 Методами электронного баланса и полуреакций расставить коэффициенты в приведенных ниже межмолекулярных окислительно-восстановительных реакциях.
HBr + H2SO4 " Br2 + SO2 + H2O
HNO3 + HCI " NOCI + CI2 + H2O
KI + HNO3 + H2SO4 " K2SO4 + I2 + NO2 + H2O
KMnO4 + HCI " KCI + MnCI2 + CI2 + H2O
HNO3 + S " H2SO4 + NO
K2Cr2O7 + H2SO4 + SO2 " K2SO4 + Cr2(SO4)3 + H2O
P + HNO3 " H3PO4 + NO
KI + H2O2 " I2 + KOH
HCI + H2O2 " CI2 + H2O
KMnO4 + Na2SO3 + H2SO4 " K2SO4 + MnSO4 + Na2SO4 H2O
K2Cr2O7 + H2S + H2SO4 " Cr2(SO4)3 + S + K2SO4+ H2O
KCrO2 + Br2 + KOH " K2CrO4 + KBr + H2O
Cr2O3 + KOH + KCIO3 " K2CrO4 + KCI + H2O
NaNO2 + KMnO4 + H2SO4 " NaNO3 + MnSO4 + K2SO4 + H2O
I2 + KOH " KOCI + KCI + H2O
CI2 + KOH " KCIO3 + KCI + H2O
HCI + K2Cr2O7 " CI2 + CrCI3 + KCI + H2O
Sn + HNO3(разб) " Sn(NO3)2 + N2O + H2O
H2O2 + KMnO4 + H2SO4 " K2SO4 + MnSO4 + O2 + H2O
HBr + H2SO4 " Br2 + SO2 + H2O
NaBr + MnO2 + H2SO4 " MnSO4 + Na2SO4 + Br2 + H2O
HCI + MnO2 " MnCI2 + CI2 + H2O
H2SO3 + CI2 + H2O " H2SO4 + HCI
KNO2 + KI + H2SO4 " NO + I2 + K2SO4 + H2O
FeSO4 + HNO3 + H2SO4 " Fe2(SO4)3 + NO + H2O
12.5.2 Закончить реакции и расставить коэффициенты методом электронного баланса.
Mn(OH)2 + CI2 + KOH " MnO2 + …
SO2 + Br2 + H2O " H2SO4 + …
FeSO4 + Br2 + H2SO4 " Fe2(SO4)3 + …
K[Cr(OH)4] + Br2 + KOH " K2CrO4 + …
S + CI2 + H2O " H2SO4 + …
H2S + CI2 + H2O " H2SO4 + …
NH3 + O2 " NO + …
MnO2 + O2 + KOH " K2MnO4 + …
K2MnO4 + CI2 " KMnO4 + …
S + HNO3(разб) " H2SO4 + …
Fe + HNO3(конц) " Fe(NO3)3 + …
Pb + HNO3(разб) " Pb(NO3)2 + ....
12.6 Список рекомендуемой литературы
12.6.1 Коровин Н.В. Общая химия: Учебник для технических направ. и спец. вузов. – М.: Высш. шк., 2009. – 557 с.
12.6.2 Глинка Н.Л. Общая химия: Учебное пособие для вузов/ Под ред. А.И.Ермакова. – М.: Интеграл-Пресс, 2010. – 728 с.
12.6.3 Глинка Н.Л. Задачи и упражнения по общей химии: Учебное пособие для вузов/ Под ред. В.А.Рабиновича и Х.М.Рубиной. – М.: Интеграл-Пресс, 2008. – 240 с.
