
- •Биосинтез рнк
- •Структура рнк-полимеразы прокариот
- •Биосинтез белка
- •R Аминоацил-тРнк
- •Современные методы молекулярной биологии
- •Гормоны. Общий механизм действия гормонов
- •Механизм действия гормонов, взаимодействующих
- •Механизм действия гормонов, взаимодействующих с 1-тмс-рецепторами
- •Механизм действия гормонов, взаимодействующих с внутриклеточными (r)
- •Гормоны — производные белков, пептидов и аминокислот гормоны гипоталамуса
- •Гормоны аденогипофиза Это гормоны белково-пептидной природы.
- •Гормоны задней доли гипофиза
- •Гормоны поджелудочной железы
- •Стероидные гормоны
- •2.Окисление и изомеризация прегненолона в прогестерон. Прегненолон является предшественником всех стероидных гормонов.
- •Половые гормоны
- •Биохимия питания. Макро- и микроэлементы
- •Макроэлементы
- •Концентрация электролитов вне и внутри клетки существенно различается: натрий и кальций преобладают во внеклеточном пространстве, калий и магний — внутри клетки. Кальций
- •Кальцитонин
- •Паратирин (паратгормон)
- •Витамин д (кальциферол), антирахитический
- •Микроэлементы Железо
- •Биохимия питания. Витамины и другие незаменимые факторы питания. Синдром недостаточного питания
- •Витамины
- •Биохимия соединительных тканей и органов полости рта (костная, хрящевая ткани; зубы)
- •Неколлагеновые белки костной ткани и их роль в процессах минерализации
- •Химический состав тканей зуба и кости (весовые %)
- •Биохимия ротовой жидкости
- •Химический состав ротовой жидкости
- •Функции ротовой жидкости
- •1. Защитная.
- •3. Очищающая.
- •Ферменты ротовой жидкости и их роль
- •Поверхностные образования на эмали
- •Фтор (f) и его роль в организме
- •Биохимия печени
- •Функции печени
- •Миофибриллярные (сократительные) белки
- •Молекулярный механизм мышечного сокращения
- •Источники энергии мышечного сокращения
- •Механизмы энергообеспечения мышечного сокращения
Механизм действия гормонов, взаимодействующих
с 7-ТМС-рецепторами
Первый этап действия гормона заключается во взаимодействии гормона с 7-ТМС-(R) (к ним относятся α- и β-адренергические (R), (R) гистамина, серотонина, соматостатина, гликопротеиновых гормонов, глюкагона, паратирина, кальцитонина, гормонов гипоталамуса).
 Второй
участник передачи гормонального сигнала
—G-белки.
Обнаружены: 1) большие, состоящие из
нескольких субъединиц G-белки
(связаны с мембранами); 2) низкомолекулярные,
состоящие из одной полипептидной цепи
(цитозольные). Все G-белки
обладают ГТФ-азной
активностью, и их конформация зависит
от того, связаны ли они в данный момент
с ГДФ или ГТФ. Мембранный G-белок
состоит из 3 субъединиц: α, β и γ.
Второй
участник передачи гормонального сигнала
—G-белки.
Обнаружены: 1) большие, состоящие из
нескольких субъединиц G-белки
(связаны с мембранами); 2) низкомолекулярные,
состоящие из одной полипептидной цепи
(цитозольные). Все G-белки
обладают ГТФ-азной
активностью, и их конформация зависит
от того, связаны ли они в данный момент
с ГДФ или ГТФ. Мембранный G-белок
состоит из 3 субъединиц: α, β и γ.
В неактивном состоянии три субъединицы соединены вместе, и α-субъединица связана с ГДФ. После присоединения гормона к 7-ТМС-(R) и взаимодействия гормон-рецепторного комплекса с G-белком в последнем происходит замена ГДФ на ГТФ, вследствие чего G-белок диссоциирует с образованием свободной α-субъединицы и димера субъединиц β, γ. Затем α-субъединица перемещается по мембране и взаимодействует с мембраносвязанными ферментами (аденилатциклазой или фосфолипазой С), катализирующими образование низкомолекулярных вторичных посредников. Продолжительность эффекта G-белка определяется ГТФ-азной активностью его α-субъединицы: после гидролиза ГТФ до ГДФ действие субъединицы прекращается и G-белок возвращается в исходное тримерное состояние
Аденилатциклаза. Различные типы аденилатциклаз реагируют с α-субъединицами, выполняющими разные функции: если связывание осуществляется с αs-субъединицей G-белка, то фермент активируется, если с αI-cубъединицей, то ингибируется. Аденилатциклаза катализирует образование цАМФ из АТФ. Уровень цАМФ в клетках очень низок, но при активировании аденилатциклазы он может быстро и значительно увеличиваться. Однако это повышение кратковременно. Распад цАМФ катализируется цАМФ-фосфодиэстеразами (ФДЭ), гидролизующими фосфодиэфирную связь в молекуле цАМФ. ФДЭ — регулируемый фермент (его ингибирует кофеин, что приводит к повышению уровня цАМФ).
ц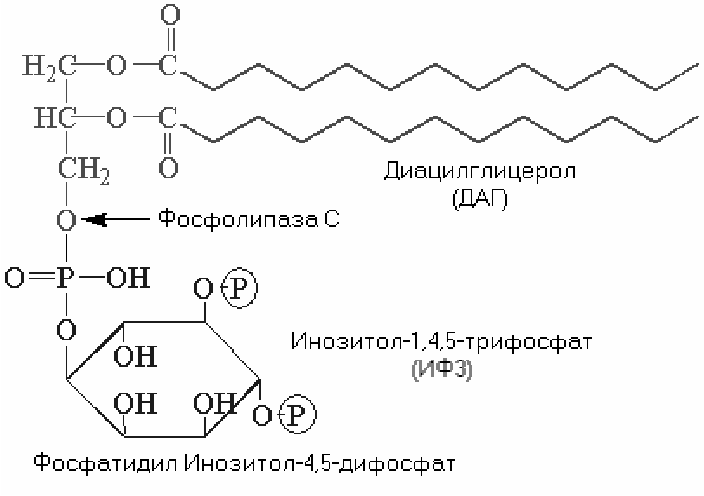 АМФ
является аллостерическим регуляторомпротеинкиназы
А (существуют
разные типы этих ферментов).
Протеинкиназы
— это гетеромеры, состоящие из
двухкаталитических и одной регуляторной
субъединиц. Присоединение цАМФ к
регуляторной субъединице высвобождает
каталитические субъединиц. Последние
переносят фосфорный остаток с АТФ на
серин или треонин некоторых ферментов,
которые при этом переходят в активное
или неактивное состояние (это зависит
от свойств данного фермента: так,
фосфорилирование
гликогенфосфорилазы
активирует ее, а фосфорилирование
гликогенсинтазы её угнетает). цАМФ
регулирует также открытие цАМФ-зависимых
ионных каналов. Повышение уровня цАМФ
может приводить к активации транскрипции
определенных генов.
АМФ
является аллостерическим регуляторомпротеинкиназы
А (существуют
разные типы этих ферментов).
Протеинкиназы
— это гетеромеры, состоящие из
двухкаталитических и одной регуляторной
субъединиц. Присоединение цАМФ к
регуляторной субъединице высвобождает
каталитические субъединиц. Последние
переносят фосфорный остаток с АТФ на
серин или треонин некоторых ферментов,
которые при этом переходят в активное
или неактивное состояние (это зависит
от свойств данного фермента: так,
фосфорилирование
гликогенфосфорилазы
активирует ее, а фосфорилирование
гликогенсинтазы её угнетает). цАМФ
регулирует также открытие цАМФ-зависимых
ионных каналов. Повышение уровня цАМФ
может приводить к активации транскрипции
определенных генов.
Фосфолипаза С. Субстратом этого фермента является фосфатидилинозитол-4,5-дифосфат. Фосфолипаза С катализирует образование двух мощных вторичных посредников: диацилглицерола (ДАГ) и инозитол-1,4,5-трифосфата (ИТФ).
ИТФ связывается с (R) кальцисом, что приводит к открытию лиганд-зависимых кальциевых каналов кальцисом. В результате в цитозоле резко увеличивается концентрация Са2+. Высвободившийся Са2+ захватывается специальными кальций-связывающими белками, например, калмодулином. Когда уровень внутриклеточного Са2+ повышается, кальций-калмодулиновый комплекс присоединяется к различным белкам-мишеням, что сопровождается изменением их активности. Кальмодулин-зависимые протеинкиназы регулируют активность многих ферментов. Они также способны проникать в ядро клетки, где фосфорилируют белки, ответственные за активацию транскрипции.
Таким образом, ИТФ повышает концентрацию Са2+ в цитозоле. ДАГ остается в плазматической мембране и либо гидролизуется с образованием арахидоновой кислоты (необходимой для синтеза простагландинов), либо активирует протеинкиназу С. При низком внутриклеточном уровне Са2+ и отсутствии ДАГ протеинкиназа С находится в цитоплазме в неактивном состоянии. При связывании ДАГ конформация протеинкиназы С изменяется, увеличивается её сродство к Са2+ и она начинает активировать разнообразные белки-мишени (так, С-киназа фосфорилирует и тем самым активирует Na+/H+ обменный насос плазматической мембраны, контролирующий внутриклеточный рН). Активная С-киназа способна усиливать транскрипцию генов.
