
- •Введение
- •1 Получение фенола и ацетона кислотным разложением гидропероксида кумола
- •1.1 Теоретическое обоснование процесса
- •1.2 Экспериментальная часть
- •1.2.1 Характеристики использованного сырья
- •1.2.2 Методика эксперимента
- •1.2.3 Определение гидропероксида кумола йодометрически методом
- •1.2.4 Определение ацетона в реакционной смеси кислотного разложения гидропероксида кумола
- •1.2.5 Определение фенола в реакционной смеси кислотного разложения гидропероксида кумола
- •1.3 Обработка результатов эксперимента
- •1.4 Вывод
- •2 Получение карбонильных соединений каталитическим дегидрированием спиртов
- •2.1 Теоретические основы процесса дегидрирования спиртов
- •2Сн3сн2сно → сн3сн2соосн2сн2сн3
- •2.2 Экспериментальная часть
- •2.2.1 Проведение контактирования
- •2.3 Обработка результатов эксперимента
- •2.3.1 Методики анализов
- •Определение спиртов методом ацетилирования
- •Потенциометрический метод титрования. Определение карбонильных соединений на основе реакции оксимирования
- •Ход анализа
- •Определение сложных эфиров методом омыления
- •Расчёт безразмерных характеристик процесса дегидрирования н‑пропилового спирта. Результаты и их обсуждение
- •2.4 Выводы
- •Заключение
- •Список литературы
1.2.5 Определение фенола в реакционной смеси кислотного разложения гидропероксида кумола
Определение фенола в реакционной смеси разложения гидропероксида кумола, оставшейся после отгонки ацетона, основано на реакции бромирования избытком брома, выделившегося при подкислении из бромид-броматного раствора
5![]()
![]()
Непрореагировавший бром определяется йодометрически
![]()
![]()
Остаток после
отгонки ацетона охлаждают, взвешивают
и количественно переносят в мерную
колбу вместимостью 250 см![]() ,
содержимое колбы доводят дистиллированной
водой до метки и перемешивают. Берут
пипеткой 10 см этого раствора и помещают
в коническую колбу вместимостью 250 см
,
содержимое колбы доводят дистиллированной
водой до метки и перемешивают. Берут
пипеткой 10 см этого раствора и помещают
в коническую колбу вместимостью 250 см![]() ,
затем приливают 50 см
,
затем приливают 50 см![]() водного раствора бромид-бромата калия
и 6 см концентрированной соляной кислоты.
Закрыв колбу пробкой, тщательно
перемешивают ее содержимое и оставляют
на 30 мин при комнатной температуре.
После этого приливают 15 см
водного раствора бромид-бромата калия
и 6 см концентрированной соляной кислоты.
Закрыв колбу пробкой, тщательно
перемешивают ее содержимое и оставляют
на 30 мин при комнатной температуре.
После этого приливают 15 см![]() водного раствора иодида калия с массовой
долей 10 %, снова энергично перемешивают
и оттитровывают выделившийся йод
раствором гипосульфита в присутствии
водного раствора крахмала с массовой
долей 1 %. В тех же условиях проводят
холостой опыт, но вместо анализируемой
фенольной воды берут такое же количество
дистиллированной воды.
водного раствора иодида калия с массовой
долей 10 %, снова энергично перемешивают
и оттитровывают выделившийся йод
раствором гипосульфита в присутствии
водного раствора крахмала с массовой
долей 1 %. В тех же условиях проводят
холостой опыт, но вместо анализируемой
фенольной воды берут такое же количество
дистиллированной воды.
Массовая доля фенола рассчитывается по формуле
![]() (5)
(5)
где
![]() - массовая доля фенола, %;
- массовая доля фенола, %;
![]() ,
,
![]() -
объем раствора гипосульфита натрия
молярной концентрацией эквивалента
гипосульфита натрия с (
-
объем раствора гипосульфита натрия
молярной концентрацией эквивалента
гипосульфита натрия с (![]() )
= 0,1 моль/дм
)
= 0,1 моль/дм![]() ,
пошедшего на титрование навески и
холостой пробы соответственно, см
,
пошедшего на титрование навески и
холостой пробы соответственно, см![]() ;
;
Т
– поправочный
коэффициент раствора гипосульфита
натрия моля-рной
концентрацией
эквивалента гипосульфита натрия
с (![]() )=
= 0,1 моль/дм
)=
= 0,1 моль/дм![]() ;
;
g- масса анализируемой реакционной смеси, взятой на анализ, г;
d-
масса фенола, соответствующая 1 см![]() раствора гипосульфита натрия молярной
концентрацией эквивалента гипосульфита
натрия с (
раствора гипосульфита натрия молярной
концентрацией эквивалента гипосульфита
натрия с (![]() )
= 0,1 моль/дм
)
= 0,1 моль/дм![]() ,
г/см
,
г/см![]() ,
определяемая по формуле:
,
определяемая по формуле:
![]() (6)
(6)
где М![]() -
молярная масса фенола, г/моль;
-
молярная масса фенола, г/моль;
с
(![]() )-
молярная концентрация эквивалента
гипосульфита натрия, моль/дм
)-
молярная концентрация эквивалента
гипосульфита натрия, моль/дм![]() ;
;
z – число эквивалентности, определяемое по реакции между фенолом и бромом (z = 6).
1.3 Обработка результатов эксперимента
Массовая доля исходного гидропероксида рассчитывается по формулам (1) и (2):
![]()
d=152![]() 0,1/2
0,1/2![]() 1000=0,0076
1000=0,0076
![]()
Массовая доля исходного гидропероксида через 30 мин рассчитывается по формулам (1):
![]()
Массовая доля исходного гидропероксида через 50 мин рассчитывается по формуле (1) :
![]()
Масса исходной смеси 22,6г
Масса гидропероксида в исходной смеси:
mгип=m![]() W=22,6
W=22,6![]() 0,2295=5,66
г
0,2295=5,66
г
Количество гидропероксида в исходной смеси:
nгип= mгип/Мгип=5,66/152,19=0,037моль
Определение содержания ацетона в реакционной смеси расчёт ведётся по формулам (1) и (2):
![]()
Масса о-ксилола:
mо-кс=Vо-кс![]()
![]() о-кс=20
о-кс=20![]() 0,881=17,604
%
0,881=17,604
%
Масса ацетона:
mац=58,08![]() 0,037=2,15
г
0,037=2,15
г
Определение содержания фенола в реакционной смеси.
Расчёт ведётся по формулам (5) и (6):
![]()
Масса фенола:
mф=94,11![]() 0,037=3,48
г
0,037=3,48
г
Материальный баланс и безразмерные характеристики процесса данные по материальному балансу представлены в таблице 2.
Таблица 2 - Материальный баланс кислотного разложения гидропероксида на фенол и ацетон
|
Компонент
|
Mолярная масса, г/моль |
Взято |
Получено | ||||
|
Масса, г
|
Количество вещества, моль
|
|
Масса, г |
Количество вещества, моль
| |||
|
Гидропероксид кумола |
152,19 |
5,66 |
0,037 |
|
0,02 |
0,0001 | |
|
О-ксилол |
106,16 |
36,62 |
0,345 |
|
36,62 |
0,345 | |
|
Фенол |
94,11 |
- |
- |
|
4,21 |
0,045 | |
|
Ацетон |
58,08 |
- |
- |
|
1,77 |
0,03 | |
|
Потери |
- |
- |
- |
|
|
- | |
|
Всего |
- |
42,62 |
|
|
42,62 |
| |
Материальный баланс и безразмерные характеристики процесса данные по материальному балансу представлены в таблице 3.
Таблица 3 - Материальный баланс без учёта добавления о-ксилола кислотного разложения гидропероксида на фенол и ацетон
|
Компонент
|
Mолярная масса, г/моль |
Взято |
Получено | |||
|
Масса, г
|
Количество вещества, моль
|
|
Масса, г |
Количество вещества, моль
| ||
|
Гидропероксид кумола |
152,19 |
5,66 |
0,037 |
|
0,01 |
0,000066 |
|
Фенол |
94,11 |
- |
- |
|
2,45 |
0,026 |
|
Ацетон |
58,08 |
- |
- |
|
2,17 |
0,018 |
|
Потери |
- |
- |
- |
|
|
- |
|
Всего |
- |
5,66 |
0,037 |
|
5,66 |
0,044 |
Cтепень превращения ГПИПБ:
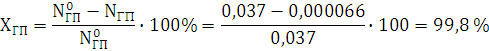
Выход ацетона составляет:
![]()
Выход фенола составляет:
![]()
Cелективность составляет:
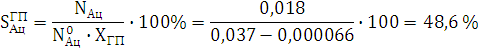
![]()
