
Аналитика отчет 2
.docМинистерство образования и науки Российской Федерации
Федеральное агенство по образованию
Государственное образовательное учреждение
Высшего профессионального образования
«Ярославский государственный технический университет» Кафедра аналитической химии и контроля качества продукции
Отчет защищен
с оценкой
Преподаватель
к. х. н., доцент
_______________Г.Г.Красовская
_____________дата
Определение содержания карбоната натрия в растворе соды
Отчет о лабораторной работе
По курсу «Аналитическая химия и физико-химические методы анализа»
ЯГТУ 240502.65-001 ЛР
Отчет выполнил
студент гр. ХТО-21
_______________ О.Д. Колутина
_______________дата
2012
Определение содержания карбоната натрия в растворе соды
I. Приготовление вторичного стандартного раствора соляной кислоты с концентрацией 0,1 моль/дм3 ,объемом 500 мл.
Посуда: склянка (V=1л), цилиндр (1л, 25 мл)
Реактивы: исходный концентрированный раствор HCl (p=1.08 г/см3;ω=16,47% масс)
Расчет:
1. Количество (г) HCl, содержащееся в 500 мл раствора HCl СHCl=0.1 моль/л.
m(HCl)=C(HCl)*V(HCl)*M(HCl)*10-3=0.1*500*36.46*10-3=1.823 г
2. Количество (мл) исходной HCl,содержащей 1,823г HCl
В 100г раствора содержится 16,47г HCl
В Хг раствора содержится 1,823г HCl
Х=1,823*100/16,47=11,0686г раствора
V(HClконц)=11,0686/1,08=10,2487 мл
3. Количество (мл) дистиллированной воды
V(Н2О)=Vр-ра- VHCl=500-10.2487=489.75(мл)
4.Экспериментальная часть:
1). Подготовить склянку (вымыть моющим раствором, водопроводной водой, ополоснуть дистиллированной водой),подобрать пробку, подписать склянку.
2). Отмерить цилиндром рассчитанное количество дистиллированной воды (490 мл), перелить через воронку в склянку.
3). Отмерить цилиндром рассчитанное количество кислоты (10,24 мл), перелить через воронку в склянку.
4). Тщательно перемешать приготовленный раствор.
II.Стандартизация раствора HCl (определение поправочного коэффициента К)
1. Первичный стандартный раствор Na2CO3
C(1/z Na2CO3)=0,1 моль/дм3 К(Na2CO3)=1,057
2. Основной метод: прямое кислотно-основное титрование
3. Основная реакция:
Na2CO3+ Z HCl =Z NaCl+CO2+H2O
4. Индикатор: метилоранж. В присутствии данного индикатора титрование осуществляется до второй ступени, поэтому фактор эквивалентности равен двум.
5. Экспериментальная часть:
В бюретку (вымытую водопроводной водой, ополоснутую дистиллированной водой и свои раствором соляной кислоты), налить раствор соляной кислоты, заполнить носик бюретки. В коническую колбу для титрования отобрать пипеткой 10 мл первичного стандартного раствора карбоната натрия, добавить 2 капли метилоранжа, перемешать. Установить уровень раствора титранта в бюретке на нулевое деление. Титровать до перехода окраски раствора от желтого до оранжевого цвета, записать объем кислоты. Титровать до получения трех-четырех сходящихся результатов. Найти среднее значение Vср.
V1 = V2= V3 = V4=
Vср. = (V1 + V2+V3 +V4)/4=
6. Расчет:
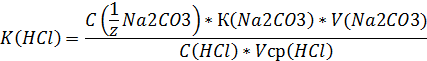
III.Определение содержания карбоната натрия в контрольном растворе соды.
1. Основной метод: прямое кислотно-основное титрование
2. Основная реакция:
Na2CO3+ 2 HCl =2 NaCl+CO2+H2O
3. Индикатор: метилоранж.
4. Реактивы :
а)стандартный раствор HCl, С(HCl)= моль/дм3, K(HCl)=
б)контрольный раствор соды(выданный лаборантом)
в)индикатор: метилоранж.
5. Посуда: мерная колба (100 мл), бюретка (25мл), пипетка (10 мл), коническая колба для титрования, резиновая груша.
6.Экспериментальная часть:
В вымытую мерную колбу емкостью 100 мл получить у лаборанта контрольный раствор соды (по карточке студента). Довести объем дистиллированной воды до метки, закрыть пробкой, перемешать.
Бюретку заполнить стандартным раствором HCl, установить уровень раствора на нулевом делении. В коническую колбу отобрать с помощью пипетки 10 мл анализируемого раствора из мерной колбы, добавить 1-2 капли метилоранжа. Оттитровать до получения четырех сходящихся результатов. Найти средний объем, пошедший титрование.
7.Расчет массы карбоната натрия в контрольном растворе соды:
 ,
г
,
г
Где VК=100 мл, Vп=100 мл, M(1/2 Na2CO3)=105.96/2=52.98 г/моль
Вывод.
