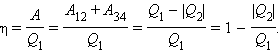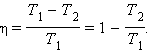51-60
.docx51.Адиабатный процесс. Вывод уравнения адиабаты.
Адиабатный процесс — процесс, при котором отсутствует теплообмен между системой и окружающей средой.
Из
первого начала термодинамики следует,
что работа газа при адиабатном процессе
совершается за счет его внутренней
энергии:
![]() (1).
С
другой стороны, из уравнения
Клапейрона-Менделеева следует:
(1).
С
другой стороны, из уравнения
Клапейрона-Менделеева следует:
![]() (2).
Разделим
уравнение (2) на уравнение (1):
(2).
Разделим
уравнение (2) на уравнение (1):
![]() ,
где
,
где
![]() .
Проинтегрируем
полученное уравнение:
.
Проинтегрируем
полученное уравнение:
![]() .
Таким
образом, при адиабатном процессе
.
Таким
образом, при адиабатном процессе
![]() —
уравнение Пуассона.
—
уравнение Пуассона.
52.Работа, совершаемая идеальным газом при изобарном и изохорном процессах.
ИЗОБАРНЫЙ
ПРОЦЕСС (![]() )
Для
изобарного процесса в идеальном газе
справедлив закон Гей-Люссака:
при
постоянном давлении объем данной массы
газа прямо пропорционален его
термодинамической температуре:
)
Для
изобарного процесса в идеальном газе
справедлив закон Гей-Люссака:
при
постоянном давлении объем данной массы
газа прямо пропорционален его
термодинамической температуре:
![]() или
или ![]() .
.
Работа
газа при изобарном расширении:
![]() .
.
ИЗОХОРНЫЙ
ПРОЦЕСС (![]() )
Изохорный
процесс в идеальном газе описывается
законом Шарля:
при постоянном объеме
давление данной массы газа прямо
пропорционально его термодинамической
температуре:
)
Изохорный
процесс в идеальном газе описывается
законом Шарля:
при постоянном объеме
давление данной массы газа прямо
пропорционально его термодинамической
температуре:
![]() или
или ![]() .
.
Работа
газа при изохорном процессе равна
нулю: ![]() .
Все
полученное тепло идет на изменение
внутренней энергии в соответствии с
первым началом термодинамики:
.
Все
полученное тепло идет на изменение
внутренней энергии в соответствии с
первым началом термодинамики:
![]() .
.
53.Работа, совершаемая идеальным газом при изотермическом процессе.
ИЗОТЕРМИЧЕСКИЙ
ПРОЦЕСС (![]() )
Изотермический
процесс в идеальном газе подчиняется
закону Бойля - Мариотта:
для данной
массы газа при неизменной температуре
произведение значений давления и объема
есть величина постоянная:
)
Изотермический
процесс в идеальном газе подчиняется
закону Бойля - Мариотта:
для данной
массы газа при неизменной температуре
произведение значений давления и объема
есть величина постоянная:
![]() или
или ![]() .
.
Работа
газа при изотермическом расширении:
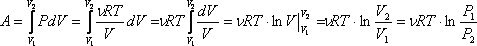 .
Изменение
внутренней энергии при изотермическом
процессе равно нулю:
.
Изменение
внутренней энергии при изотермическом
процессе равно нулю:
![]() .
Все
полученное тепло идет на совершение
работы в соответствии с первым началом
термодинамики:
.
Все
полученное тепло идет на совершение
работы в соответствии с первым началом
термодинамики:
![]() .
.
54.Работа, совершаемая идеальным газом при адиабатном процессе.
Работа
газа при адиабатном процессе равна
убыли внутренней энергии:
![]()
55.Тепловые машины. Цикл Карно.
Тепловая машина – это устройство, способное превращать тепловую энергию в механическую работу. Первая тепловая машина это ружье. Для того, чтобы тепловая машина работала необходимо приводить ее в начальное состояние, т.е. ее работа должна быть цикличной.
Было предложено множество тепловых машин, работающих по различным циклам. Наиболее удачным оказался цикл Карно
Цикл Карно
|
A = A12 + A23 + A34 + A41. |
|
A = –ΔU = –CV (T2 – T1), |
|
A23 = –A41. |
По определению, коэффициент полезного действия η цикла Карно есть
|
|
С. Карно выразил коэффициент полезного действия цикла через температуры нагревателя T1 и холодильника T2:
|
56.Второй закон термодинамики
При рассмотрении различных ТД процессов выполняется 1 начало ТД, т.е. закон сохранения энергии. Но 1 начало ничего не говорит о том, в каких направлениях могут протекать процессы. Но ряд процессов незапрещенных 1 началом ТД в природе не наблюдается, второе начало ТД показывает в каком направлении могут протекать процессы. У этого начала есть несколько формулировок:
-
В природе не существуют процессы, при которых вся теплота переходит в механическую
-
Невозможен вечный двигатель 2го рода, т.е. устройство переводящее всю теплоту в механическую работу
-
В природе не существует процессов, единственным результатом которых является передача тепла от менее нагретого тела к более нагретому без изменения состояния окружающих тел
-
В изолированной системе возможны только процессы, при которых энтропия системы не уменьшается. Все самопроизвольные процессы в природе происходят с возрастанием энтропии
57.Коэффициент полезного действия.
Коэффицие́нт поле́зного де́йствия — характеристика эффективности системы (устройства, машины) в отношении преобразования или передачи энергии. Определяется отношением полезно использованной энергии к суммарному количеству энергии полученному системой
![]() x
100 %,
x
100 %,
где А — полезная работа, а Q — затраченная энергия.
КПД теплово́го дви́гателя — отношение совершённой полезной работы двигателя, к энергии, полученной от нагревателя. КПД теплового двигателя может быть вычислен по следующей формуле
![]() ,
,
где ![]() — количество
теплоты,
полученное от нагревателя,
— количество
теплоты,
полученное от нагревателя, ![]() —
количество теплоты, отданное холодильнику.
Наибольшим КПД среди циклических машин,
оперирующих при заданных температурах
горячего источника T1 и
холодного T2,
обладают тепловые двигатели, работающие
по циклу
Карно;
этот предельный КПД равен
—
количество теплоты, отданное холодильнику.
Наибольшим КПД среди циклических машин,
оперирующих при заданных температурах
горячего источника T1 и
холодного T2,
обладают тепловые двигатели, работающие
по циклу
Карно;
этот предельный КПД равен
![]() .
.
58. Энтропия. Основное уравнение термодинамики.
Энтропия
![]() ,
,
где ![]() —
приращение энтропии;
—
приращение энтропии; ![]() —
минимальная теплота, подведенная к
системе; T — абсолютная температура
процесса;
—
минимальная теплота, подведенная к
системе; T — абсолютная температура
процесса;
Приведенная теплота перехода не зависит от пути перехода. Энтропия определяет изменение некоторой функции состояния системы
Основное уравнение ТД.
Введем энтропию в формулу 1го начала ТД
dQ=dU+dA
dS=dQ/T
TdS=dU+dA
За бесконечно малое время Т фактически не изменяется и процесс можно считать изотермическим
dA=-d(U-TS)
При необратимом процессе энтропия системы возрастает и внутренняя энергия обесценивается. Причиной любых процессов является разница в энергиях. При возрастании энтропии эта разница уменьшается и в этом смысл об энтропии говорит, что она есть мера обесценивания внутренней энергии.
59.Статистический смысл второго начала термодинамики.
Все процессы в природе происходят в направлении, приводящем к увеличению ТДой вероятности состояния системы.
Связь энтропии с ТД-ой вероятностью установлена Больцманом и имеет вид:
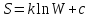
Законы статистики применимы к макросистемам, но нарушаются в микро и мега мире, т.е. там не выполняется 2 начало ТД. В микромире наблюдается флуктуация концентрации частиц, а следовательно флуктуация плотности, давления, энергии, температуры.
60.Теорема Нернста (III начало термодинамики). Недостижимость абсолютного нуля.
Термодинамическому равновесию соответствует наиболее вероятное состояние систему и максимальная энтропия. При этом в системе наблюдается максимальный беспорядок, следовательно энтропия это мера хауса.
При понижении температуры уменьшается интенсивность теплового движения частиц. Вещество переходит в конденсируемое состояние, а при сверхнизких температурах – в кристаллическое. Атомы находятся в углах кристаллической решетки, электроны на самых низких энергетических уровнях. Такому состоянию соответствует максимальный порядок
Теорема Нернста.
1)При стремлении температуры вещества к абсолютному нулю, его энтропия стремится к конечному пределу
2) При абсолютном нуле все процессы в системе происходят без изменения энтропии. Вблизи абс. Нуля прекращается теплообмен
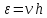
3) Невозможно создать тепловую машину, способную охладить тело до абс. нуля, т.е. абс. ноль недостижим