
Задачи по химии К1
.rtfЗАДАЧИ ПО ХИМИИ.
1. Составить электронную формулу и графическую схему заполнения электронами валентных валентных орбиталей атома азота (углерода, кислорода, фосфора, хлора, натрия).
Азот N 1s2 2s2 2p3
Углерод C 1s2 2s2 2p2
Кислород O 1s2 2s2 2p4
Фосфор P 1s2 2s2 2p6 3s2 3p3
Хлор Cl 1s2 2s2 2p6 3s2 3p5
Натрий Na 1s2 2s2 2p6 3s1
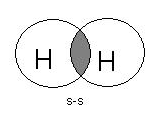
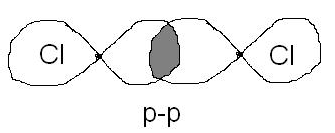
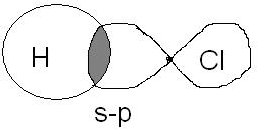
2.Указать тип химической связи в молекулах: H2, Cl2, HCl. Привести схему перекрывания электронных облаков.
H2 – Ковалентная неполярная связь
Cl2 – Ковалентная неполярная связь.
HCl – Ковалентная полярная связь.
3. Эквивалентная масса хлора равна 35,5 г/моль, молярная масса меди равна 63,5 г/моль. Эквивалентная масса хлорида меди равна 99,5 г/моль. Какова формула хлорида меди?
Мэ(Cu)= 99.5-35.5 = 64 г/моль.
Валентность меди = 63,5/64 =1; => формула CuCl.
Ответ: CuCl.
4. При сгорании 5г металла образуется 9,44г оксида металла. Определить эквивалентную массу металла.
M(O2)= 9.44 - 5 = 4.44г.
Мэ(O2)= 32 * 1/4 = 8 г/моль.
5/Мэ(Me) = 4.44/8
Мэ(Me) = 5*8/4,44 = 9 г/моль.
Ответ: Мэ(Me) = 9 г/моль.
5. Вычислить атомную массу двухвалентного металла и определить, какой это металл, если 8,34 г металла окисляется 0,68 л кислорода (условия нормальные).
2Me + O2 = 2MeO2
n(O2) = V(O2)/Vm = 0.68/22.4 = 0.03 моль.
n(Me) = 2*n(O2) = 0.03*2 = 0.06 моль.
A(Me)=m(Me)/n(Me) = 8.34/0.06 = 137 г/моль. => Ba.
Ответ: 137 г/моль Ba.
6. На нейтрализацию 2,45 г кислоты идет 2 г гидроксида натрия. Определить эквивалентную массу кислоты.
mкисл./mосн = Мэкисл/Мэосн.
Мэ(NaOH) = 40.
Мэкисл = 2.45*40/2 = 49 г/моль.
Ответ: 49 г/моль.
7. Сколько молекул диоксида углерода находится в 1 л воздуха, если объемное содержание СО2 составляет 0,03% (норм. условия).
Vвозд = 1000мл.
M(возд) = 29г/моль.
1000мл - 100%
Х - 0,03%
Х= 3,33 мл.
n(CO2)= 3.33/22.4 = 0.14 моль.
N(CO2)= 0.14*6*1023 = 0.84*1023
Ответ: N(CO2)= 0.84*108. Какой объем водорода (при 17 23
0С и давлении 102,4 кПа) выделится при растворении 1,5 г цинка в соляной кислоте?
Дано:
m(Zn)=1,5г
M(Zn)=65 г/моль
M(H₂)=2 г/моль
Т=17°С+273=290° К
R=8,31 Дж/(моль*К)
P=102,4 кПа=102400 Па
Найти: V(Н₂)
1) Запишем уравнение реакции и составим пропорцию, чтобы определить массу водрода:
Zn+HCl = ZnCl₂+H₂
1,5 г --------------------х г
65 г/моль ---------------2 г/моль
х=1,5*2/65=0,046 г.
2) Из уравнения Менделеева-Клайперона выразим объем V(H₂):
V(H₂)=mRT/(M*P)=0,046*8.31*290/(2*102400)=0,00054 л.
Ответ: V(H₂)=0,00054 л.
9. После взрыва 0,02 л смеси водорода с кислородом осталось 0,0032 л кислорода. Выразить в % по объему первоначальный состав смеси.
Прореагировало: 0,02 - 0,0032 = 0,0168л.
H2O2 2:1
V(H2)исх.= (0,0168/3 )*2= 0,0056*2 = 0,0112 л.
V(O2 )исх. = 0,0168/3 + 0,0032 = 0,0088 л.
H2 = 0,0112/0,02 = 56%
О2 = 0,0088/0,02 = 44%
Ответ: H2 = 56%
О2 = 44%
10. Вычислить массу азота, содержащуюся в 1 кг калийной селитры - KNO3; аммиачной селитры - NH4NO3; аммофоса - (NH4)HPO4.
КNO3
M(KNO3)=101 г/моль
n(KNO3)= 1000/101=9.9 моль
n(KNO3)= n(N)
m(N)= n x M=9.9 x 14=138.6 г
NH4NO3
M(NH4NO3)=80 г/Моль
n(NH4NO3)= m/M=1000/80= 12,5 моль
2n(NH4NO3)= n(N)
n(N)= 25 моль
m(N)= n x M= 25X14=350 г
(NH4)2HPO4
M(NH4)2HPO4)= 114 г/моль
n(NH4)2HPO4= 1000/114= 8,77 моль
n(NH4)2HPO4)= n(N)
m(N) = 8,77 x14= 122,78 г
11. При сжигании 3 г антрацита получилось 5,3 л СО2, измеренного при нормальных условиях. Сколько процентов углерода (по массе) содержит антрацит?
C+O2=CO2
х гр----5.3л СО2
12г-----22.4л
х=2.83г
n(C) = m(C)*100/3 = 94.3 %
Ответ: 94.3%
12. Через раствор, содержащий 7,4 г гидроксида кальция, пропустили 3,36 л диоксида углерода, взятого при нормальных условиях. Найти массу вещества, образовавшегося в результате реакции.
Ca(OH)2 + CO2 = CaCO3 + H2O
V=m/M;
V(Ca(OH)2 )= 7.4/74 = 0.1 моль.
V(CO2) = 3.36/22.4 = 0.15 моль ( в избытке)
m(CaCO3) = V*M = 0.1*100 = 10г.
Ответ: 10г.
13. К раствору, содержащему 6,8 г AlCl3, прилили раствор, содержащий 5 г КОН. Найти массу образовавшегося осадка
Находим количества веществ: n = m/M:
n(АlСl3) = 6.8/133 = 0.05 моль.
n(KOH) = 5/56 = 0.09 моль
соотношение: 0,05:0,09 = 1:1,8, по уравнению реакции:
AlCl3 + 3 KOH = Al(OH)3↓ + 3 KCl
соотношение должно быть 1:3. Отсюда недостаток КОН ограничивает реакцию, поэтому считаем выход продукта реакции по количеству КОН:
3 моль КОН ------------ 1 моль Al(OH)3
0,09 моль КОН --------- х моль Al(OH)3
х = 0,09*1/3 = 0,03 моль Al(OH)3
M(Al(OH)3) = 78 г/моль.
m(Al(OH)3) = n*M = 0,03*78 = 2,34 г.
Ответ: m(Al(OH)3) = 2,34 г.
14.Какой объем водорода (н.у.) надо затратить для восстановления 125 г(МОЛИБДЕН а не магний) МоО3 до металла
MoO3 + H2 = MoO2 + H2O
143 ----22.4л
125 ---- X л.
X = 19.5л. (В нете не нашел, так что делал приблизительно сам. Если можете, то проверьте.)
Ответ: 19.5л
15. Сколько граммов Na2SO3 потребуется для приготовления 5 л 8%-ного раствора (по массе). Плотность раствора = 1,075 г/мл?
Дано:
Vр-ра(Na2SO3)=5 л=5000 мл
n(Na2SO3)=8% или 0,08
ρр-ра(Na2SO3)=1,075 г/мл
m(Na2SO3)=?
Решение:
Определяем массу раствора по формуле:
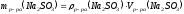 ;
;
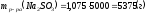 .
.
Находим массу Na2SO3, содержащегося в растворе:
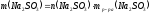 ;
;
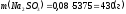 .
.
Ответ: 430 г.
16. Определить массовую долю вещества в растворе, полученном смешением 300 г 25%-ного и 400 г 40%-ного (по массе) растворов этого вещества.
Дано:
n1=25% или 0,25
mр-ра1=300 г
n2=40% или 0,4
mр-ра2=400 г
n3=?
Решение:
Определим массу полученного раствора:
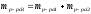 ;
;
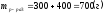 .
.
Найдем массы растворенного вещества в исходных растворах:
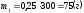 .
.
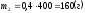 .
.
Тогда масса растворенного вещества в полученном растворе:
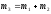 ;
;
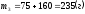 .
.
Вычислим массовую долю растворенного вещества в полученном растворе:
n3 = 235/700 = 33.6%
.
Ответ: 33,6%.
17. Какой объем воды надо прибавить к 100 мл 20%-ного (по массе) раствора H2SO4 (плотность = 1,14 г/мл), чтобы получить 5%-ный раствор?
1.Найдем массу первого раствора:
m1(раствора)=V*р(ро)=100*1,14=114 г
2. Найдем массу кислоты в нем:
m(H2SO4)=m1(раствора)*w(H2SO4)=114*0,2=22,8 г
3. Теперь находим массу нового раствора(после добавления воды),зная,что масса кислоты останется прежней и ее там будет уже 5%:
22,8 г - ------5%,
х г------------100%
,откуда х=22,8*100/5= 456 г(это m2(раствора))
4. Разница между массами второго и первого растворов и будет массой добавленной воды:
m(H2O)=m2(рствора) - m1(раствора)= 456 - 114 = 342 г, а так как плотность воды равна 1 г/мл,то масса и обем численно равны,т.е. объем будет 342 мл
Ответ: V(H2O) = 342мл.
18. К 500 мл 32%-ной (по массе) азотной кислоты, плотностью 1,2 г/мл, прибавили 1 л воды. Чему равна массовая доля HNO3 в полученном растворе?
Посчитаем массу изначального раствора и массу азотной кислоты:
m(раствора) = 500*1,2 = 600 г.
m(HNO3) = 600*0,32 = 192 г.
Потом долили 1л = 1000 г воды.
Масса раствора стала:
1000 + 600 = 1600 г.
Тогда массовая доля HNO3: 192*100%/1600 = 12%
Ответ: 12%.
19. Для приготовления 5%-ного (по массе) раствора MgSО4 взято 400 г MgSО4*7H2O. Найти массу полученного раствора.
массовая доля (MgSO4) в (MgSO4*7H2O)= 120/246= 0,4878(48,78%)
тогда m(MgSO4) в купоросе = 400 * 0,4878 = 195гр.;
m(H2O)= 400-195=205гр.
Зададим себе вопрос: в какой массе 5% раствора MgSO4 содержится 195гр. соли?
195/0,05 = 3900г.
Но в кристаллогидрате уже имеется 205гр воды ,тогда
масса раствора = 3900 -205 = 3695 г.
Ответ: масса раствора 3695г.
20. Какой объем 15%-ного (по массе) раствора H2SO4 плотностью 1,1 г/мл потребуется для полного растворения: а)24,3 г Mg? б) 27 г Al?
а) H2SO4 + Mg = MgSO4 + H2
V(Mg) = 24,3/24=1,01 моль.
По уравнению кислота с магнием реагируют в молярном соотношении 1:1.Значит, кислоты потребуется тоже 1,01 моль.
В граммах это 1,01*98=100 г.
Если раствор 15%-ный, то чтоб там было 100 г. чистой кислоты, его нужно взять 100/15*100=666,7 г.
Если каждый миллилитр такого раствора имеет массу 1,10 г, то объем его будет 666,7/1,10=606,1 мл
б) Составим уравнение химической реакции
3 H2SO4 + 2 Al => Al2(SO4)3 + 3 H2
1) Находим количество вещества алюминия n=m/M
n(Al) = 27/27 = 1 моль.
2) по уравнению находим кол-во вещества серной кислоты ( составляем пропорцию)
n ( H2SO4)/3 моль = 1 моль/ 2 моль
n( H2SO4)= 1,5 моль
3) находим массу серной кислоты m = n*M
m р.в. ( H2SO4) = 1,5 моль * 98 г/моль = 147 г
4) находим массу раствора серной кислоты
m раствора = (m р.в * 100%)/ n р.в
m( H2SO4) = 147 г * 100% / 15% = 980 г
5) находим объем раствора серной кислоты V= m раствора / p
V ( H2SO4) = 980 г / 1,1г/мл = 890,909 мл
21. Сколько граммов SO3 надо растворить в 400 г H2O, чтобы получить 15%-ный (по массе) раствор H2SO4?
Пусть m(SO3) - X , тогда
0,15 = Х/(400+Х)
0,15*(400+Х)=Х
60+0,15Х = Х
60 = 0.85Х
Х= 60/0.85
Х = 70.6 г.
Ответ: 70.6г.
