
Пятый тип диаграмм (рис.6) -
Когда компоненты А и В образуют химическое соединение, разлагающееся ниже т-ры плавления (т. наз. инконгруэнтное плавление).
Напр., при охлаждении
жидкости
(расплава) до нек-рой т-ры Тр
(рис. 6) кристаллизуется только компонент
В; при Тр
происходит перитектич. р-ция с образованием
хим. соед. АmВn
в твердом состоянии, т. е. р-ция твердая
фаза SВ
+ расплав
перитектич. состава твердая фаза
SА(m)В(n).
Если при этом в твердой фазе компонент
В имеется в избытке, в результате
перитектич. р-ции исчезает жидкая фаза
и при дальнейшем охлаждении ниже Тр
остается смесь двух твердых фаз SB
и SА(m)B(n).
Если же в твердой фазе компонента В
недостает, в результате р-ции исчезают
кристаллы
В и жидкость
при дальнейшем охлаждении выделяет
кристаллы
соед. АmВn,
изменяя свой состав по линии
ликвидуса РЕ. При т-ре ТЕ
происходит
эвтектич. кристаллизация
AmBn
и А. Возможны и др. варианты диаграммы.
Описанные типы диаграмм плавкости могут
усложняться из-за полиморфизма
как компонентов А и В, так и соед. АmВn.
 Рис.
6. Диаграмма плавкости двойной системы,
компоненты к-рой А и В образуют
инконгруэнтно плавящееся хим. соед.
АmВn.
Рис.
6. Диаграмма плавкости двойной системы,
компоненты к-рой А и В образуют
инконгруэнтно плавящееся хим. соед.
АmВn.
(Обозначения те же. что и на рис. 4 и 5).
Диаграммы растворимости.
При
отсутствии в системе твердых фаз Д. с.
состоит из области существования одной
жидкой фазы (т. наз. области гомогенности)
и области сосуществования двух насыщенных
жидких р-ров разного состава, образующих
несмешивающиеся друг с другом слои
(рис. 7). Кривая, разделяющая эти области,
наз. бинодалью. Так, при т-ре Т1
в равновесии находятся р-р компонента
В в А (его состав отвечает точке С) и р-р
А в В (его состав отвечает точке D). Если
однородный р-р 1 охладить до т-ры Т1,
он распадется на две жидкие фазы.
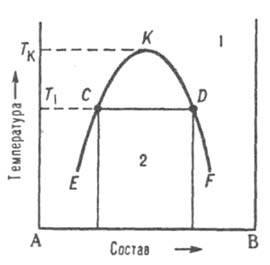 Рис.
7 Диаграмма растворимости
двойной системы, компоненты к-рой А и В
ограниченно растворимы друг в друге; 1
область существования однородного
р-ра, 2 область сосуществования двух
насыщенных р-ров; ECKDF - бинодаль, CD - нода,
К -верхняя критич. точка растворимости.
Рис.
7 Диаграмма растворимости
двойной системы, компоненты к-рой А и В
ограниченно растворимы друг в друге; 1
область существования однородного
р-ра, 2 область сосуществования двух
насыщенных р-ров; ECKDF - бинодаль, CD - нода,
К -верхняя критич. точка растворимости.
Обычно
при повышении т-ры взаимная растворимость
жидкостей
увеличивается, поэтому по своим св-вам
оба насыщенных р-ра, составы к-рых
изменяются по отрезкам бинодали ЕК и
KF, сближаются. Наконец, при т-ре Tк
различие
между ними исчезает; эта т-ра наз.
критической т-рой растворимости
(смешения), выше нее может существовать
лишь одна жидкая фаза. Большинство
систем с расслоением р-ров характеризуются
только одной критич. т-рой р-римости,
чаще всего верхней, т. е. на Д. с. имеют
незамкнутую снизу бинодаль. Если в таких
системах не образуются хим. соед., область
сосуществования двух жидких фаз
ограничена снизу кривой кристаллизации
одного из компонентов при т-ре превращения
жидкая фаза 1 жидкая фаза 2 + твердая
фаза. Такое трехфазное равновесие наз.
монотектическим; оно по своей термодинамич.
природе аналогично эвтектическому или
эвтектоидному. При синтектическом
трехфазном равновесии две жидкие фазы
взаимодействуют с образованием твердого
соед. Такое равновесие аналогично
перитектическому. В нек-рых системах
бинодаль имеет форму замкнутой кривой
(овал), т. е. система имеет две т-ры смешения
верхнюю и нижнюю. Диаграмма равновесия
жидкость-пар. При р = const каждому составу
жидкой смеси отвечает определенная
т-ра равновесия с паром
и определенный состав пара,
отличающийся, как правило, от состава
жидкой смеси. На Д. с. (рис. 8, а) кривые
кипения
и конденсации
изображают зависимости т-р начала
кипения
и конденсации
от состава и отделяют поля жидкости
L и пара
V от поля (L + V)гетерог. состояний
жидкость-пар. На кривой кипения
м. б. экстремум: максимум (рис. 8, б) или
минимум (рис. 8, в); в этих точках кривая
кипения
касается кривой конденсации,
т. е. составы равновесных жидкости
и пара
совпадают Жидкие смеси такого состава
полностью выкипают, подобно чистым
жидкостям,
при постоянной т-ре без изменения состава
(см. Азеотропные смеси). Д. с., описывающие
равновесия двухкомпонентных твердых
р-ров с жидкими р-рами и жидких р-ров с
паром,
подобны.
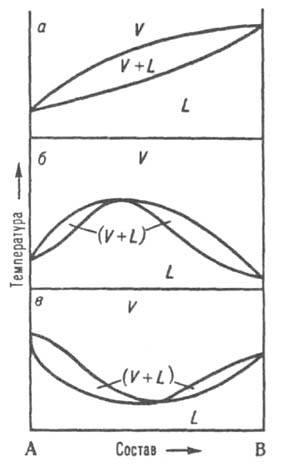 Рис.
8. Диаграммы
состояния,
двойной системы, описывающие равновесие
жидкость
- пар.
L и V области существования жидкости
и пара
соотв.. (L + V) область сосуществования
жидкой и паровой фаз; а система без
азеотропной точки; б и в два типа
азеотропных
смесей
Рис.
8. Диаграммы
состояния,
двойной системы, описывающие равновесие
жидкость
- пар.
L и V области существования жидкости
и пара
соотв.. (L + V) область сосуществования
жидкой и паровой фаз; а система без
азеотропной точки; б и в два типа
азеотропных
смесей
Тройные (трехкомпонентные) системы.
Состояния
тройных систем однозначно определяются
четырьмя независимыми параметрами: Т,
р и молярными (массовыми) долями двух
компонентов (доля третьего компонента
определяется из условия равенства
единице суммы долей всех компонентов).
Поэтому при построении Д. с. тройных
систем один из независимых параметров
(р или Т) или два (р и T) фиксируют и
рассматривают пространственные изобарные
или изотермич. диаграммы или плоские
изобарно-изотермич. диаграммы,
соответствующие одному из сечений
пространственной Д. с. Каждому составу
тройной смеси отвечает определенная
точка на плоскости составов. Область
возможных составов тройных систем наз.
композиционным треугольником или
треугольником составов. В системе
прямоугольных координат он представляет
собой прямоугольный равнобедренный
треугольник, вершины к-рого отвечают
компонентам А, В и С, а стороны - двойным
смесям АВ, ВС и СА. Более распространено
использование равностороннего композиц.
треугольника. В этом случае все компоненты
равноправны, а за начало координат можно
с равным основанием принять любую из
его вершин (см. Многокомпонентные
системы). Для построения пространств.
изобарной или изотермич. Д. с. по
координатной оси, перпендикулярной
композиц. треугольнику, откладывают
соотв. T или р. При этом фигуративные
точки системы в целом и ее трехкомпонентных
фаз оказываются расположенными внутри
трехгранной призмы, грани к-рой изображают
двойные системы, ребра -однокомпонентные
системы. На рис. 9, а изображена простейшая
диаграмма плавкости тройной системы,
компоненты к-рой А, В и С не образуют
друг с другом твердых р-ров и (или) хим.
соед. и не расслаиваются в жидком
состоянии (неограниченно взаимно
растворимы). Пов-сть т-р начала
кристаллизации
тройных расплавов
(пов-сть ликвидуса) состоит из трех полей
-ТAЕ1ЕЕ3,
TBE1EE2
и ТCE2EE3,
отвечающих кристаллизации
А, В и С соотв. и разделенных тремя
пограничными кривыми E1E,
E2E
и E3E.
Ортогональные проекции пограничных
линий
на композиц. треугольник образуют т.
наз. плоскую диаграмму плавкости тройной
системы (рис. 9, б) с тремя полями
кристаллизации
компонентов AE1EE3,
ВE1EE2,
СE2EE3
Более полную информацию о системе дает
плоская диаграмма с нанесенными на ней
изотермами проекциями кривых пересечения
пов-сти ликвидуса равноотстоящими
плоскостями (рис. 9, в). Рассмотрим с
помощью Д. с. процессы, происходящие при
охлаждении жидкого расплава,
первоначальное состояние к-рого
изображается, напр., фигуративной точкой
М. Поскольку вертикальная прямая,
проходящая через М, пересекает поле
кристаллизации
В (на плоской диаграмме проекция точки
М находится в поле кристаллизации
В), первым начинает кристаллизоваться
именно этот компонент.
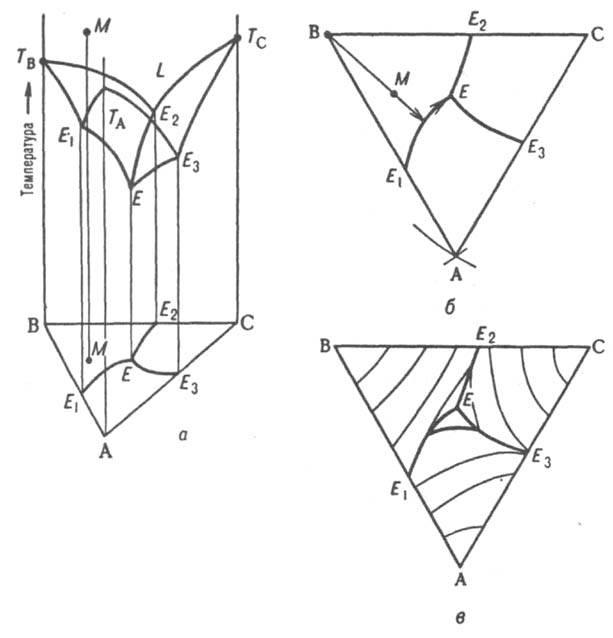 Рис.
9. Диаграмма плавкости тройной системы
эвтектического типа: а - пространственная
диаграмма, б плоская диаграмма, в плоская
диаграмма с нанесенными на ней изотермами.
ТА,
ТB,
ТC
т-ры плавления
компонентов А, В и С соотв., L область
существования жидкой фазы; E1,
E2,
E3
эвтектич. точки двойных систем АВ, ВС и
СА соотв., Е тройная эвтектич. точка; М
фигуративная точка системы.
Рис.
9. Диаграмма плавкости тройной системы
эвтектического типа: а - пространственная
диаграмма, б плоская диаграмма, в плоская
диаграмма с нанесенными на ней изотермами.
ТА,
ТB,
ТC
т-ры плавления
компонентов А, В и С соотв., L область
существования жидкой фазы; E1,
E2,
E3
эвтектич. точки двойных систем АВ, ВС и
СА соотв., Е тройная эвтектич. точка; М
фигуративная точка системы.
Первоначально однофазная и четырехвариант-ная (условно трехвариантная) система становится двухфазной и трехвариантной (условно дивариантной). Соотношение кол-в А и С в расплаве при кристаллизации В не изменяется, поэтому состав жидкости в ходе кристаллизации В изменяется вдоль прямой (луча кристаллизации), проходящей через точки М и В в направлении удаления от вершины В. В точке пересечения луча кристаллизации с пограничной кривой Е1Е начинает кристаллизоваться еще и А, система становится трехфазной (условно моновариантной). При дальнейшем охлаждении фигуративная точка жидкой фазы смещается вдоль пограничной линии Е1Е по направлению к тройной эвтектич. точке Е, в к-рой происходит кристаллизация всех трех компонентов при постоянной т-ре, завершающаяся полным затвердеванием системы. Эвтектич. т-ра отвечает условно нонвариантному равновесию всех четырех фаз. Кристаллизация тройной жидкой смеси любого состава в системе такого типа всегда заканчивается образованием тройной эвтектики, т. е. пов-стью солидуса рассматриваемой системы является горизонтальная плоскость, проходящая через точку Е. Обычно рассматривают изотермич. сечение изобарной пространственной диаграммы, наз. изобарно-изотермической. Если при нек-рой т-ре все три компонента - жидкости, из к-рых две ограниченно смешиваются друг с другом, на Д. с., как и в случае двойных систем, имеется область сосуществования двух жидких фаз, ограниченная бинодалью ЕKF (рис. 10). Если жидким является лишь один из компонентов, напр., вода в системе, содержащей еще две соли В и С с общим ионом, диаграмма растворимости (рис. 11) состоит из четырех полей, отвечающих одной жидкой фазе L (поле ADEF), двухфазным состояниям (L + SВ) (поле DEB) и (L + SC) (поле FEC) с йодами, проходящими соотв. через точки В и С, и условно нонвариантному трехфазному состоянию (L+ SB + SС) (поле ВЕС), в к-ром твердые В и С находятся в равновесии с насыщенным этими в-вами р-ром состава Е, к-рый наз. эвтоническим; отвечающая ему фигуративная точка наз. эвтонической или эвтоникой.
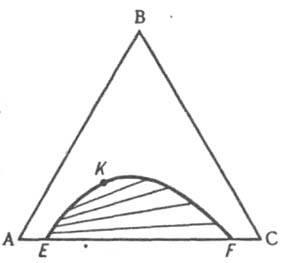 Рис.
10. Изобарно-изотермич. диаграмма
состояния
тройной системы ABC с ограниченной
взаимной растворимостью
компонентов А и С в жидком состоянии.
EKF бинодаль, К - верхняя критич. точка
растворимости.
Рис.
10. Изобарно-изотермич. диаграмма
состояния
тройной системы ABC с ограниченной
взаимной растворимостью
компонентов А и С в жидком состоянии.
EKF бинодаль, К - верхняя критич. точка
растворимости.
 Рис.
11. Изобарно-изотермич. диаграмма
растворимости
твердых В и С в жидком растворителе
A. DE и EF - линии
растворимости
(кристаллизации), Е - эвтонич точка
(эвтоника).
Рис.
11. Изобарно-изотермич. диаграмма
растворимости
твердых В и С в жидком растворителе
A. DE и EF - линии
растворимости
(кристаллизации), Е - эвтонич точка
(эвтоника).
Линии DE и FE - геометрич. место точек жидких фаз, находящихся в равновесии соотв. с твердыми В и С; они наз. линиями растворимости, или линиями кристаллизации, этих компонентов, т. к. в частном случае водных р-ров при изотермич. испарении воды, сопровождающемся движением фигуративной точки жидкости вдоль луча испарения, выходящего из вершины А, по достижении фигуративной точкой одной из этих линий начинается кристаллизация соответствующего компонента. При образовании в тройной системе хим. соед. (двойных солей, кристаллогидратов, интерметаллич. соед. и т. п.), а также твердых р-ров пространственные Д. с. и их плоские сечения усложняются. Для тройных водно-солевых систем, содержащих соли с общими ионами, при построении изобарно-изотермич. Д. с. по координатным осям (в прямоугольной системе координат) иногда откладывают не массовые или молярные доли компонентов, а молярные концентрации солей или молярную долю одной из солей в общей солевой массе и число молей воды на 100 молей солевой массы. Разработаны спец. методы построения Д. с. для тройных систем, между компонентами к-рых возможны р-ции замещения (обмена) или вытеснения, а также для систем, содержащих четыре и более компонентов.
Окислительно-восстановительные процессы (ОВР). Основы электрохимии
|
|
1 |
. Влияние физико-химических параметров (температуры, концентрации реагентов, их природы, среды и др.) на глубину и направление протекания ОВР.
