
Тема: Фазовые равновесия в гетерогенных системах
Содержание:
-
Понятия о термическом анализе.
-
Построение диаграмм состояния различных систем.
-
Правило фаз Гиббса. Правило рычага
ДИАГРАММА СОСТОЯНИЯ
(фазовая диаграмма, Д. С.) –
– графическое изображение всех возможных сос-тояний т/д-кой системы на плоскости (двумерные Д. С.) или в пространстве (трехмерные Д. С.) от основных параметров состояния: температуры Т, давления Р и состава Х (обычно выражаемого массовыми или молярными концентрациями (долями) компонентов.
Для сложных систем, состоящих из многих фаз и компонентов, построение Д. С. является единственным методом, позволяющим на практике установить, сколько фаз и какие конкретно фазы образуют систему при данных значениях параметров состояния.
Каждое реально существующее состояние системы на Д. С. изображается так называемой фигуративной точкой; области существования одной фазы на двумерных Д. С. отвечают участки плоскости, на трехмерных Д. С. – про-странства; условиям сосуществования фаз - соответствующие линии или поверхности.
Изменение фазового состояния системы на Д. С. рассматривается как движение фигурати-вной точки.
Таким образом, анализ относительного располо-жения участков, поверхностей, линий и точек, которые образуют Д.С., позволяет однозначно и наглядно определять условия фазового равнове-сия, появления в системе новых фаз, химических соединений, образования и распада жидких и твердых растворов и т. п.
Д. С. используют в материаловедении, металлу-ргии, нефтепереработке, хим. технологии (в част-ности, при разработке методов разделения в-в), в производствах электронной техники и микроэ-лектроники. По Д. С. определяют направлен-ность процессов, связанных с фазовыми перехо-дами, осуществляют выбор режимов термообра-ботки, находят оптимальные составы сплавов.
Теоретическими основами построения и ин-терпретации Д.С. равновесных систем являются: 1) условие фазового равновесия гетерогенной си-стемы – равенство химических потенциалов μi каждого i-го компонента системы во всех фа-зах системы.
Химический потенциал (μi) i-го компонента системы – это энергия Гиббса, приходящаяся на 1 моль вещества.
2) условие химического и термодинамического равновесия: сумма хим. потенциалов (полная энергия Гиббса) вступающих в х. р. веществ при равновесии равна аналогичной сумме для про-дуктов реакции; т.е. изменение энергии Гиббса равно нулю (∆G = 0).
3) правило фаз Гиббса: число компонентов (независимых) К, число фаз Ф, число интенсивных внешних параметров П и число степенй свободы С (вариантность системы)) связаны соотношением:
С = К + П – Ф (или: С = К – Ф + П).
Вариантность системы С – это число независимых параметров состояния (число степеней свободы), которые можно в определен-ных пределах изменять без изменения числа и природы фаз.
В физико-химических процессах часто П = 2 (когда на состояние системы влияют только два интенсивных параметра –Т и Р, температура и давление. Если же учитывают и др. параметры, (напр., напряженности электромагнитного или гравитационного полей), - вариантность системы соответственно увеличивается.
Различают состояния (равновесия): нонвариантные (С = 0), моновариантные (С = 1), бивариантные (С = 2) и т. д.;
4) правило о соприкасающихся пространствах состояния: если два разных пространства сос-тояния (участки плоскости в случае плоской ди-аграммы) соприкасаются по линии, то они разли-чаются между собой на одну фазу, если участки плоскости соприкасаются в точке, то состояния различаются на три фазы.
Для построения Д. С. расчетным путем необ-ходимо знать зависимости химических потенци-алов всех компонентов системы от Т, Р и состава Х фаз. Приближенные методы расчета с приме-нением компьютерных программ интенсивно раз-виваются, в частности, для многокомпонентных сплавов. Однако в н. вр. Д. С. строят на основе экспериментальных данных, получаемых глав-ным образом путем термического анализа, к-рый позволяет определять зависимости Т плавления или кристаллизации от состава системы, а также изучением равновесий жидкость - пар и жидкость - жидкость. Широко используют рентгеновский фазовый анализ, данные о микроструктуре затвер-девших расплавов, измерения физических свойств фаз (см. Диаграмма состав-свойство).
Изучение Д. С. составляет основное содержа-ние физико-химического анализа.
Однокомпонентные системы
Однокомпонентной системой является любое простое в-во или хим. соед., обладающее строго определенным составом в газообразном, жидком и твердом состояниях.
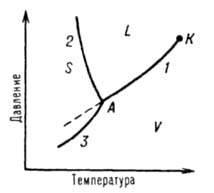
Д. С.
обычно строят на плоскости в координа-тах
«Т-Р» (рис. 1). Фазовые поля (области
существования) пара
V, жидкости
L и твердой фазы S дивариантны, т.е.
допускают одновременное изменение двух
параметров
состояния
- Т и р.
 (для
Н2О)
Рис. 1 Диаграмма
состояния
однокомпонентной
системы: S,
L и V
- соотв. области существования твердой,
жидкой и паровой фаз; 1,
2 и 3
- кривые кипения
(испарения), плавления
и возгонки (суб-лимации) соотв., К
- критическая
точка; А
– трой-ная
точка.
(для
Н2О)
Рис. 1 Диаграмма
состояния
однокомпонентной
системы: S,
L и V
- соотв. области существования твердой,
жидкой и паровой фаз; 1,
2 и 3
- кривые кипения
(испарения), плавления
и возгонки (суб-лимации) соотв., К
- критическая
точка; А
– трой-ная
точка.
Двухфазное равновесие между жидкостью и паром изображается кривой 1 (линия 1) - кипения (или испарения);
между жидкостью и кристаллами - кривой 2 (плавления) ;
между кристаллами и паром – кривой 3 -возгонки (или сублимации).
Все двухфазные равновесия моновариантны, т. е. не нарушаются при произвольном измене-нии только одного из параметров, Т или Р; при этом значение другого определяется из Д. С.
Например, кривая кипения 1 характеризует зависимость давления насыщенного пара в-ва от Т или зависимость Т кипения в-ва от внешнего давления.
Со стороны повышенных Т и Р эта кривая заканчивается в критической точке К, начиная с которой исчезает различие в свойствах между жидкостью и ее паром.
Жидкость может находиться в переохлажден-ном состоянии (пунктирная линия на рис. 1).
Аналогично кривая плавления характеризует зависимость Т плавления от внешнего давления, кривая возгонки (или сублимации) – температур-ную зависимость давления насыщенного пара над твердым веществом.
На рис. 1 ход кривой плавления соответствует повышению Т плавления с ростом давления, од-нако возможно и понижение Т плавления с дав-лением (см. уравнение Клапейрона – Клаузиуса).
Все три кривые моновариантных фазовых равновесий сходятся в тройной точке А, отвечающей параметрам состояния, при которых нахо-дятся в нонвариантном равновесии три фазы.
Д. С. усложняется, если вещество в твердом состоянии может существовать в различных кри-сталлических модификациях. Каждой модифи-кации отвечает свое фазовое поле. Линии моно-вариантных равновесий, разграничивающие эти поля, называют кривыми превращений.
Двойные (двухкомпонентные) системы
Состояние двойной системы определяется тремя независимыми параметрами: Т, Р и соста-вом Х (содержанием одного из компонентов), поэтому Д. С. такой системы трехмерна. Обычно принимают постоянными Т или Р и рассматрива-ют соответствующие плоские сечения Д. С., на-зываемые соотв-но изотермическими (Р – Х) или изобарными (Т – Х) Д. С.
В конденсированных системах роль давления сравнительно невелика и в качестве параметров состояния обычно выбирают Т и состав Х (конце-нтрацию одного из компонентов).
Диаграммы плавкости
- Такие Д. С. служат для установления усло-вий равновесия между твердыми и жидкими фазами. Рассмотрим их основные типы.
Первый тип диаграммы (простейший вариант Д.С., рис.2) –
-
соответствует случаю, когда компоненты
А и В образуют одну жидкую фазу (расплав
или р-р), при охлаждении которой только
выделяются (кристаллизуются) индивидуальные
в-ва (не образуются ни твердые растворы,
ни химические соединения).
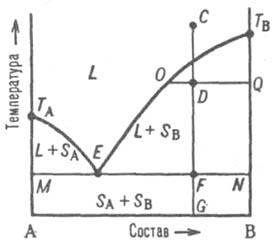 Рис.
2. Диаграмма
плавкости двойной системы,
компоненты которой А
и В
не образуют
твердых растворов.
Рис.
2. Диаграмма
плавкости двойной системы,
компоненты которой А
и В
не образуют
твердых растворов.
На данной диаграмме плавкости:
L - область существования жидкости (расплава), (L + SA) и (L + SB) - области сосуществования жидкой фазы и твердых А и В соотв.;
(SA + SB) - область существования мех. смеси твердых А и В;
ТАETВ и MEN - линии ликвидуса и солидуса соотв., E - эвтектическая точка;
С, D, F, G, О и Q - фигуративные точки.
На Д. С. (рис. 2) линия, изображающая зависимость от состава температуры начала выделения из жидкой фазы твердого компонента (начала равновесной кристаллизации), называ-ют линией ликвидуса. Она состоит из двух ветвей ТАЕ и ТВЕ, отграничивающих фазовое поле жидкости L от полей сосуществования жидкой фазы с твердыми А и В соотв. (поля L + SA и L + SB). Линия, изображающая зависимость от состава т-ры окончания равновесной кристаллизации при охлаждении (или начала плавления при нагр.), наз. линией солидуса. Ниже нее расположено фазовое поле SA + SB твердого состояния системы, отвечающее условиям сосуществования двух твердых фаз. Происходящие в системе фазовые изменения описываются следующим образом. При охлаждении жидкой фазы, напр., из начального состояния С, фигуративная точка системы в целом движется вниз вдоль прямой CG. В точке ее пересечения с линией ликвидуса начинается кристаллизация компонента В, система становится двухфазной и бивариантной или, поскольку давление фиксировано, условно моновариантной. По мере кристаллизации вещества В жидкость обогащается компонентом А, ее состав изменяется по ветви ликвидуса и по достижении системой состояния, изображаемого, напр., фигуративной точкой D, жидкой и твердой фазам соответствуют фигуративные точки О и Q. Прямые, соединяющие фигуративные точки двух находящихся в равновесии фаз, наз. нодами (или коннодами); горизонтальные ноды, подобные OQ, можно провести через любые точки фазовых полей, отвечающих гетерог. состояниям системы. При выражении состава в массовых (молярных) долях отношение отрезков OD и DQ пропорционально отношению масс (чисел молей) твердой и жидкой фаз (т. наз. правило рычага). Оно позволяет рассчитать по Д.С. относительные кол-ва фаз при любой т-ре, чтобы, напр., опреде-лить полноту кристаллизации или степень извлечения данного компонента из жидкой фазы в твердую.
В точке F пересечения прямой CG с линией солидуса начинается кристаллизация компонента А. Система становится трехфазной (жидкость и две твердые фазы А и В) и моновариантной (условно нонвариантной), т.е. при постоянном давлении совместная кристаллизация двух твердых фаз (т. наз. эвтектическая кристаллизация) протекает при постоянных т-ре и составе жидкой фазы, отвечающих координатам эвтектической точки Е. После завершения эвтектической кристаллизации система состоит из двух твердых фаз и является дивариантной (условно моновариантной). В обсуждаемом случае система после затвердевания состоит из относительно крупных кристаллов В и мелкодисперсной смеси совместно возникших при эвтектич. кристаллизации кристаллов А и В; такую смесь называют эвтектикой. Если исходная жидкость имела эвтектический состав, продукт ее затвердевания - мелкодисперсная эвтектика без примеси крупных кристаллов какого-либо из компонентов. При нагревании смеси твердых А и В описанные явления протекают в обратной последовательности: изотермическое образование жидкости эвтектического состава вплоть до исчерпания какого-либо из твердых компонентов и растворение в жидкости оставшегося твердого компонента при дальнейшем повышении т-ры, которое завершается по достижении фигуративной точкой системы линии ликвидуса.
Третий тип Д.С.- диаграммы плавкости двухкомпонентных систем (рис.3) -
- характерен для случая ограниченной р-римости компонентов в твердом состоянии.
Твердый р-р В в А (обозначается -раствор) образуется лишь до определенной концентрации В, твердый р-р А в В (-раствор) - лишь до определенной концентрации А.
Для таких систем возможны два случая трехфазного равновесия:
I. Эвтектическое равновесие:
1)
жидкого расплава
состава Е, твердого р-ра , концентрация
которого соответствует точке М, и
твердого р-ра , концентрация
которого соответствует точке N, при
эвтектической температуре, к-рая, как
правило, ниже температур плавления
TA
и ТB
обоих компонентов (рис. 3).
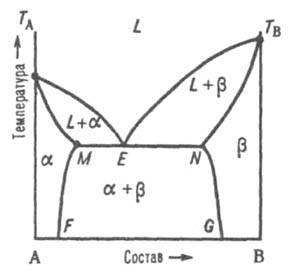 Рис.
3. Диаграмма плавкости двойной системы
эвтектич. типа с ограниченными твердыми
Рис.
3. Диаграмма плавкости двойной системы
эвтектич. типа с ограниченными твердыми
р-рами.
2) L, и - области существования жидкой фазы (расплав) и твердых р-ров В в А и А в В соотв.; (L + ) и (L + ) - области сосуществования жидкой фазы и твердых р-ров и соотв.; ( + ) - область сосуществования двух твердых р-ров. ТАЕТВ и MEN - линии ликвидуса и солидуса соотв., E - точка эвтектики.
3) При охлаждении затвердевшей смеси ниже линии солидуса MN происходит изменение концентраций твердых р-ров и соотв. по линиям MF и NG, к-рые дают температурную зависимость растворимости в твердом состоянии В в А и А в В.
II. Равновесие при т-ре Тр :
4) Т-ра Тр – промежуточная между т-рами плавления ТА и ТB. Если, напр., т-ра начала кристаллизации расплава с высоким содержанием А выше ТА (рис. 4), а с высоким содержанием В - ниже ТB, линия ликвидуса состоит из двух ветвей ТАР и ТВР, соответствующих кристаллизации твердых р-ров и .
Разновидность второго типа Д.С.- диаграммы плавкости двухкомпонентных систем (рис.4) -
- перитектического
типа, также характерен для случая
ограниченной р-римости компонентов в
твердом состоянии:
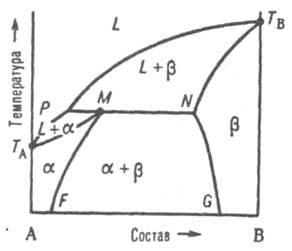 Рис.
4. Диаграмма плавкости двойной системы
перитектического типа.
Рис.
4. Диаграмма плавкости двойной системы
перитектического типа.
Р - перитектич. точка, остальные обозначения те же, что и на рис. 3.
Эти ветви пересекаются в т. наз. перитектической точке Р - фигуративной точке жидкой фазы, к-рая может равновесно сосуществовать одновременно с двумя твердыми растворами и , составы которых определяются точками М и N. Линия солидуса состоит из трех ветвей: ТAМ, MN и NTB.
При охлаждении двухфазной системы (L + ) до перитектич. т-ры Тр в системе появляется третья фаза - р-р . При протекании перитектич. превращения (фазовой р-ции) жидкость (расплав) + твердый р-р твердый р-р система моновариантна, или условно нонвариантна, т. е. при данном давлении равновесие возможно лишь при постоянных т-ре и составах каждой из фаз. Если после окончания перитектич. р-ции остается избыток жидкой фазы, система переходит в двухфазное поле (L + ). При дальнейшем охлаждении происходит кристаллизация твердого -раствора. Послед. понижение т-ры (ниже линии МF) приводит к тому, что однородный твердый -раствор становится неустойчивым и, распадаясь, выделяет некоторое кол-во раствора, состав которого отвечает линии NG. Если после окончания перитектич. реакции полностью исчезает жидкая фаза, система переходит в двухфазное поле + ; по мере снижения т-ры составы - и -растворов изменяются в соответствии с ходом линий MF и NG.
Возможны и др. трехфазные равновесия, например, при наличии у одного из компонентов полиморфных модификаций, когда все три сосуществующие фазы являются твердыми. Полиморфная модификация может участвовать в т. наз. эвтектоидном превращении + или в перитектоидном превращении + , в принципе аналогичных рассмотренным выше эвтектич. и перитектич. превращениям. При метатектическом превращении модификация при охлаждении распадается на твердую и жидкую фазы: + L.
Четвертый тип диаграммы (рис.5) – с образованием устойчивого химического соединения -
-
описывает состояния двойной системы,
компоненты к-рой А и В образуют устойчивое
химическое соединение, которое не
разлагается вплоть до температуры
плавления
и переходит в жидкую фазу того же состава,
т. е. плавится конгруэнтно.
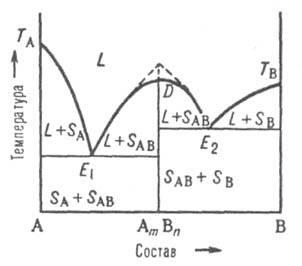 Рис.
5. Диаграмма плавкости двойной системы,
компоненты к-рой А и В образуют конгруэнтно
плавящееся хим. соед. АmВn.
Рис.
5. Диаграмма плавкости двойной системы,
компоненты к-рой А и В образуют конгруэнтно
плавящееся хим. соед. АmВn.
D - сингулярный максимум, Е1 и Е2 - эвтектич. точки; остальные обозначения те же, что и на рис. 3 и 4.
В точке плавления, соответствующей стехиометрич. составу АmВn, на линии ликвидуса имеется сингулярный максимум (рис. 5); это значит, что линия D - АmВn разделяет систему на две подсистемы. На диаграмме максимуму отвечает излом (показан пунктиром на рис. 5). В каждой из подсистем взаимодействие между компонентами, соответственно, А и АmВn, В и АmВn, может быть представлено диаграммами эвтектического или перитектического (или любого другого) типа.
Если соед. AmBn частично диссоциировано в жидкой фазе, максимум на кривой ликвидуса несколько сглажен в соответствии со степенью диссоциации.
Если соед. АmВn диссоциирует и в твердом состоянии, то сглаженный максимум будет и на линии солидуса. Однако независимо от вида максимума, общий характер фазового равновесия в системе определяется характером взаимодействия соед. АmВn с компонентами А и В.
