
Лекции по химии
.pdf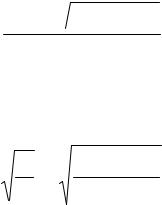
43
Отрицательного значения степень диссоциации иметь не может, поэтому
α = − K + 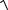 K2 + 4KC = 2,74 10−4 . 2C
K2 + 4KC = 2,74 10−4 . 2C
Зная заранее, что степень диссоциации очень мала (а этого следует ожидать, учитывая очень малое значение константы диссоциации), можно применить приближенное соотношение:
α = |
K |
= |
7,5 10−10 |
= 2,74 10−4 . |
|
C |
|
0,01 |
|
Это значение отличается от полученного выше только в третьем знаке после запятой, в данном случае – несущественно.
4. Рассчитайте рН 1М раствора бората натрия NaВO2
Решение.
NaВO2 – соль, образованная сильным основанием (NaOH) и слабой кислотой (HBO2). Уравнения реакции гидролиза в молекулярном и ионном виде
NaBO2 + H2O = HBO2 + NaOH,
BO−2 + H2O = HBO2 + OH− ,
показывают, что среда в результате гидролиза становится щелочной. Значение рН среды в данном случае определяется величинами концентрации соли и константы диссоциации слабой кислоты.
Учитывая, что концентрации анионов BO−2 и недиссоциированной кислоты HBO2 должны в сумме давать концентрацию соли C, получаем для константы диссоциации выражение:
K = |
[H+ ][BO2− ] |
= |
[H+ ](C − [HBO2 ]) |
. |
[HBO2 ] |
|
|||
|
|
[HBO2 ] |
||
С другой стороны, по уравнению реакции гидролиза, каждая образовавшаяся недиссоциированная молекула HBO2
соответствует одному образовавшемуся иону OH–. Тогда, учитывая имевшуюся уже в чистой воде концентрацию гидроксид-анионов 10–7 моль/л, можно записать выражение для ионного произведения воды в этом растворе:
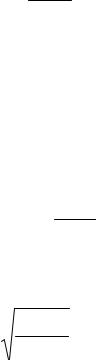
44
ния воды в этом растворе:
KW = [H+ ](10−7 + [HBO2 ]).
Поскольку при гидролизе соли количество образовавшихся гидроксид-анионов на 3-4 порядка больше, чем 10–7, первым слагаемым можно пренебречь. Тогда получаем, что концентрация недиссоциированной кислоты
[HBO2 ] = KW , [H+ ]
а выражение для константы диссоциации кислоты принимает вид:
[H+ ]2 |
|
KW |
|
|
|||
C − |
|
|
|||||
|
|
||||||
|
|
|
[H |
+ |
|
|
|
K = |
|
|
|
] |
. |
||
|
KW |
|
|
|
|
||
|
|
|
|
|
|
|
|
В свою очередь, очевидно, C >> KW , так как концентрация
[H+ ]
ионов водорода заведомо на несколько порядков меньше 10–14. Тогда концентрация ионов водорода составляет
[H+ ] = |
KW K |
, |
|
C |
|
и рН легко рассчитывается по формуле
pH = |
14 + pK − pC |
= |
14 + 9,12 − 0 |
= 11,56. |
|||
|
2 |
|
2 |
||||
|
|
|
|||||
3.4.Лабораторная работа №3.
Вданной лабораторной работе значение рН растворов определяется с помощью специально откалиброванного милливольтметра, измеряющего разность потенциалов между стеклянным электродом (потенциал которого прямо пропорционален рН раствора) и электродом сравнения (хлорид-серебряный электрод).
Передняя панель прибора рН-121 представлена на рис. 3. Шкала 1 имеет пять соответствующих диапазонов. Выбор диапазона осуществляется нажатием соответствующих клавиш право-
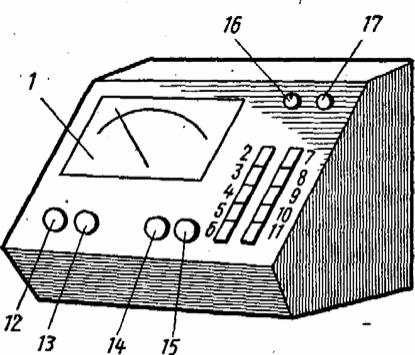
45
го ряда 8-11. Назначение клавишных кнопок на передней панели обозначено соответствующими надписями. Клавиши левого ряда служат для переключения рода работы прибора и измерения температуры раствора: «рН» 2 – измерение рН; «+ mV» 3 или «-mV» 4 включают при измерении э.д.с. Клавиши «+» или «-», 3, 4 нажимают в зависимости от величины и знака измеряемой э.д.с.
Рис. 3 Передняя панель pH– метра–милливольтметра рН-121
Ручка 16 служит для установления температуры измеряемого раствора; контрольная лампочка 17 сигнализирует о включении прибора в сеть.
Клавиша «0, t» 5 предназначена для измерения температуры раствора и должна быть всегда нажата по окончании измерения и при замене испытуемых растворов. Клавиша 7 и ручка «НИ» 15 используются только в том случае, когда прибор работает как «нуль-индикатор».
Хлорид-серебряный электрод сравнения (ЭВЛ-1МЗ), подключается на задней панели прибора к гнезду «всп».
При работе со стеклянным электродом измерение рН проводят следующим образом.
1. Заземляют прибор.
46
2.Нажимают кнопку «0, t».
3.Включают прибор в сеть и прогревают в течение не менее
25 мин.
4.Наливают испытуемый раствор в стаканчик и опускают в него индикаторный электрод и электрод сравнения. Электроды перед погружением в раствор тщательно промывают дистиллированной водой, остатки воды с электродов осторожно удаляют фильтровальной бумагой.
5.Нажимают кнопку «-1–14» переключателя диапазонов и кнопку «рН» переключателя рода работы.
6.В соответствии с полученным на самом грубом диапазоне значением pH выбирают более узкий диапазон, нажимая одну из кнопок («-1–4»; «4–9»; «9–14»), и по соответствующей шкале прибора получают значение рН с точностью до 2 знака после запятой.
7.Перед заменой раствора нажимают кнопку «0, t».
ВНИМАНИЕ: Прибор рН-121 требует тщательной предварительной настройки с использованием специальной аппаратуры. В связи с этим в ходе выполнения работы категорически запрещается вращать ручки настройки 12 – 15!
По окончании работы электроды необходимо промыть и оставить погруженными в стаканчик с дистиллированной водой.
Порядок выполнения работы.
Опыт 1. Определение рН растворов соляной кислоты. Стаканчик для измерения рН (установленный на рН-метре)
ополосните исследуемым 0,01М раствором соляной кислоты, затем налейте в него такое количество раствора, чтобы в него могли погрузиться электроды. Электроды погрузите в раствор и измерьте рН, как описано выше. Вычислите теоретическое значение рН исследуемого раствора. Результаты измерения и вычисления запишите в таблицу 5.
Отберите из стаканчика пипеткой 10 мл раствора НСl, который использовали в предыдущем опыте, перенесите в мерную колбу на 100 мл. Объем раствора доведите до метки (по нижнему мениску) дистиллированной водой. Закройте колбу пpoбкой и раствор тщательно перемешайте. Раствор окажется разбавлен-
47
ным в 10 раз и его концентрация составит 0,001 моль/л. После этого определите рН приготовленного раствора так же, как предыдущего. Результат измерения внесите в таблицу 5. В эту же таблицу внесите результат расчета теоретического значения рН 0,001М раствора соляной кислоты.
Таблица 5.
Результаты измерении и вычислений рН растворов сильного электролита
№ |
С |
рНэкс |
[H+] |
рНтеор |
|
опыта |
(моль/л) |
(моль/л) |
|||
|
|
||||
|
|
|
|
|
|
1 |
|
|
|
|
|
|
|
|
|
|
|
2 |
|
|
|
|
|
|
|
|
|
|
Опыт 2. Определение рН растворов уксусной кислоты Измерение рН предварительно приготовленного 0,1М рас-
твора уксусной кислоты CH3COOH проведите в последовательности, описанной в опыте 1. Значение измеренной величины рН раствора используйте для расчета константы диссоциации кислоты. Результаты измерений и вычислений внесите в таблицу 6.
Таблица 6.
Результаты измерении рН и вычислений некоторых физикохимических характеристик растворов слабого электролита
№ |
С |
рС |
рН |
рК |
К |
α |
опыта |
(моль/л) |
|||||
|
|
|
|
|
|
|
3 |
|
|
|
|
|
|
|
|
|
|
|
|
|
4 |
|
|
|
|
|
|
|
|
|
|
|
|
|
По методике, описанной в опыте 1, приготовьте 0,01М раствор уксусной кислоты и проведите измерение рН. Вычислите
48
величину константы диссоциации уксусной кислоты. Используя закон разведения Оствальда, рассчитайте величину степени диссоциации уксусной кислоты для обеих концентраций. Запишите результаты измерений и вычислений в таблицу 6.
Опыт 3. Гидролиз солей В четыре стаканчика налейте по 40 мл дистиллированной
воды. В трех стаканчиках растворите по 1-2 г солей NaCl, CuSO4 и Na2CO3. Измерьте рН каждого раствора и сравните их значения со значением рН дистиллированной воды.
Напишите ионные и молекулярные уравнения протекающих реакций гидролиза солей.
Формулируя выводы, ответьте на следующие вопросы:
1)Как связаны между собой концентрация и рН раствора сильной кислоты? Почему при уменьшении концентрации сильной кислоты в 10 раз рН увеличивается на 1?
2)Как объяснить то, что константа диссоциации слабого электролита при разбавлении его раствора не изменяется?
3)Почему степень диссоциации слабых электролитов увеличивается при разбавлении раствора? (Используйте принцип Ле Шателье).
4)Как изменяется рН при растворении в воде солей, образованных сильными и слабыми кислотами и основаниями? В чем причина этих изменений?
5)Какие соли подвергаются гидролизу в водных растворах?
6)Перечислите способы усиления и подавления процессов гидролиза солей. Почему при повышении температуры гидролиз солей усиливается? (Обратите внимание на выводы, которые вы сделали по результатам лабораторной работы №1).
