
Zadachi_po_khimii
.pdf62
Поэтому э.д.с. поляризации ЕП = ЕК–ЕА = 1,23–0,80 = 0,43 В, а потенциал разложения или наименьшая разность потенциалов, необходимая для проведения данного процесса электролиза,
ЕР =Еп + η = 0,43 + 0,45 = 0,88 В.
Задачи
241.Сколько времени следует пропускать ток силой 2,5 А через раствор NaCl, чтобы получить по одному молю каждого из газообразных продуктов, выделяющихся на электродах (условия нормальные). Составьте электронные уравнения процессов на угольных электродах.
242.Вычислить потенциал разложения водного раствора ZnSO4. Электроды угольные. Перенапряжение кислорода на аноде 0,45 В. Перенапряжением цинка можно пренебречь. Какие процессы протекают на электродах.
243.Составьте уравнения процессов, протекающих на электро-
дах при электролизе раствора CuSO4: а) с угольным анодом, б) с медным анодом.
244.Какой металл будет выделяться в первую очередь на катоде из раствора, содержащего ионы: Ni2+, Cu2+ и Ag+, если напряжение источника тока является достаточным для выделения любого из этих металлов? Можно ли разделить эти металлы, используя процесс электролиза?
245.Составьте электронные уравнения процессов, происходящих
на электродах при электролизе раствора А12(SО4)3 в случае угольного анода; в случае алюминиевого анода.
246. При электролизе расплава NaCl на аноде выделилось 280 см3 хлора, измеренного при нормальных условиях. Какое количество натрия выделится в это время на катоде? Составьте уравнения процессов, протекающих на электродах.
247.Ток силой 1,5А протекает в течение 1 часа через раствор
Na2SO4. Вычислите массу разложившейся воды и объемы газообразных веществ (при н.у.), выделившихся на электродах. Составьте уравнения процессов, протекающих на угольных электродах.
63
248.Определите выход по току, если при прохождении через
раствор CuSO4 96457 Кл электричества на катоде выделилось 30 г меди. Составьте уравнения процессов, протекающих на электродах.
249.Металлическую деталь необходимо покрыть слоем серебра толщиной 0,025 мм. Сколько времени потребуется на осаж-
дение нужного количества серебра из раствора AgNO3, если поверхность детали 500 см2, сила тока 1 А, плотность серебра 10,5 г/см3, а выход по току составляет 0,87?
250.В растворе находилось 0,1 моль HgCl2 и 0,2 моль CuCl2. Какие вещества и в каком количестве выделяются на угольных электродах, если через раствор пропускать ток силой 10 А в течение 1 часа? Составьте уравнения процессов, протекающих на угольных электродах.
251.Какие вещества и в каком количестве выделяются на угольных электродах при электролизе раствора KBr в течение 1 ч 35 мин при силе тока 15 А?
252.Через соединенные последовательно растворы SnCl2 и SnCl4 пропустили электрический ток в течение некоторого времени. Одинаковые ли количества олова и хлора выделяются на электродах из растворов? Составьте электронные уравнения процессов, протекающих на угольных электродах.
253.Определите выход по току, если при прохождении через
раствор AgNO3 96485 Кл электричества на катоде выделилось 100 г серебра. Составьте электронные уравнения процессов, протекающих на угольных электродах.
254.Вычислить потенциал разложения раствора CdSO4. Электроды платиновые, перенапряжение кислорода на аноде равно 0,45 В, перенапряжением кадмия на катоде можно пренебречь. Составьте электронные уравнения процессов, протекающих на электродах.
255.Составьте электронные уравнения процессов, происходящих
на электродах при электролизе растворов АlСl3, NiSO4. В обоих случаях анод угольный.
64
256.Электролиз раствора сульфата некоторого металла проводили при силе тока 6 А в течение 45 мин, в результате чего на катоде выделилось 5,49 г металла. Вычислите эквивалент металла. Определите, какой это может быть металл.
257.Через раствор NiSO4 пропускали ток до полного выделения всего никеля из раствора. Какие процессы протекают на угольных электродах при электролизе раствора? Что представляет собой оставшаяся жидкость?
258.Составьте электронные уравнения процессов, проходящих
на электродах при электролизе AgNO3 (анод из серебра). Как изменится масса анода в результате пропускания тока силой 2,5 А в течение 6 мин 36 сек.
259.Составьте электронные уравнения процессов, протекающих на платиновых электродах в электрической ячейке (хемотронный прибор), содержащей раствор KI и некоторое количество I2. Укажите применение этих приборов.
260.Электролиз раствора K2SО4 проводили при силе тока 5 А в течение 3 ч. Составьте электронные уравнения процессов, происходящих на электродах, вычислите объем выделяющихся на электродах веществ.
Тема 14. Органические соединения, полимеры.
Пример 1. Составьте структурную формулу 1,3-бутадиена. Какие особенности имеет это соединение? Напишите уравнение взаимодействия его с хлором. Напишите условия процесса и реакцию полимеризации 1,3-бутадиена.
Решение: Составим углеродный скелет молекулы в соответствии с названием: четыре (бутан) углеродных атома и две двойных связи, на что указывает окончание названия – диен. Соединение принадлежит к непредельным (ненасыщенным) углеводородам, а цифры «1,3» определяют местоположение двойных связей:
1 2 3 4 C = C ― C = C.
65
Присоединяя атомы водорода к оставшимся возможным положениям у каждого углеродного атома, получим структурную формулу:
H |
H |
H |
H |
\ |
| |
| |
/ |
C = C ― C = C |
|||
/ |
|
|
\ |
H |
|
|
H. |
1,3-бутадиен относится к системам с сопряженными связями. В таких системах имеет место чередование двойной и простой связей, что приводит к делокализации π-связей и более равномерному распределению электронной плотности между всеми четырьмя углеродными атомами. В соответствии с этим возникшие связи по длине и энергии занимают промежуточное положение между двойными и простыми. Эта особенность обусловливает присоединение различных веществ не только к одной из двойных связей, но и к крайним атомам углерода сопряженной системы в 1,4-положениях с перемещением двойной связи к 2-му и 3- му углеродным атомам:
CH2=CH―CH=CH2+Cl2 → CH2Cl―CН=CН―CH2Cl. |___↑ ↑___|
Практически важной особенностью двойных углеводородов с сопряженными связями является их способность полимеризоваться в каучукообразные продукты.
На основе 1-,3-бутадиена советским химиком С.В. Лебедевым в 1932 году был разработан промышленный способ получения синтетического каучука (натрийбутадиенового). Реакция полимеризации протекала в присутствии металлического натрия (ионный механизм полимеризации) по схеме:
nCH2=CH―CH=CH2 → (―CH2―CH=CH―CH2―)n
(разрываются две двойные связи). Проходит процесс и путем разрывом только одной π – связи:
nCH2=CH―CH=CH2 → (―CH2―CН(CН=CH2)―)n.
66
Содержание в продукте звеньев 30-35% и 65-70% соответственно.
Задачи
261.Укажите тип гибридизации атомных орбиталей углерода в молекуле бензола. Какое геометрическое строение он имеет? Чем объясняется его низкая способность к реакциям присоединения?
262.В каком из нижеуказанных соединений имеется более чем один тип гибридизации орбиталей атомов углерода?
а) CH3―CH2―CH2―CH3; б) CH2=CH―CH2―CH3; в) CH≡CH.
263.В чем отличие химического поведения водородного атома в
группе ―ОН в соединениях СН3ОН и СН3СООН? К какому классу органических соединений относится каждый из них? Какие характерные реакции для них знаете?
264.Напишите структурную формулу простейшей непредельной одноосновной карбоновой кислоты и уравнение реакции взаимодействия этой кислоты с метиловым спиртом. Составьте схему полимеризации этого продукта.
265.Какие углеводороды называют диеновыми? Приведите пример. Какой общей формулой выражают состав диеновых углеводородов? Составьте схему полимеризации одного из них.
266.Фенол относится к ароматическим соединениям. Его фор-
мула С6Н5ОН. Метиловый спирт относится к алифатическим соединениям. Его формула СН3ОН. Чем отличаются эти два соединения в химическом поведении? Напишите соответствующие реакции.
267.Что такое: а) полимеризация; б) поликонденсация? Чем отличаются друг от друга эти реакции? Укажите основные стадии процесса полимеризации. Составьте соответствующие схемы (на примере образования полипропилена из пропилена).
268.Этерификация – реакция получения эфиров. Напишите реакцию этерификации акриловой кислоты и метилового
67
спирта. Назовите полученный эфир. Составьте схему его полимеризации.
269.Полистирол отличается большой стойкостью к действию кислот и щелочей, низким дипольным моментом, незначительной диэлектрической проницаемостью и малым углом диэлектрических потерь, вследствие чего применяется для производства высокочастотных кабелей. Составьте схему получения полистирола.
270.Тетрафторэтилен при полимеризации образует полимер – тефлон, проявляющий поразительную химическую стойкость («органическая платина»). Он не изменяется даже при температуре 300°С под действием концентрированных кислот, окислителей и щелочей. Составьте схему полимеризации. В каких областях техники тефлон применяется благодаря своим уникальным свойствам?
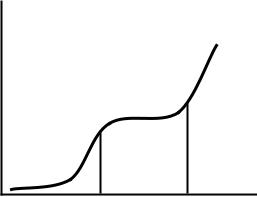
271.Укажите три состояния линейных полимеров. Чем характеризуется переход из одного состояния в другое. Рассмотрите термомеханическую кривую аморфного линейного полимера. Каким состояниям полимера отвечают области I, II и III?
Деформация
I |
II |
III |
Температура
Рис. 9 Как называются температурные границы (перегибы на кри-
вой) при переходе полимера из одного состояния в другое? Какие характеристики определяют его принадлежность к той или иной области?
68
272. .Составьте схему реакции поликонденсации фенола с формальдегидом. Полученный при избытке фенола полимер называется «новолак» и относится к термопластичным смолам. Полученный при избытке формальдегида полимер носит название «резит» и относится к термореактивным смолам. Что это означает? Где применяются такого вида смолы?
273.Какие полимеры называют: а) стереорегулярными; б) нерегулярными? Как они отличаются по строению и свойствам? Составьте схему реакции получения полипропилена
274.Полимером какого непредельного углеводорода является натуральный каучук? Напишите структурную формулу этого углеводорода. Как называют процесс превращения каучука в резину? Чем по строению и свойствам различаются каучук и резина?
275.К кремнийорганическим полимерам относятся силаны и силоксаны. Изобразите элементарное звено макромолекулы для силанов и силоксанов. В чем их сходство и различие? Где применяются кремнийорганические соединения?
276.Индукционный эффект какого элемента является эталоном сравнения. Какие заместители проявляют положительный индукционный эффект, какие – отрицательный? Рассмотреть на примере органических кислот.
277.От чего зависят физико-химические свойства полимеров: гибкость макромолекул, старение полимеров, время релаксации?
278.Кристаллическое состояние полимеров и стадии протекания процесса кристаллизации. Какие различия в свойствах у аморфных и кристаллических полимеров?
279.Органические полупроводники. Уравнения реакций получения полиацетилена и полиакрилонитрила.
280.Какие полимеры используются в радиотехнике и электронике?
69
ПРИЛОЖЕНИЯ
|
|
|
|
|
|
|
|
|
|
|
|
Таблица 1. |
||
Относительная электроотрицательность s- и p-элементов |
||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
H |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
2,1 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Li |
|
Be |
|
B |
|
C |
|
N |
|
O |
|
F |
|
|
1,0 |
1,5 |
|
2,0 |
|
2,5 |
|
3,0 |
|
3,5 |
|
4,0 |
|
||
Na |
|
Mg |
|
Al |
|
Si |
|
P |
|
S |
|
Cl |
|
|
0,9 |
1,2 |
|
1,5 |
|
1,8 |
|
2,1 |
|
2,5 |
|
3,0 |
|
||
K |
|
Ca |
|
Ga |
|
Ge |
|
As |
|
Se |
|
Br |
|
|
0,8 |
1,0 |
|
1,6 |
|
1,8 |
|
2,0 |
|
2,4 |
|
2,8 |
|
||
Rb |
|
Sr |
|
In |
|
Sn |
|
Sb |
|
Te |
|
I |
|
|
0,8 |
1,0 |
|
1,7 |
|
1,8 |
|
1,8 |
|
2,1 |
|
2,6 |
|
||
Cs |
|
Ba |
|
Tl |
|
Pb |
|
Bi |
|
|
|
|
|
|
0,7 |
0,9 |
|
2,0 |
|
2,3 |
|
2,0 |
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Таблица 2. |
||
|
|
Некоторые свойства элементов 2 периода |
|
|
|
|||||||||
|
|
|
|
|
|
|
|
|||||||
Элемент |
|
Энергия |
|
Сродство к |
|
В молекулах Э–Э |
|
|||||||
|
|
ионизации |
|
электрону |
|
|
|
|
|
|
|
|||
|
Межядерное |
Энтальпия |
|
|||||||||||
|
|
(кДж/моль) |
(кДж/моль) |
|
||||||||||
|
|
расстояние, |
|
связи |
|
|||||||||
|
|
|
|
|
|
|
|
|
(нм) |
(кДж/моль) |
|
|||
Li |
|
520 |
|
|
|
59,8 |
0,2672 |
|
|
107 |
|
|||
|
|
|
|
|
|
|
|
|
|
|
|
|||
Be |
|
899 |
|
|
|
241,2 |
- |
|
|
0 |
|
|||
|
|
|
|
|
|
|
|
|
|
|
|
|||
B |
|
800 |
|
|
|
23,2 |
0,1590 |
|
|
274 |
|
|||
|
|
|
|
|
|
|
|
|
|
|
||||
C |
|
1086 |
|
|
122,5 |
0,1242 |
|
|
603 |
|
||||
|
|
|
|
|
|
|
|
|
|
|
||||
N |
|
1403 |
|
|
0 |
0,1097 |
|
|
942 |
|
||||
|
|
|
|
|
|
|
|
|
|
|
||||
O |
|
1314 |
|
|
141,8 |
0,1207 |
|
|
494 |
|
||||
|
|
|
|
|
|
|
|
|
|
|
||||
F |
|
1681 |
|
|
322,3 |
0,1418 |
|
|
155 |
|
||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
70
|
|
|
|
|
|
|
|
|
|
Таблица 3 |
||
|
Фундаментальные константы |
|
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
|
||||
|
Константа |
|
Сим- |
|
|
Значение |
|
|||||
|
|
|
вол |
|
|
|
|
|
|
|
|
|
|
Универсальная газовая постоянная |
R |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
8,314 Дж/моль К |
|
||||||
|
Число Авогадро |
|
NA |
|
6,02 1023 моль–1 |
|
||||||
|
Заряд электрона |
|
ē |
|
|
|
–19 |
Кл |
|
|
||
|
|
|
|
|
1,6 10 |
|
|
|||||
|
Число Фарадея |
|
F |
|
|
|
|
|
4 |
Кл/моль |
|
|
|
|
|
|
|
9,6457 10 |
|
|
|||||
|
|
|
|
|
|
|
|
|
|
Таблица 4 |
||
|
Константы диссоциации слабых электролитов при 298К |
|||||||||||
|
|
|
|
|
|
|
||||||
|
Электролит |
Уравнение |
|
|
|
Значение |
|
|||||
|
диссоциации |
|
|
|
|
|
Кдисс. |
|
||||
|
|
|
|
|
|
|
|
|||||
|
Азотистая кислота |
НNO2 = H+ + NO2– |
|
|
|
4,0 |
10–4 |
|
||||
|
Аммония гидроксид |
NH4OH = NH4+ + OH– |
|
|
1,8 |
10–5 |
|
|||||
|
Борная кислота (1ст.) |
Н3ВО3 = Н+ + Н2ВО3– |
|
|
5,8 |
10–10 |
|
|||||
|
Кремниевая к-та (1ст.) |
H2SiO3=H++HSiO32– |
|
|
|
1,76 10–4 |
|
|||||
|
Муравьиная кислота |
НСООН = Н++НСОО– |
|
|
1,8 |
10–4 |
|
|||||
|
Сероводородная к-та |
H2S = H++HS– |
|
|
|
5,7 |
10–8 |
|
||||
|
|
HS- = H++S2– |
|
|
|
1,2 |
10–15 |
|
||||
|
Угольная кислота |
Н2СО3 = НСО3–+Н+ |
|
|
|
4,3 |
10–7 |
|
||||
|
|
НСО3– = СО32–+Н+ |
|
|
|
5,6 |
10–11 |
|
||||
|
Фосфорная кислота |
Н3РО4 = Н++Н2РО4– |
|
|
|
7,5 |
10–3 |
|
||||
|
|
Н2РО4– = Н++НРО42– |
|
|
|
6,2 |
10–8 |
|
||||
|
|
НРО42– = Н++РО43– |
|
|
|
2,2 |
10–13 |
|
||||
|
Уксусная кислота |
СН3СООН=H++СН3СOO– |
|
|
1,75 10-5 |
|
||||||
|
Фтористоводородная |
HF = H+ + F– |
|
|
|
7,2 |
10–4 |
|
||||
|
кислота |
|
|
|
|
|
|
|
|
|
|
|
|
Хлорноватистая к-та |
НС1О = Н++С1О– |
|
|
|
3,0 |
10–8 |
|
||||
|
Цианистоводородная |
HCN = H+ + CN– |
|
|
|
7,2 |
10–10 |
|
||||
|
(синильная) кислота |
|
|
|
|
|
|
|
|
|
|
|
|
Щавелевая кислота |
Н2С2О4 = Н++НС2О4– |
|
|
|
5,9 |
10–2 |
|
||||
|
|
НС2О4– = Н++С2О42– |
|
|
|
6,4 |
10–5 |
|
||||
71
Таблица 5 Произведения растворимости малорастворимых в воде веществ
Формула |
ПР |
Формула |
ПР |
|
|
||||
|
|
|
|
|
AgCl |
1,6 |
10–10 |
MgCO3 |
1,0 10–5 |
Al(ОН)3 |
1,9 |
10–33 |
MnS |
1,4 10–5 |
AlPO4 |
1,8 |
10–18 |
Mn(OH)2 |
4,0 10–14 |
BaSO4 |
1,1 |
10–10 |
NiS |
1,6 10–19 |
CaCO3 |
4,8 |
10–9 |
PbI2 |
8,7 10–9 |
Cd3(PO4)2 |
1,6 |
10–18 |
PbS |
1,1 10–29 |
Cu(OH)2 |
2,6 |
10–16 |
Pb(OH)2 |
2,6 10–19 |
CuS |
8,5 |
10–45 |
Sn(OH)2 |
2,2 10–20 |
Fe(OH)3 |
3,8 |
10–38 |
Zn(OH)2 |
1,0 10–17 |
Mg(OH)2 |
5,0 |
10–12 |
ZnS |
1,3 10–23 |
|
|
|
|
|
|
Таблица 6 |
|
Стандартные термодинамические характеристики веществ |
|||||||
|
|
|
|
|
|
|
|
Вещество |
Состояние |
∆ |
0 |
298, кДж/моль |
0 |
|
|
|
|
|
H |
S |
298, Дж/моль К |
|
|
Al |
к |
|
|
0 |
|
28,30 |
|
Al2O3 |
к |
|
|
–1676,80 |
|
50,90 |
|
BaCO3 |
к |
|
|
–1217,11 |
|
112,20 |
|
BaO |
к |
|
|
–553,90 |
|
70,46 |
|
BeCO3 |
к |
|
|
–702,42 |
|
81,32 |
|
BeO |
к |
|
|
–575,29 |
|
21,21 |
|
C |
к (алмаз) |
|
|
0,46 |
|
2,44 |
|
C |
к (графит) |
|
|
0 |
|
5,69 |
|
CH4 |
г |
|
|
–74,85 |
|
186,19 |
|
