
Zadachi_po_khimii
.pdf22
200°С. Температурный коэффициент скорости реакции равен 3. Рассчитайте энергию активации реакции.
91.Вычислите, как изменится скорость реакции, если повысить температуру от 40 до 80°С. Температурный коэффициент скорости реакции равен 2.
92.Как следует изменить концентрацию водорода, чтобы ско-
рость реакции С2H4(г)+H2(г)→С2H6(г) увеличилась в 9 раз? Как изменится скорость прямой реакции, если увеличить давление в системе вдвое?
93.Реакция идет по уравнению N2+ЗН2=2NН3. Начальные концентрации участвующих в ней веществ составляли:
CN2 = 0,80 моль/л; CH 2 = 1,5 моль/л; CNH3 = 0,10 моль/л.
Вычислите концентрацию водорода и аммиака, когда CN2 стала равной 0,5 моль/л.
94. Реакции протекают по следующим кинетическим схемам: CH3COCH3→СH4+CH2CO;
CH4+2O2→СO2+2H2O;
HCl+NaOH→NaCl+H2O.
Напишите выражения зависимости скоростей этих реакций от концентрации и укажите: 1) порядок реакции; 2) размерность константы скорости каждой реакции, если концентрации веществ выражены в моль/л, а время – в секундах.
95.Вычислите, во сколько раз уменьшится скорость реакции, если понизить температуру от 120 до 80°С. Температурный коэффициент скорости реакции равен 3.
96.Реакция идет по уравнению Н2+I2=2НI. Константа скорости этой реакции при 508°С равна 0,16. Исходные концентрации
реагирующих веществ: CH2 = 0,04 моль/л; CI2 = 0,05 моль/л. Вычислите начальную скорость реакции и скорость ее в момент, когда CH2 стала равной 0,03 моль/л.
97.Как изменится скорость реакции, при повышении температуры на 60°, если температурный коэффициент скорости данной реакции равен двум?
23
98.Исходная температура среды 300 К. Как нужно изменить температуру, чтобы скорость реакции возросла в 1000 раз? Температурный коэффициент скорости реакции равен 3. Рассчитайте энергию активации этой реакции.
99.Реакция между веществами А и В протекает по схеме А+В→С. Начальные концентрации веществ А и В соответ-
ственно равны 0,5 и 0,3 моль/л. Константа скорости реакции равна 0,5 л2/моль2 с. Вычислите начальную скорость реакции и скорость реакции в момент времени, когда концентрация вещества В составит 0,1 моль/л.
100.Температурный коэффициент скорости реакции равен 3. Как изменится скорость этой реакции при понижении температуры на 30°?
Тема 6. Химическое равновесие
Пример 1. Вычислите константу равновесия при 25°С и 101325 Па для реакции
Fe2O3(к)+3CO(г)=2Fe(к)+ЗСО2(г).
Решение. Константу равновесия можно определить, используя выражения
∆G°= –RTlnKp,
∆G=∆H–T ∆S,
где ∆H и ∆S – изменения энтальпии и энтропии реагирующих веществ.
Используя стандартные значения энтальпий образования (∆H°) и абсолютных энтропий веществ (S°), которые приведены в табл. 2 приложения, рассчитаем ∆H и ∆S реакции (см. пример к Теме 4):
∆H= –3 393,7 + 2 0 – (–822,7 – 3 110,5)= –26,9 кДж/моль; ∆S= 3 213, 8 + 2 27,15 – (87,5 + 3 197,6)= 15,4 Дж/моль К; ∆G°= –26,9 – 298 15,4 10-3= –31,49 кДж. Реакция при стан-
дартных условиях протекает в прямом направлении.
|
∆G0 |
31,49 103 |
ln K = − |
RT = |
8,314 298 = 12,71; K = 3,31 105. |
24
Пример 2. Для реакции 2HI=H2+I2 константы равновесия при температурах 573 и 633 К соответственно равны 1,25 10–2 и 1,62 10–2. Вычислите тепловой эффект этой реакции. В каком направлении сместится равновесие при повышении: а) температуры; б) давления.
Решение. Зависимость константы равновесия от температуры описывается уравнением:
d ln K |
|
∆H |
|
dT |
= |
|
. |
RT 2 |
|||
Если принять, что тепловой эффект химической реакции для узкого интервала температур не зависит от температуры, и проинтегрировать это уравнение, то получим:
|
K2 |
|
∆H |
|
1 |
|
1 |
|
ln |
|
|
|
|||||
= |
R |
|
− T |
|||||
K |
T |
. |
||||||
|
1 |
|
|
|
1 |
2 |
|
|
Подставив значения переменных из условия задачи, получаем: ∆H=13,1 кДж. Положительное значение ∆H показывает, что прямая реакция – эндотермическая.
Повышение температуры смещает равновесие вправо, т.е., способствует разложению HI.
В тех случаях, когда в результате реакции количество газообразных веществ (в молях!) остается постоянным, при изменении давления одинаково изменяются скорости прямой и обратной реакций, и изменения положения равновесия не происходит.
Пример 3. В состоянии равновесия для химической реакции N2+3H2=2NH3 концентрации азота, водорода и аммиака соответственно равны: 2,4, 7,2 и 0,4 моль/л. Вычислите константу равновесия. Определите исходные концентрации азота и водорода.
Решение. Константа равновесия данной реакции выражается соотношением:
K = |
[NH3]2 |
|
|
. |
|
[H2 ]2 [N2 ] |
||
Подстановка значений концентраций даёт K=1,7 10–4.
В момент равновесия концентрация аммиака 0,4 моль/л. Из стехиометрического уравнения реакции следует, что прореагиро-
25
вало 0,4/2=0,2 моля азота и 0,4 3/2=0,6 молей водорода. Исходные концентрации:
C N2 =0,2+2,4=2,6 моль/л; C H2 =0,6+7,2=7,8 моль/л.
Задачи
101.Вычислите константу равновесия при 25°С и 101325 Па для
реакции N2O4(г)=2NO2(г), используя значения стандартных термодинамических величин.
102.Для реакции FeO(к)+СО(г)=Fe(к)+СО2(г) константы равновесия при температурах 973 и 1173 К соответственно равны 0,678 и 0,466. Вычислите тепловой эффект этой реакции. В каком направлении сместится равновесие при понижении: а) температуры; б) давления?
103.В состоянии равновесия при температуре 900 К для химиче-
ской реакции С(графит)+СО2(г)=2СО(г) концентрации диоксида углерода и монооксида углерода соответственно равны: 0,73 и 0,36 моль/л. Вычислите константу равновесия
истандартное изменение изобарно-изотермического потенциала для этой реакции. Определите исходную концентрацию диоксида углерода.
104.Рассчитайте константу равновесия при 25°С и 101325 Па
для реакции H2S(г)+I2(к)=2HI(г)+S(к), используя табличные значения стандартных величин энтальпий и энтропий образования реагирующих веществ.
105.В состоянии равновесия при температуре 660 К для реакции
2SO2(г)+O2(г)=2SO3(г) концентрации оксида серы(IV), кислорода и оксида серы(VI) соответственно равны: 4,4; 1,3 и 7,2 моль/л. Вычислите константу равновесия и стандартное изменение энергии Гиббса для этой реакции. Определите исходные концентрации оксида серы (IV) и кислорода.
106.Для реакции N2(г)+O2(г)=2NO(г) константы равновесия при температурах 2300 и 2600 К соответственно равны 1,69 10–3
и5,03 10–3. Вычислите тепловой эффект этой реакции. В каком направлении сместится равновесие при повышении: а) температуры; б) давления.
26
107.Вычислите константу равновесия при 25°С и 101325 Па для
реакции РС15(г)=РС13(г)+С12(г), используя значения стандартных термодинамических величин.
108.В состоянии равновесия при температуре 718 К для реакции
Н2(г)+I2(г)=2HI(г) концентрации водорода, иода и иодоводорода соответственно равны 7,84, 0,18 и 8,46 моль/л. Вычислите константу равновесия и стандартное изменение изо- барно-изотермического потенциала для этой реакции. Определите исходные концентрации водорода и иода.
109.Для реакции 4НС1(г)+О2(г)=2Cl2(г)+2H2O(г) константы равновесия при температурах 960 и 1000 К соответственно равны 0,11 и 0,05. Вычислите тепловой эффект этой реакции. В каком направлении сместится равновесие при понижении: а) температуры; б) давления.
110.Для реакции N2(г)+ЗН2(г)=2NН3(г) при температурах 600 и 900 К константы равновесия соответственно равны 6,3 10–4
и 1,26 10–6. Вычислите тепловой эффект этой реакции. В каком направлении сместится равновесие при понижении: а) температуры; б) давления.
111.В состоянии равновесия при температуре 1000 К для реак-
ции 2NO2=2NO+O2 концентрации оксида азота(IV), кислорода и оксида азота(II) соответственно равны 0,06; 0,4 и 0,8 моль/л. Вычислите константу равновесия и стандартное изменение энергии Гиббса для этой реакции. Определите исходную концентрацию оксида азота(IV).
112.Вычислите константу равновесия при 25°С и 101325 Па для
реакции Fe3O4(к)+СО(г)=ЗFеО(к)+СО2(г), используя табличные значения стандартных термодинамических величин.
113.В состоянии равновесия при температуре 800 К для реакции
2СО(г)+О2(г)=2СО2(г) концентрации оксида углерода(II), кислорода и оксида углерода(IV) соответственно равны 6,0; 2,0 и 10,0 моль/л. Вычислите константу равновесия и стандартное изменение изобарно-изотермического потенциала для этой реакции. Определите исходные концентрации кислорода и оксида углерода(II).
27
114.Напишите выражение для константы равновесия гомоген-
ной химической реакции СН4+СО2=2СО+2Н2. Как следует изменить температуру и давление, чтобы повысить выход водорода? Прямая реакция – эндотермическая.
115.Напишите выражение для константы равновесия гетероген-
ной реакции С(к)+Н2О(г)=СО(г)+Н2(г). Как следует изменить концентрацию и давление, чтобы сместить равновесие в направлении образования исходных веществ?
116.Вычислите константу равновесия для газовой реакции
СО(г)+Н2О(г)=СО2(г)+Н2(г), если равновесные концентрации реагирующих веществ составляют: [СО]=0,004 моль/л; [Н2О]=0,064 моль/л; [СО2]=0,016 моль/л; [Н2]=0,016 моль/л.
117.Константа равновесия реакции СО(г)+Н2О(г)=СO2(г)+Н2(г) при некоторой температуре равна 1. Вычислите равновесные концентрации всех реагирующих веществ, если исходные концентрации: C CO =0,1 моль/л; C H2O =0,4 моль/л.
118.Константа равновесия газовой реакции N2+ЗН2=2NН3 при температуре 400°С равна 0,1. Равновесные концентрации
водорода и аммиака соответственно равны 0,2 моль/л и 0,08 моль/л. Вычислите равновесную и исходную концентрации азота.
119.Почему при изменении давления равновесие смещается для
реакции N2+3H2=2NH3 и не смещается для реакции N2+O2=2NO? Напишите выражения для констант равновесия каждой из данных газовых реакций.
120.Исходные концентрации NO и С12 в гомогенной системе, в которой протекает реакция 2NO+C12=2NOC1, составляют соответственно 0,5 и 0,2 моль/л. Вычислите константу равновесия, если к моменту наступления состояния равновесия прореагировало 20% NO.
Тема 7. Правило фаз Гиббса. Фазовые равновесия
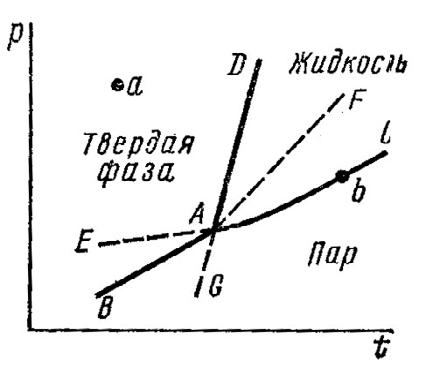
Пример 1. На рис. 1 изображена диаграмма состояния однокомпонентной системы (давление насыщенного пара – темпе-
28
ратура). Сколько фаз и степеней свободы в точках a, b, A системы?
Какие зависимости описывают кривые AD, AC, AG, AB, AE?
Рис. 1.
Решение: Согласно правилу фаз, связь между числом степеней свободы (С), числом компонентов (К) и числом фаз (Ф) описывается уравнением Гиббса: С=К+2–Ф. Для однокомпонентной системы (К=1): С=3–Ф.
В точке a присутствует одна фаза (твердое вещество), С=3-1=2; в точке b число фаз Ф=2 (жидкость и пар), С=3-2=1; в точке А: Ф=3
и С=0.
Кривая АD выражает зависимость температуры перехода из жидкого состояния в твердое от внешнего давления (кривая плавления). Кривая АС характеризует зависимость давления насыщенного пара жидкости от температуры (кривая испарения). Кривая AG даёт зависимость температуры перехода переохлажденной жидкости в твердое состояние от давления. Кривая АВ устанавливает зависимость давления насыщенного пара твердого вещества от температуры (кривая возгонки). Кривая АЕ выражает
29
температурную зависимость давления насыщенного пара над переохлажденной жидкостью.
Пунктирные линии АG, АЕ, АF отвечают неустойчивым (метастабильным) равновесиям.
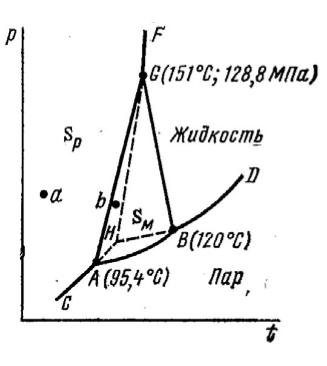
Пример 2. На рис. 2 изображена р–Т диаграмма (р – давление насыщенного пара, Т - температура) состояния серы. Вопросы: а) сколько фаз и степеней свободы у системы в точках: a, b, H, B и на кривой AB? б) какие зависимости описывают кривые AB, AC, AG, BG, GH, GF?
Рис. 2.
Решение. Согласно правилу фаз С=К+2-Ф. Для однокомпонентной системы уравнение Гиббса принимает вид: С=3-Ф.
а) Когда в равновесии находятся три фазы (точки В, Н), С=3- 3=0, равновесие называется нонвариантным и может существовать при строго определенных значениях температуры и давления. На кривой АВ: Ф=2 (сера ромбическая и пар), С=1; в точках
а,b число фаз Ф=1 и С=2.
b)Кривые AB, AC, AG, BD, BG, GH, GF являются линиями двухфазного равновесия. Линии АВ, АС, BD выражают зависи-
30
мость давления насыщенного пара от температуры для ромбической, моноклинной и жидкой серы, соответственно. Линии GF и BG дают зависимость температуры плавления ромбической и моноклинной серы от давления; AG – изменение температуры превращения серы из фазы с ромбической структурой в фазу с моноклинной симметрией от давления; кривая GH отвечает метастабильному равновесию “перегретая ромбическая сера ↔ расплав”
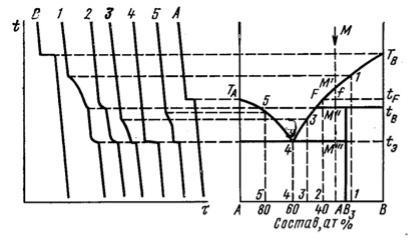
Пример 3. На рис. 3 приведена диаграмма состояния системы А–В, в которой образуется химическое соединение состава АВ3, плавящееся инконгруэнтно (с разложением) и эвтектика. Описать процессы, происходящие при охлаждении расплава, содержащего 35 % мол. вещества А.
Рис. 3.
Решение. Для двухкомпонентных систем (К=2) формула Гиббса имеет вид С=2+2-Ф=4-Ф. При р=const: С=2+1-Ф=3-Ф.
При охлаждении расплава, содержащего 35 % мол. А, вплоть до достижения кривой ликвидуса (точка М`): Ф=1 (расплав), С=2, система является бивариантной.
Вточке М` начинается кристаллизация вещества В. Между М` и М``: Ф=2 (расплав и кристаллы В), С=1; система является двухфазной и одновариантной.
Вточке М`` начинается кристаллизация соединения АВ3 (температура инконгруэнтного плавления tB). При этом в равно-
31
весии находятся три фазы: расплав, кристаллы В и кристаллы АВ3 (Ф=3, С=0).
При дальнейшем понижении температуры (между точками М`` и М``` или между tB и tЭ) в системе кристаллизуется фаза АВ3 (Ф=2: расплав и кристаллы АВ3, С=1).
В точке эвтектики 4 (Э) при температуре tЭ в равновесии находятся 3 фазы: расплав, кристаллы А и АВ3 (Ф=3, С=0).
При температуре ниже эвтектической в системе исчезает жидкая фаза, и остаются две твердые фазы (кристаллы А и АВ3):
Ф=2, С=1.
Диаграмма состояния позволяет определить количественные соотношения между массами находящихся в равновесии фаз при помощи так называемого «правила рычага». Например, при температуре tF (точка f) в системе находятся в равновесии кристаллы В и расплав. Для определения состава расплава надо опустить перпендикуляр из точки F на ось концентраций АВ: состав расплава – 52 ат.% В и 48 ат.% А. Соотношение между расплавом и кристаллами В:
Масса кристаллов B |
= |
fF |
|
Масса расплава состава F |
ftF |
||
|
Пример 4. Давление насыщенного пара водного раствора, содержащего нелетучее растворенное вещество, на 2% ниже давления пара чистой воды. Определите моляльность раствора.
Решение. Зависимость давления насыщенного пара над раствором твердых веществ в жидких растворителях от концентрации выражается законом Рауля:
(P0 |
− P ) |
|
∆P |
|
n |
|
|
|
i |
i |
= |
|
= |
2 |
= x |
, |
|
P0 |
P0 |
n1 + n2 |
||||||
|
|
2 |
|
|||||
|
i |
|
i |
|
|
|
|
|
где Pi0 – давление пара над чистым растворителем; Pi – давление пара над раствором данной концентрации; ∆P/Pi0 - относительное понижение давления насыщенного пара; n2 - число молей растворенного вещества; n1 – число молей растворителя; x2 – мольная доля растворенного вещества.
Приняв за 100 давление пара чистого растворителя Pi0 и подставив 98 вместо Pi, получим x2=0,02.
