
Zadachi_po_khimii
.pdf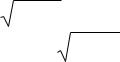
42
Равновесная концентрация [OH−] вычисляется по формуле: [OH− ] = KГ1C , а рН раствора соли заданной концентрации pH = pKW + lg K Г1C = 14 − 3 = 11.
Задачи
161.Составьте молекулярные уравнения реакций, которые выражаются следующими ионными уравнениями:
а) Fe3++3OH−=Fe(OH)3; |
в) H++OH−=H2O; |
б) Cu2++S2−=CuS; |
г) Ca2++CO32−=CaCO3. |
162.Составьте молекулярные и ионные уравнения реакций, протекающих в растворах между следующими веществами:
а) Ca(OH)2 и Na2CО3; |
в) Zn(OH)2 и KOH; |
б) NiSO4 и H2S; |
г) CaCO3 и HCl. |
163.К каждому из веществ: KCl, H2SO4, Sn(OH)2, NaHCO3 при-
бавили раствор NaOH. Выразите происходящие реакции молекулярными и ионными уравнениями.
164.Составьте молекулярные уравнения реакций, которые выражаются следующими ионными уравнениями:
а) Al3++PO43−=AlPO4; |
в) Al3++3OH−=Al(OH)3; |
б) Zn2++S2−=ZnS; |
г) 3Cd2++2PO43−=Cd3(PO4)2. |
165.Составьте молекулярные и ионные уравнения реакций, протекающих в растворах между следующими веществами:
а) FeCl3 и AgNO3; |
в) Mn(OH)2 и H2SO4; |
б) Pb(NO3)2 и H2S; |
г) НС1 и Na2S. |
166.К каждому из веществ: Fe2(SO4)3, Mg(OH)2, Cr2(SO4)3 прибавили избыток раствора KOH. Выразите происходящие реакции молекулярными и ионными уравнениями.
167.К каждому из веществ: Ca(HCO3)2, NaHCO3, H2S, Cu(NO3)2
прибавили раствор Ca(OH)2. Выразите происходящие реакции молекулярными и ионными уравнениями.
168.Составьте молекулярные и ионные уравнения реакций, про-
текающих в растворах между следующими веществами:
а) KHCO3 и Сa(OH)2; |
в) Fe(OH)2 и HCl; |
б) MnCl2 и H2S; |
г) HClO и KOH. |
43
169.Составьте молекулярные уравнения реакций, которые выражаются следующими ионными уравнениями:
а) S2−+2H+=H2S; |
в) Al(OH)3+OH−=[Al(OH)4]−; |
б) Ba2++SO42−=BaSO4. |
г) HCO3−+OH−=CO32−+H2O; |
170.К каждому из веществ: Na2SiO3, Ba(OH)2, MgCO3, Cu(OH)2
прибавили раствор H2SO4. Выразите происходящие реакции молекулярными и ионными уравнениями.
171.Какие из этих солей подвергаются гидролизу: KCl, Na2S, CuSO4, NaBr, ZnCl2? Составьте молекулярные и ионные уравнения гидролиза соответствующих солей. Определите константу гидролиза Na2S по первой ступени
172.Составьте молекулярные и ионные уравнения гидролиза
следующих солей: NiCl2, ZnSO4, K2S. Какое значение pH (больше или меньше 7) имеют растворы этих солей? Определить константу гидролиза К2S по первой ступени
173.Какие из этих солей подвергаются гидролизу: Fe2(SO4)3, K2SO4, Zn(NO3)2, NaNO3, K2CO3? Составьте молекулярные и ионные уравнения гидролиза соответствующих солей. Определить константу гидролиза K2CO3 по первой ступени.
174.Составьте молекулярные и ионные уравнения гидролиза:
а) в результате которого образуется кислая соль; б) в результате которого образуется основная соль.
175.Составьте молекулярные и ионные уравнения гидролиза
следующих солей: NiSO4, Na2S, AlCl3. Какое значение pH (больше или меньше 7) имеют растворы этих солей?
176.Составьте молекулярные и ионные уравнения гидролиза соли, раствор которой имеет:
а) кислую реакцию; |
б) щелочную реакцию. |
177.Составьте молекулярные и ионные уравнения гидролиза
следующих солей: CrCl3, CH3COONa, Fe2(SO4)3. Больше или меньше 7 значение pH растворов этих солей? Определить
константу гидролиза CH3COONa и рН 0,001 М раствора этой соли.
44
178.Какие из этих солей подвергаются гидролизу: NaCl,
HCOOK, K2SO3, NaNO3, Rb2S? Составьте молекулярные и ионные уравнения гидролиза соответствующих солей. Определить рН 0,1 М раствора формиата (муравьинокислого) калия.
179.Какие из этих солей подвергаются гидролизу: AlBr3, BaCl2, Mg(NO3)2, Na2SiO3, KNO3? Составьте молекулярные и ионные уравнения гидролиза соответствующих солей.
180.При смешивании раствора Cr(NO3)3 c раствором Na2CO3 получается осадок тригидроксида хрома Cr(OH)3 и выделяется CO2. Составьте молекулярное и ионное уравнения совместного гидролиза указанных солей.
Тема 10. Окислительно-восстановительные реакции и редокс-потенциалы
Пример 1. Окислительно-восстановительная реакция выражается следующей схемой:
SnCl2+KMnO4+H2SO4→SnCl4+Sn(SO4)2+KCl+MnSO4+H2O;
Для данной реакции:
а) определите для всех элементов степени окисления; б) выберите окислитель и восстановитель; в) составьте уравнения окисления и восстановления;
г) найдите наименьшее общее кратное для количества электронов и запишите стехиометрическое уравнение реакции в молекулярной форме.
Решение. а) Степень окисления элемента в соединении определяется, исходя из того, что сумма степеней окисления всех атомов равна 0, так как молекула нейтральна. Высшая степень окисления элемента обычно равна номеру группы и имеет знак «+», низшая определяется из уравнения: № группы – 8 и имеет знак «–». Таким образом, схема реакции будет выглядеть так:
+2 −1 |
+1 +7 −2 |
+1 +6 −2 |
+4 −1 |
+4 +6 −2 |
+1 −1 +1 −2 |
; |
Sn Cl2 |
+ K Mn O4 |
+ H2 S O 4 |
→ Sn Cl4 |
+ Sn( S O4 )2 |
+ K Cl+ H2 O |
б) Окислитель выбирается как элемент, уменьшающий свою степень окисления в ходе реакции, то есть захватывающий один или

45
несколько электронов. Восстановитель понижает степень окисления за счет отдачи электрона. В нашем случае окислитель – Mn+7 в ионе МnO4–, а восстановитель – ион Sn2+.
в) Уравнения окисления и восстановления запишем в электронноионном виде:
окисление: |
Sn2+ – 2ē -= Sn4+; |
×5 |
восстановление: |
МnO4–+8H++5ē -= Mn2++4H2O; |
×2 |
Наименьшее общее кратное равно 10, первое уравнение умножаем на 2, второе на 5 и при сложении получаем итоговое стехиометрическое уравнение:
5SnCl2+2KMnO4+8H2SO4= =2SnCl4+3Sn(SO4)2+2KCl+2MnSO4+8H2O.
Пример 2. Из перечисленных ниже соединений выберите окислитель и восстановитель, которые будут реагировать между собой в первую очередь: Na2SO3; MnO2; FeCl3; Cl2; HNO3. Запишите возможное уравнение реакции. Ответ обоснуйте, используя значения окислительно-восстановительных (редокс-) потенциалов соответствующих реакций.
Решение. Окислителем может быть элемент, имеющий высшую или промежуточную степень окисления. Такими явля-
+4 +4 +3 0 +5
ются: Na2 S O3, Mn O2 , FeCl3, Cl2, H N O3. Наиболее сильным из
них будет являться соединение, для перехода которого в восстановленную форму редокс-потенциал имеет наибольшее значение:
Cl2+2ē -=2Cl–; ECl0 2 Cl− = 1,36 В. Восстановителем может быть
элемент, имеющий низшую или промежуточную степень окисле-
+4 +4 +3 0
ния: Na2 S O3, Mn O2 , FeCl3, Cl2 . Наиболее сильным будет являться тот, для окисления которого потенциал имеет наименьшее
значение: SO32–+H2O–2ē=SO42–+2H+; E0 2 |
− |
2 |
− = 0,17 В. |
SO4 |
|
SO3 |
|
Уравнение реакции складывается из двух вышеуказанных
процессов восстановления и окисления:
Cl2 + 2ē -= 2Cl–
SO32– + H2O – 2ē = SO42– + 2H+,
46
суммарно:
Cl2 + H2SO3 + H2O = H2SO4 + 2HCl.
Данная реакция будет протекать самопроизвольно, так как э.д.с. процесса больше нуля.
Задачи
181.Какие из нижеприведённых реакций являются окислитель- но-восстановительными? Составьте для них: а) электронные уравнения; б) уравнения реакций. Для каждой реакции укажите окислитель и восстановитель.
Fe2O3+HCl→FeCl3+H2O; K2S+NaClO+H2SO4→S+K2SO4+NaCl+H2O; FeCl3+KI→FeCl2+I2+KCl; Na2SO3+H2SO4→Na2SO4+SO2+H2O.
182.Окислительно-восстановительные реакции выражаются следующими схемами:
KClO3→KCl+KClO4; Cl2+NaOH→NaClO+NaCl+H2O; KMnO4+K2SO3+H2O→MnO2+K2SO4+KOH.
Составьте: а) электронные уравнения; б) уравнения реакций. Для каждой реакции укажите окислитель и восстановитель.
183.Окислительно-восстановительные реакции выражаются следующими схемами:
KMnO4+K2SO3+H2SO4→MnSO4+K2SO4+H2O; KClO→KClO3+KCl; I2+Cl2+H2O→HIO3+HCl.
Составьте: а) электронные уравнения; б) уравнения реакций. Для каждой реакции укажите окислитель и восстановитель.
184.Окислительно-восстановительные реакции выражаются следующими схемами:
KI+K2Cr2O7+H2SO4→I2+Cr2(SO4)3+K2SO4+H2O; I2+HNO3→HIO3+NO+H2O; KMnO4+K2SO3+KOH→K2MnO4+K2SO4+H2O.
Составьте: а) электронные уравнения; б) уравнения реакций. Для каждой реакции укажите окислитель и восстановитель.
47
185.Окислительно-восстановительные реакции выражаются следующими схемами:
HClO3+H2SO3→HCl+H2SO4; FeSO4+HIO3+H2SO4→Fe2(SO4)3+I2+H2O; Br2+KOH→KBrO+KBr+H2O.
Составьте: а) электронные уравнения; б) уравнения реакций.
186.Окислительно-восстановительные реакции выражаются следующими схемами:
NaCrO2+Cl2+NaOH→Na2CrO4+NaCl+H2O; FeSO4+HNO3+H2SO4→Fe2(SO4)3+NO+H2O; Ni(OH)2+NaOCl+H2O→Ni(OH)3+NaCl.
Составьте: а) электронные уравнения; б) уравнения реакций. Для каждой реакции укажите окислитель и восстановитель.
187.Какие из нижеприведённых реакций являются окислитель- но-восстановительными? Составьте для них: а) электронные уравнения; б) уравнения реакций.
AsH3+O2→As2O3+H2O; KClO3+S→KCl+SO2; HF+SiO2→SiF4+H2O; KI+KNO2+H2SO4→I2+NO+K2SO4+H2O.
188.Окислительно-восстановительные реакции выражаются следующими схемами:
KNO3+Cr2(SO4)3+Na2CO3→KNO2+Na2CrO4+Na2SO4+CO2; HClO4+H2SO3→HCl+H2SO4; K2Cr2O7+HI+H2SO4→Cr2(SO4)3+I2+K2SO4+H2O.
Составьте: а) электронные уравнения; б) уравнения реакций. Для каждой реакции укажите окислитель и восстановитель.
189.Какие из нижеприведённых реакций являются окислитель- но-восстановительными? Составьте для них: а) электронные уравнения; б) уравнения реакций.
H2S+SO2→S+H2O; HNO3+P+H2O→H3PO4+NO; KOH+HNO3→KNO3+H2O; H2SO4+Zn+HNO3→ZnSO4+N2O+H2O.
48
190.Окислительно-восстановительные реакции выражаются следующими схемами:
KClO3→KCl+O2; Br2+H2O+SO2→H2SO4+HBr; HNO3+HCl+HgS→HgCl2+NO+S+H2O.
Составьте: а) электронные уравнения; б) уравнения реакций. Для каждой реакции укажите окислитель и восстановитель.
191.Какие из нижеприведённых реакций являются окислитель- но-восстановительными? Составьте для них: а) электронные уравнения; б) уравнения реакций.
HNO3+H2S→NO2+S+H2O; FeCl3+KOH→Fe(OH)3+KCl; Cr2O3+NaOH+NaNO3→Na2CrO4+NaNO2+H2O; UCl4+O2+H2O→UO2Cl2+HCl.
192.Окислительно-восстановительные реакции выражаются следующими схемами:
H2SO4+H2O2+NaI→Na2SO4+I2+H2O; H2S+CoCl3→CoCl2+S+HCl; HNO3+As2S3→H3AsO4+H2SO4+NO2+H2O.
Составьте: а) электронные уравнения; б) уравнения реакций.
193.Окислительно-восстановительные реакции выражаются следующими схемами:
H2SO4+C→SO2+CO2+H2O; MnO2+H2SO4+NaBr→MnSO4+Na2SO4+Br2+H2O; HNO2+HI→NO+I2+H2O.
Составьте: а) электронные уравнения; б) уравнения реакций. Для каждой реакции укажите окислитель и восстановитель.
194.Окислительно-восстановительные реакции выражаются следующими схемами:
Pb+HNO3→Pb(NO3)2+NO+H2O; KMnO4+H2SO4+H2S→MnSO4+K2SO4+S+H2O; Cu2S+HNO3→Cu(NO3)2+NO+H2SO4+H2O.
Составьте: а) электронные уравнения; б) уравнения реакций. Для каждой реакции укажите окислитель и восстановитель.
49
195.Окислительно-восстановительные реакции выражаются следующими схемами:
F2+H2O→HF+O2; PbO2+HNO3+Mn(NO3)2→HMnO4+Pb(NO3)2+H2O; K2Cr2O7+H2SO4+Al→Al2(SO4)3+K2SO4+Cr2(SO4)3+H2O.
Составьте: а) электронные уравнения; б) уравнения реакций.
196.Окислительно-восстановительные реакции выражаются следующими схемами:
KMnO4+H2SO4+FeSO4→Fe2(SO4)3+MnSO4+K2SO4+H2O; K2Cr2O7+HCl→CrCl3+KCl+Cl2+H2O; NiS+H2O2+H2SO4→NiSO4+S+H2O.
Составьте: а) электронные уравнения; б) уравнения реакций. Для каждой реакции укажите окислитель и восстановитель.
197.Какие из нижеприведённых реакций являются окислитель- но-восстановительными? Составьте для них: а) электронные уравнения; б) уравнения реакций.
KClO3+KOH+MnO2→K2MnO4+KCl+H2O; (NH4)2SO4+KOH→K2SO4+NH3+H2O; KMnO4+Zn+H2SO4→MnSO4+ZnSO4+K2SO4+H2O; Cd+NaVO3+HCl→CdCl2+NaCl+VCl2+H2O.
198.Окислительно-восстановительные реакции выражаются следующими схемами:
MnO2+HCl→MnCl2+Cl2+H2O; FeSO4+Ag2SO4→Fe2(SO4)3+Ag; KNO3+C+S→K2S+CO2+N2.
Составьте: а) электронные уравнения; б) уравнения реакций. Для каждой реакции укажите окислитель и восстановитель.
199.Какие из нижеприведенных реакций являются окислитель- но-восстановительными? Составьте для них: а) электронные уравнения; б) уравнения реакций.
AlCl3+KOH→Al(OH)3+KCl; N2+H2→NH3; Zn+H2SO4→ZnSO4+SO2+H2O; Al(OH)3+NaOH→NaAlO2+H2O.
50
200.Окислительно-восстановительные реакции выражаются следующими схемами:
KNO2+K2Cr2O7+H2SO4→KNO3+Cr2(SO4)3+K2SO4+H2O; Cu+HNO3→Cu(NO3)2+NO+H2O; HBr+KMnO4→Br2+MnBr2+KBr+H2O.
Составьте: а) электронные уравнения; б) уравнения реакций.
Тема 11. Электродный потенциал и теория гальванического элемента
Пример 1. Никелевая и серебряная пластины погружены соответственно в растворы Ni(NO3)2 и AgNO3 с концентрациями ионов никеля 0,01 моль/л и ионов серебра 0,1 моль/л. Составьте электрохимическую схему, вычислите э.д.с. и изменение изобар- но-изотермического потенциала для реакции, протекающей при работе гальванического элемента.
Решение. Для вычисления значений электродных потенциалов никеля и серебра используем уравнение Нернста:
E = E0 + 0,059 lg aMn+ n ,
где aMn+ – активность ионов металла; n – зарядовое число иона;
E0 – стандартный электродный потенциал металла.
Для разбавленных растворов E = E0 + 0,059n lgC, где С – кон-
центрация катионов металла. Тогда (по данным табл. 7):
ENi2+ Ni = −0,25 + 0,059 lg10−2 = −0,309 В и n
EAg+ Ag = 0,80 + 0,059 lg10−1 = 0,74 В и n
Анодом в данном элементе является никель, так как
ENi2+ / Ni < EAg + / Ag.
Электрохимическая схема гальванического элемента записывается так:
а (–) Ni / Ni(NO3)2 || AgNO3 / Ag (+) к |
|
Ni – 2ē = Ni2+ |
Ag+ + ē = Ag |
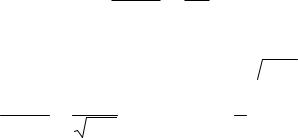
51
∆E = EK–EA=0,74–(–0,309)= 1,049 В.
Работа гальванического элемента обусловлена реакцией: Ni + 2Ag+ = Ni2+ + 2Ag.
Изменение изобарно-изотермического потенциала окисли- тельно-восстановительной реакции и э.д.с. элемента связаны математической зависимостью:
–∆G=nF ∆E,
где ∆E – э.д.с.; F – число Фарадея; n – зарядовое число катиона. Правая часть уравнения определяет величину максимальной полезной работы, совершаемой гальваническим элементом по переносу заряда против электрических сил Aмакс:
–∆G = Aмакс = 2 96485 1,049 = 202425 Дж =202,425 кДж.
Отрицательное значение ∆G свидетельствует о самопроизвольном протекании в гальваническом элементе окислительновосстановительной реакции.
Пример 2. Гальванический элемент составлен из медной пластины в насыщенном растворе CuS и медной пластины в 0,1 М
растворе CuSO4. Рассчитайте э.д.с. элемента. ПРCuS = 3,2 10−38. Решение. Для концентрационного элемента
∆E = 0,059 lg C1 (здесь С1>С2). n C2
ПРCuS = [Cu2+] [S2–], но [Cu2+] = [S2–] и ПРCuS = [Cu2+]2,
откуда [Cu2+] =  ПР ;
ПР ;
∆E = |
0,059 lg |
0,1 |
= 0,029(−1− |
1 lg 3,2 10−38 ) = 0,477 В. |
|
n |
ПР |
|
2 |
Задачи
201.Медная и никелевая пластины погружены в соответствующие растворы их солей с концентрацией ионов меди и никеля, равной 0,1 моль/л. Составьте схему гальванического элемента, вычислите э.д.с. и изменение изобарно-изотерми- ческого потенциала реакции, протекающей при работе гальванического элемента.
202.В каком направлении самопроизвольно пойдёт реакция в гальваническом элементе, составленном из двух электродов:
