
- •Лекция n 20-23. Растворы электролитов
- •1. Растворы электролитов. Слабые электролиты. Закон разбавления Оствальда
- •Растворы слабых электролитов
- •2. Сильные электролиты. Активность. Ионная сила раствора
- •3. Электролитическая диссоциация воды, рН раствора. Расчет рН растворов сильных и слабых электролитов..
- •Расчет рН растворов сильных и слабых электролитов.
- •4. Буферные растворы. Буферные системы живых организмов.
- •Типы буферных систем.
- •Расчет рН буферных растворов.
- •Механизм действия буферных систем
- •Буферные системы живого организма
- •3.Белковые буферные системы.
- •5. Гидролиз солей
- •Влияние различных факторов на гидролиз.
- •6. Равновесие в системе осадок – раствор электролита
- •Условия растворения и осаждения труднорастворимых электролитов
- •7. Равновесия в растворах комплексных соединений
- •Токсичность солей тяжелых металлов
3. Электролитическая диссоциация воды, рН раствора. Расчет рН растворов сильных и слабых электролитов..
Вода – слабый электролит, который диссоциирует по уравнению:
![]()
Константа диссоциации воды при 250С составляет:
![]()
Так как константа диссоциации воды очень мала, можно считать концентрацию воды постоянной величиной:
![]()
Тогда:
K[H2O] =[H+] [OH-] = 55,61,810-16 = 10-14
Kw= [H+] [OH-] = 10-14
Величина Kw называется ионным произведением воды.
Ионное произведение воды характеризует равновесие между ионами водорода и гидроксид-ионами в водных растворах и является постоянной при данной температуре величиной.
Кислотность или основность водного раствора может быть выражена концентрацией ионов водорода или гидроксид-ионов. Чаще всего для этой цели используют величину рН, которая связана с концентрацией ионов водорода следующим соотношением:
pH = - lg[H+]
В нейтральной среде:
[H+]
= [OH-]
=
![]() моль/л
моль/л
pH = 7
В кислой среде:
[H+] > [OH-] pH < 7
В щелочной среде:
[H+] <[OH-] pH > 7
Расчет рН растворов сильных и слабых электролитов.
Пример 1. Рассчитать рН 0,01М раствора соляной кислоты.
Для разбавленных растворов сильных электролитов принимаем =1, =1 и а=с. Тогда:
[H+] = CHCl = 0,01 моль/л
рН = - lg 0,01 = 2.
Пример 2. Рассчитать рН 0,01М раствора гидроксида аммония.
(Кв=1,810-5).
Гидроксид аммония диссоциирует по уравнению:
![]()

Согласно уравнению диссоциации:
[NH4+]=[OH-]
Так как Кв очень мала, то можно считать, что равновесная концентрация молекул, не распавшихся на ионы, равна исходной концентрации гидроксида аммония. Тогда:
![]()
[OH-]
=
![]() =
=
![]()
Используя ионное произведение воды, вычисляем концентрацию ионов водорода и рН раствора:
![]() =
=![]()
pH = - lg [H+] = -lg 2,410-11= 10,6
4. Буферные растворы. Буферные системы живых организмов.
Буферными называют растворы, рН которых изменяется лишь незначительно при добавлении небольших количеств кислоты или щелочи, а также при разбавлении.
С точки зрения протонной теории кислот и оснований буферные системы должны содержать сопряженные кислотно-основные пары:
НА = Н+ + А-
кислота сопряженное
основание
В + Н+ = ВН+
основание сопряженная
кислота
Типы буферных систем.
Раствор слабой кислоты и ее соли, например:
ацетатный буфер (СН3СОО-/СН3СООН);
гидрокарбонатный буфер (НСО3-/Н2СО3).
Раствор кислой и средней соли или двух кислых солей, например:
карбонатный буфер (СО32-/НСО3-);
фосфатный буфер (НРО42-/Н2РО4-).
Раствор слабого основания и его соли, например:
аммиачный буфер (NH3/NH4+).
4. Растворы амфолитов: аминокислот или белков.
Расчет рН буферных растворов.
Рассчитаем рН буферного раствора, содержащего в 1 л 0,1 моль уксусной кислоты и 0,1 моль ацетата натрия.
Концентрацию ионов водорода вычисляем, исходя из константы диссоциации уксусной кислоты :
![]()


В присутствии ацетата натрия равновесие диссоциации уксусной кислоты сдвинуто влево, поэтому можно считать, что

Тогда

![]()
рН = 4,76
В общем случае, для буферного раствора, образованного смешением слабой кислоты и ее соли:

где pKa= - lg Ka.
Рассчитаем рН буферного раствора, содержащего в 1 л 0,01 моль гидроксида аммония и 0,1 моль хлорида аммония.
Концентрацию гидроксид-ионов рассчитаем, исходя из константы диссоциации гидроксида аммония:
![]()

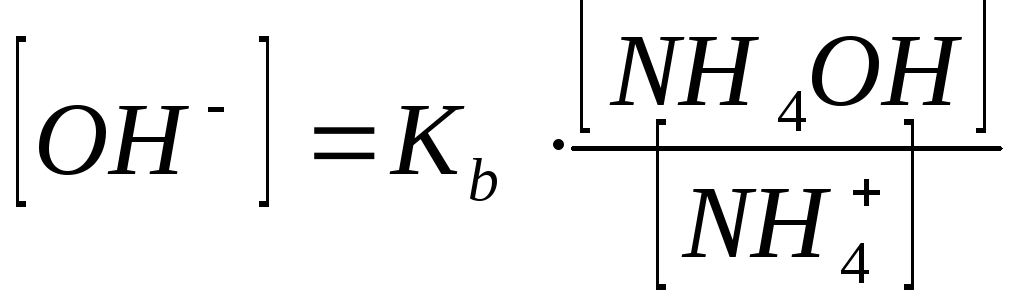
В присутствии хлорида аммония равновесие диссоциации гидроксида аммония смещено влево, поэтому можно считать, что

Тогда

![]()
Исходя из ионного произведения воды, рассчитаем [H+] и рН раствора:
![]() моль/л.
моль/л.
В общем случае, для буферных растворов, образованных смешением слабого основания и его соли:

где pKb = - lg Kb, а 14 = - lg Kw
