
Lektsii_po_biofizike_Baskakov_Kapilevich
.pdf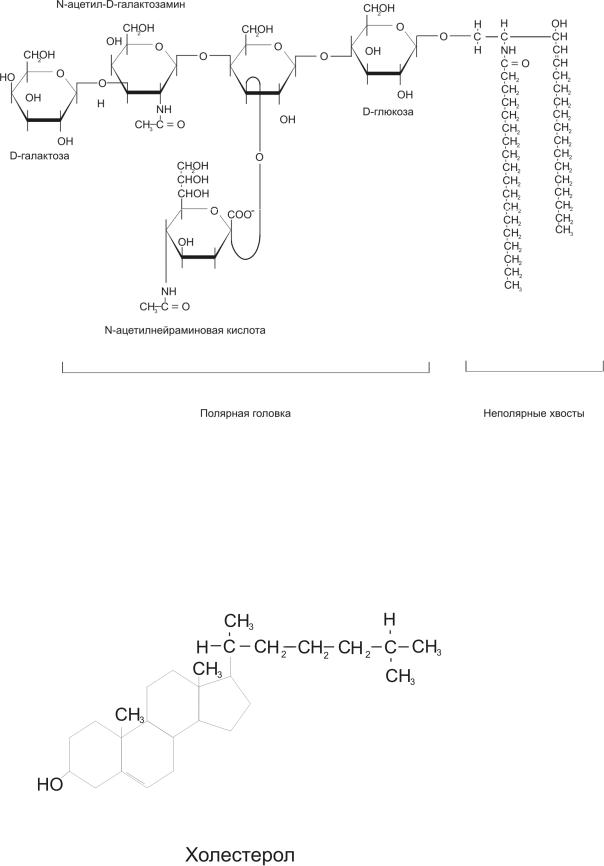
Гликолипиды – липиды, содержащие 2 остатка жирных кислот, спирт сфингозин и остатки моно- (цереброзиды) или олигосахаров (ганглиозиды).
Стероиды содержат стероидное ядро, образованное тремя гексагональными полностью насыщенными кольцами и одним циклопентановым кольцом. Стероиды представлены в основном холестерином (в животных клетках) или ситостерином и стигмастерином (в растительных клетках).
Физиологическая роль различных классов липидов
Фосфолипиды выполняют структурную функцию, образуя липидный бислой мембраны. Кроме того, они могут выполнять и важные
71
физиологические функции. Так, арахидоновая кислота, состоящая из цепи с 20 атомами углерода и с 4 двойными связями, входящая в состав фосфолипидов, служит предшественником таких биологически активных веществ, как простагландины.
Гликолипиды широко представлены в различных тканях, в частности в нервной. Они локализованы преимущественно на наружной поверхности цитоплазматической мембраны, где их углеводные компоненты входят в число других углеводов клеточной поверхности. Ганглиозиды участвуют в дифференцировке нейрональной ткани. Ганглиозиды других клеток определяют видоспецифичность и регулируют межклеточные контакты. В иммунокомпетентных клетках они участвуют в формировании иммунной реакции. Холестерин выполняет важную роль в модификации бислоя: он, в частности, регулирует упаковку и подвижность фосфолипидов мембраны. Кроме того, холестерин служит предшественником в образовании половых гормонов, гормонов коры надпочечников, а также желчных кислот.
Липид-липидные взаимодействия. Динамические характеристики расположения липидов в мембране
Длина растянутой углеводородной цепи жирной кислоты, состоящей из 18 атомов углерода, составляет 2 нм, на полярную головку приходится еще 0,5–0,7 нм, следовательно, толщина бислоя липидов должна превышать 4 нм, но в действительности толщина двойного слоя липидов оказывается равной 3,5–4 нм. Причиной обнаруженного феномена является рыхлое, а не упорядоченное расположение остатков жирных кислот. Раз одна из двух жирных кислот, образующих гидрофобный хвост, ненасыщенная, как правило, увеличивается вероятность образования цис-конформации.
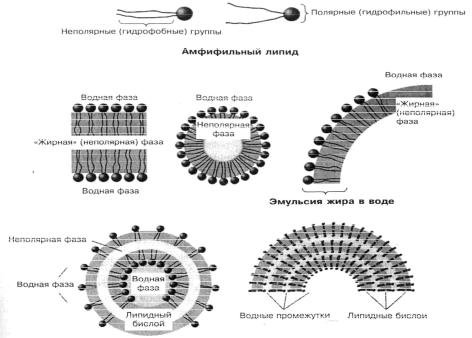
Рис.14. Структуры, образуемые липидами в водной фазе.
72
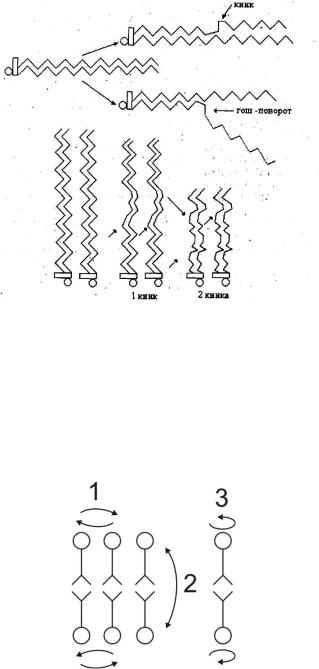
Различные конфигурации молекул жирных кислот, возникающие при поворотах вокруг С-С связей, называют ротамерами или конформерами. Процесс изменения конформации молекул за счет таких поворотов называется транс-гош-изомеризацией (рис. 15). Гош-конформация (“гош” – скошенный) аналогична цис-конформации. Вероятность транс-гош-перехода весьма велика
иеще более возрастает при увеличении температуры. При переходе из транс- в гош-конформацию образуются складки или кинки (от англ. kink – петля). Такого рода изменения способны захватывать целые кластеры мембранных липидов. Считается, что именно с образованием кинков связан транспорт воды
идругих веществ через мембраны.
|
Липиды |
способны |
совершать |
|||
|
вращательные |
движения |
вокруг оси |
|||
|
молекулы (вращательная диффузия), |
|||||
|
перемещаться в пределах одного слоя |
|||||
|
(латеральная диффузия), а также |
|||||
|
перемещаться из одного слоя в другой |
|||||
|
(трансмембранный переход или флип- |
|||||
|
флоп) (рис. 16). Наибольшую |
|||||
|
скорость |
имеют вращательная |
и |
|||
|
латеральная диффузия. Например, |
|||||
|
коэффициент |
латеральной диффузии |
||||
|
составляет 1,8×10-8см2 с-1. Это |
|||||
|
соответствует |
частоте |
парных |
|||
|
перестановок соседних молекул 107с-1. |
|||||
|
Наиболее |
медленным |
процессом |
|||
Рис. 15. Гош-трансоформация и |
является флип-флоп, |
что |
связано |
с |
||
образование кинков. |
высоким |
|
уровнем |
энергии, |
||
|
необходимой |
для |
проталкивания |
|||
|
заряженных |
полярных |
головок через |
|||
средний углеводородный слой мембраны. Поперечная диффузия молекул фосфолипидов на расстоянии 5 нм занимает в 109 раз больше времени, чем диффузия на то же расстояние в латеральном направлении.
Рис. 16. Виды диффузии липидов в мембране.
1 – латеральная диффузия;
2 – трансмембранный переход или флипфлоп; 3 – вращательная диффузия.
Сочетание быстрой диффузии молекул липидов вдоль мембраны и медленной диффузии поперек мембраны имеет большое значение для функционирования мембран. Благодаря этому поддерживается
73
упорядоченность в молекулярной структуре мембраны, определенная ориентация белков поперек мембраны, что имеет значение для направленного переноса веществ через мембрану, кроме того, обеспечивается асимметрия бислоя липидов. Функциональная асимметрия мембраны – один из важнейших аспектов, характеризующих липид-липидные взаимодействия. Асимметрия бислоя означает, что состав липидов каждого из слоев неодинаков.
Фазовые переходы липидов
Вводной среде липидные структуры часто ведут себя как жидкие кристаллы – обладают анизотропией и некоторыми признаками упорядоченности (рис. 14). Это связано с тем, что они в качестве двуцепочечных амфифильных (амфипатических) молекул способны образовывать двойные слои в водной среде. Полярные головки при этом обращены в водную среду, а неполярные хвосты создают гидрофобную среду.
Бислой обладает свойствами лиотропного мезоморфизма (зависимость состояния от гидратации) и термотропного мезоморфизма (зависимость состояния от температуры). Эти свойства связаны друг с другом – температура фазового перехода зависит от степени гидратации, а также от рН, электрического заряда и ионного состава раствора.
При достижении критической температуры в липидном бислое происходит фазовый переход из состояния жидкого кристалла в гель и обратно. В полностью однородном бислое (состоящем из одного типа липидных молекул) фазовые переходы являются кооперативными. То есть в узком температурном интервале им охватывается весь бислой.
Вмомент фазового перехода возрастает подвижность полярных головок и гидрофобных хвостов, меняется геометрия бислоя – увеличивается его площадь
ивозрастает гидрофобный объём мембраны.
Фазовые переходы в мембране обладают склонностью к кооперативности, то есть к генерализации с помощью так называемых конформационночувствительных сигналов.
Белки мембраны и их функции
Доля белка в общей массе мембраны может колебаться в очень широких пределах – от 18% в миелине до 75% в митохондриальной мембране.
По расположению в мембране белки можно разделить на интегральные и периферические (рис. 17).
Интегральные белки являются, как правило, гидрофобными и легко встраиваются в липидный бислой.
74
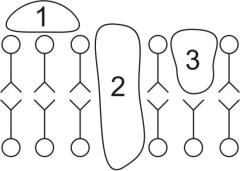
Рис. 17. Классификация белков по месту их расположения в мембране.
1 – периферические;
2 – интегральные;
3 – полуинтегральные.
Взаимодействие такого белка с мембраной происходит в несколько стадий. Сначала белок адсорбируется на поверхности бислоя, изменяет свою конформацию, устанавливая гидрофобный контакт с мембраной. Затем происходит внедрение белка в бислой. Глубина внедрения зависит от силы гидрофобного взаимодействия и соотношения гидрофобных и гидрофильных участков на поверхности белковой глобулы. Гидрофильные участки белка взаимодействуют с примембранными слоями по одну или обе стороны мембраны. Фиксация белковой глобулы в мембране происходит благодаря
электростатическим и гидрофобным взаимодействиям. Углеводная часть белковых молекул (если она имеется) выступает наружу. Интегральные белки в силу тесной связи с бислоем оказывают на него существенное воздействие: конформационные перестройки белка приводят к изменению состояния липидов, так называемой деформации бислоя.
Периферические белки обладают меньшей глубиной проникновения в липидный бислой и, соответственно, более слабо взаимодействуют с липидами мембраны, оказывая на них гораздо меньшее воздействие, чем интегральные.
По характеру взаимодействия с мембраной белки делятся на
монотопические, битопические, политопические:
монотопические белки взаимодействуют с поверхностью мембраны (моно
– одним из слоев липидов); битопические пронизывают мембрану насквозь (би – двумя слоями
липидов); политопические пронизывают мембрану несколько раз (поли –
многократное взаимодействие с липидами).
Понятно, что первые относятся к периферическим белкам, а вторые и третьи – интегральным.
Белки мембран можно также классифицировать по выполняемой ими функции. В связи с этим выделяют следующие белки:
структурные белки;
белки-ферменты;
белки-рецепторы;
транспортные белки.
Особую группу составляют белки цитоскелета клетки. Строго говоря, эти белки не являются компонентами мембраны, примыкая к ней с цитоплазматической стороны. Белки цитоскелета входят в состав всех его
75
компонентов: миофиламенты содержат молекулы белка актина; в состав микротрубочек входит белок тубулин, промежуточные филаменты также содержат более полиморфный белковый комплекс. Цитоскелет не только обеспечивает эластичность мембраны, противостоит изменениям объема клетки, но, по-видимому, участвует и в различных внутри- и внеклеточных механизмах регуляции.
Модели биологических мембран
Первоначальные представления о существовании мембран опирались на физиологические исследования. Первые указания на лимитирующие диффузию свойства клеточной поверхности были получены в середине XIX века К.В.Нагели. Он отметил, что клеточная поверхность является барьером для свободной диффузии красителей внутрь клетки из внеклеточной жидкости. Кроме того, Нагели обнаружил, что клетки проявляют осмотические свойства. На основании этих наблюдений он предположил, что существует некая плазматическая мембрана.
Используя эритроциты в качестве осмометра, Э. Овертон в конце XIX века выявил тесную взаимосвязь между растворимостью вещества в липидах и его способностью проникать в клетку: чем больше эта растворимость, тем меньший осмотический эффект оказывает вещество. Эти данные явились первым свидетельством того, что мембраны содержат большое количество липидов.
Морфологические данные о существовании клеточной мембраны были получены только после разработки методов приготовления ультратонких срезов тканей, фиксированных химическими методами для проведения электронно-микроскопических исследований. Тонкая структура мембран была исследована с помощью метода замораживания – скалывания.
Первыми авторами, которые предложили модель структурной организации мембраны, были Э. Гортер и Ф. Грендель (1925).
Они экстрагировали липиды из теней эритроцитов и приготовляли из них мономолекулярную плёнку на поверхности воды. Амфифильные молекулы липидов распределялись таким образом, что их полярные головки были погружены в воду, а неполярные хвосты торчали наружу. Пленку диспергированных молекул на поверхности воды аккуратно сжимали в латеральном направлении и измеряли силу сжатия. Резкое возрастание этой силы происходило в момент формирования компактного монослоя.
Оказалось, что площадь, занимаемая монослоем, в 2 раза превышала поверхность эритроцитов, взятых для экстракции. Именно это послужило основанием для создания Э. Гортером и Ф. Гренделем концепции липидного бислоя, которая впоследствии легла в основу всех дальнейших представлений о структуре мембран.
Измерение поверхностного натяжения липидного бислоя показало, что оно гораздо больше, чем в мембране эритроцитов, и снижается при добавлении в бислой белков. На основании этих данных в 1931 г. Дж. Ф. Даниэлли предложил модель «сэндвича», или унитарную мембранную модель. По его представлению, белки покрывают обе поверхности липидного бислоя,
76
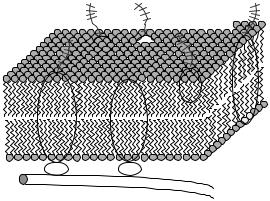
связываясь с ним электростатическими силами. Из расчётов выходило, что белки находятся на мембране в фибриллярной форме. Этой модели неплохо соответствует миелин – мембрана леммоцитов.
Робертсон несколько модифицировал модель Даниэлли (1964), предположив, что глобулярные белки находятся на внешней стороне мембраны, а фибриллярные белки – на внутренней.
Однако с термодинамической точки зрения маловероятно, что белок может успешно конкурировать с водой за полярные головки липидных молекул и что слой белка смог бы экранировать их от водного окружения.
Современные методы исследования окончательно опровергли «бутербродную модель» мембраны.
На сегодняшний день общепризнанной является «мозаичная» модель мембраны, предложенная в 1972 г. С. Сингером и Г. Николсоном. Основанием для создания жидкостно-мозаичной модели мембраны послужили данные следующих исследований. Оптические наблюдения показали, что мембранные белки имеют глобулярную структуру (рис. 18).
Было установлено, что некоторые белковые молекулы свободно диффундируют в латеральном направлении, т.е. в плоскости мембраны. Исследования с использованием изотопов и др. показали, что белковые молекулы или их части, экспонированные с одной стороны мембраны, отличаются от других, выходящих на другую сторону мембраны.
Согласно этой модели, глобулярные белки интегрированы в липидный бислой; при этом одни из них пронизывают его насквозь, другие лишь частично погружены в бислой. Мембрана является лабильной структурой, все её компоненты имеют возможность осуществлять различные формы подвижности
– латеральную диффузию, вращательные движения, «флип-флоп» переходы и другие.
Жидкостно-мозаичная модель, по-видимому, дает наиболее адекватные представления о структурной организации поверхностной мембраны и многих внутриклеточных мембран.
Липидный |
Углевод |
бислой 










Интегральный
белок
Периферический
белок
Цитоскелет
Рис. 18. Жидкостномозаичная модель биологической мембраны.
77
VI. СИГНАЛЬНАЯ ФУНКЦИЯ БИОЛОГИЧЕСКИХ МЕМБРАН
Основные регуляторные механизмы клетки
Одно из условий существования живых организмов – согласованное протекание всех химических и физических процессов в клетке. В процессе эволюции происходили отбор и закрепление тех регуляторных механизмов, которые наиболее эффективно обеспечивали согласованность физикохимических процессов в биологических системах. Создание новых, более совершенных форм регуляции не проводило к исчезновению менее совершенных. Среди регуляторных механизмов можно найти и сравнительно простые, реализуемые на уровне одноклеточных организмов, и более поздние высокоэффективные способы воздействия на активность клеток, тканей, органов. У многоклеточных организмов для поддержания целостности организма, координации активности тканей и осуществления гибкой регуляции физиологических функций клеток в процессе эволюции выработался сложный механизм межклеточных взаимодействий, который реализуется с помощью сигнальных молекул. В то же время этот сложная система регуляции включает в себя и относительно простые механизмы, которые реализуются как самостоятельные регуляторные пути на уровне отдельной клетки.
Внастоящей главе сделаем попытку обсудить известные механизмы клеточной регуляции, отличающиеся уровнем организации.
Наиболее многообразные функции в клетке выполняют белки, поэтому в большинстве случаев регуляция клеточной активности сводится к регуляции активности именно белковых молекул. Практически все биохимические реакции в клетке катализируются ферментами. В связи с этим одним из важнейших путей регуляции клеточных функций является изменение активности ферментов.
Первый путь регуляции клеточных функций обусловлен изменением активности ферментов.
Вкачестве второго пути регуляции клеточной активности следует назвать изменение компартментализации веществ. Роль компартментализации (пространственного разделения) метаболических процессов в клетках эукариот очень велика. Локализация специфических метаболических процессов в цитозоле или в клеточных органоидах облегчает независимую регуляцию этих процессов и позволяет осуществить наиболее тонкую регуляцию метаболизма. Поскольку ферменты и субстраты зачастую разделены мембраной, изменение
еепроницаемости для субстратов, несомненно, скажется на ходе ферментативных реакций.
Всвязи с тем, что многие ферменты клетки встроены в цитоплазматические мембраны, существует третий путь регуляции клеточной активности – так называемая топодинамическая регуляция, основанная на динамической неоднородности распределения белков в мембране, их
78
способности образовывать ассоциации. Объединение ферментов, катализирующих многоступенчатую последовательность метаболических реакций в макромолекулярный комплекс, позволяет координировать их работу и обеспечивает перемещение интермедиатов по метаболическому пути. Адекватное взаимное расположение ферментов облегчает перенос продукта от одного фермента к другому без его предварительного уравновешивания с метаболическим пулом. Конформационные изменения в одном из компонентов могут передаваться через белковые взаимодействия на другие компоненты комплекса, что позволяет усиливать регуляторные эффекты. Перестройки конформации ферментов зависят от их липидного окружения. Поскольку скорость латеральной диффузии белков в мембране меньше, чем скорость диффузии белков в цитозоле, то распределение ферментов в мембране может контролировать распределение ферментов в цитозоле. В связи со способностью ферментов изменять взаимное расположение для протекания реакций является важным, в каком участке клетки находится фермент и какие «соседи» расположены рядом. Для полного описания клеточного метаболизма или его звена необходимо, наряду с активностью фермента, вводить его пространственные координаты, которые являются функцией от времени.
Кроме белков определенный вклад в топодинамическую регуляцию вносят липиды. Примером может служить так называемая «молекулярная память» липидов. Многие краткосрочные события в мембране влияют на долговременные параметры ее функционирования. Например, взаимодействие лиганда с белком-рецептором приводит к изменению конформации белкарецептора, что, в свою очередь, вызывает изменение белок-липидных контактов, а это ведет к изменению состояния мембранных липидов. Это измененное состояние липидного бислоя сохраняется и после отсоединения лиганда от рецептора, что служит способом закрепления рецептора в возбужденном состоянии. Таким образом, бислой липидов способен воспринимать и сохранять в памяти информацию об измененном состоянии белков мембраны.
Следующим, четвертым способом регуляции клеточной активности является химическая модификация ферментов и других белков. В зависимости от того, какая химическая группа присоединяется к белку, различают ацетилирование, аденилирование, гидроксилирование, метилирование, фосфорилирование и др. В ряде случаев белки подвергаются химической модификации еще в процессе рибосомального синтеза. Присоединение химической группы изменяет функциональную активность или свойства белка, например устойчивость к протеолизу. Некоторые модификации белка (гидроксилирование, метилирование) сохраняются в течение всей его жизни, другие – в течение нескольких часов, суток (ацетилирование, аденилирование), минут (фосфорилирование). Наиболее хорошо изучено фосфорилирование белков, которое представляет собой присоединение к белку фосфатной группы. Ферменты, отвечающие за присоединение фосфатных групп к белковым молекулам, называют протеинкиназами. Источником фосфатной группы служит ATP. Обратную реакцию (дефосфорилирование) осуществляют
79
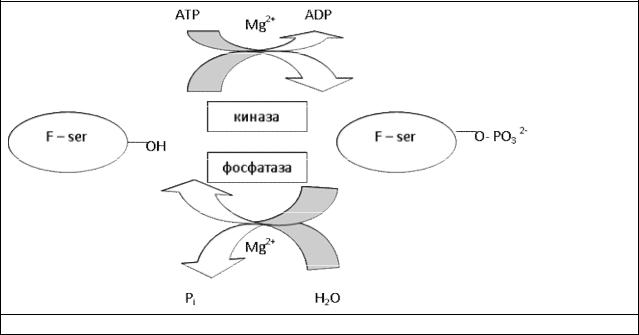
протеинфосфатазы. Различают серин-треониновые протеинкиназы и тирозининазы. Первые фосфорилируют белки по остаткам серина и треонина, вторые – по остаткам тирозина. Несмотря на то, что белок содержит много остатков серина, треонина или тирозина, фосфорилирование происходит избирательно и затрагивает лишь небольшое число (1–3) остатков. Дефосфорилирование осуществляют протеинфосфатазы двух типов: серинтреонинифосфатаза и тирозинфосфатаза. Обратимо модифицированные ферменты могут находиться в двух состояниях, одно из которых характеризуется высокой, а другое – низкой каталитической активностью. В зависимости от конкретного случая более эффективным катализатором может быть либо фосфо-, либо дефосфофермент (рис. 19).
Рис. 19. Регуляция клетки через фосфорилирование – дефосфорилирование белков.
Другим способом химической модификации белков служит ограниченный протеолиз, который представляет собой избирательное расщепление белка на фрагменты. Ферменты, осуществляющие протеолиз, называются протеазами. Так, многие ферменты производятся в виде проферментов. Для перехода их в активное состояние происходит отщепление фрагмента полипептидной цепи. Благодаря ограниченному протеолизу клетка в ответ на сигнал может увеличить количества активного фермента без транскрипции и трансляции.
В качестве пятого способа регуляции клеточной активности следует назвать экспрессию генома. Регуляция количества белка в клетке осуществляется посредством индукции и репрессии его синтеза, т.е. в результате изменения скорости транскрипции соответствующего гена. Согласно модели Жакоба и Моно, у прокариот индуктором синтеза белка является субстрат. У многоклеточных эукариот роль индукторов выполняют специфические регуляторы, например тиреоидные и стероидные гормоны. Подробнее этот вопрос будет рассмотрен далее.
И наконец, шестым способом регуляции активности клеток является система, связанная с так называемыми вторичными посредниками
80
