
- •Введение
- •Титриметрический (объемный) анализ
- •Классификация титриметрических методов анализа.
- •Закон эквивалентности.
- •Для проведения определения титриметрическим методом необходимо наличие:
- •Титрованные (стандартные) растворы. Титрованными (стандартным) растворами называются растворы с точно известной концентрацией (титром), предназначенные для целей титрования в объемном анализе.
- •Способы выражения концентрации титрованных растворов.
- •Выражение результатов измерений и вычислений в количественном анализе. Значащие цифры.
- •Занятие № 1
- •1. Тема: Введение в количественный анализ. Техника взвешивания. Титриметрические методы анализа. Кислотно-основное титрование.
- •Учебные вопросы для самоподготовки студентов
- •5.4. Пример решения задач:
- •Литература:
- •1. Проверка вместимости мерных пипеток.
- •2. Приготовление стандартных растворов метода кислотно-основного титрования.
- •Кислотно-основное титрование
- •Занятие № 2
- •1. Тема: Кислотно-основное титрование. Титрование сильных кислот сильными основаниями и наоборот.
- •2. Цель: Изучить теоретические основы метода кислотно-основного титрования и приобрести навыки титриметрического количественного определения сильных кислот и сильных оснований.
- •Учебные вопросы для самоподготовки студентов
- •5.4. Пример решения задач:
- •0,2 Ммоль hCl содержится в 38 мл
- •Литература:
- •Приготовление и стандартизация титрованных растворов метода кислотно-основного титрования.
- •Виды титрования, применяемые в титриметрическом анализе
- •Прямое и заместительное титрование.
- •Обратное титрование.
- •Кислотно-основное титрование слабых электролитов
- •Занятие № 3
- •1. Тема: Кислотно-основное титрование. Титрование слабых кислот щелочами и слабых оснований сильными кислотами.
- •2. Цель: Изучить теорию титрования слабых кислот щело-чами и слабых оснований сильными кислотами и приобрести навыки количественного определе-ния слабых кислот и слабых оснований.
- •Учебные вопросы для самоподготовки студентов
- •5.4. Пример решения задач:
- •Литература:
- •1. Определение массовой доли (в %) уксусной кислоты в растворе.
- •2. Определение граммового содержания аммиака в водном растворе аммиака.
- •По среднему значению объема титранта рассчитывают граммовое содержание аммиака в водном растворе аммиака по формуле:
- •Титрование многоосновных кислот, многокислотных оснований, смесей кислот или оснований
- •Занятие № 4
- •1. Тема: Кислотно-основное титрование. Титрование многоосновных кислот, многокислотных оснований, смесей кислот или оснований.
- •Учебные вопросы для самоподготовки студентов
- •5.4. Пример решения задач:
- •Литература:
- •Определение массовой доли (в %) гидрокарбоната натрия и карбоната натрия в смеси.
- •Титрование амфолитов
- •Определение гидрофосфата натрия Na2нро4.
- •Определение дигидрофосфата натрия NaН2ро4.
- •Индикаторные ошибки титрования
- •Занятие № 5
- •1. Тема: Кислотно-основное титрование. Титрование амфолитов.
- •2. Цель: Изучить общие положения титриметрического определения амфолитов. Изучить индикаторные ошибки кислотно-основного титрования.
- •Учебные вопросы для самоподготовки студентов
- •5.4. Пример решения задач:
- •Литература:
- •1.Определение массовой доли (в %) гидрофосфата натрия в образце.
- •2. Определение массовой доли (в %) дигидрофосфата натрия в образце.
- •Применение метода кислотно-основного титрования в количественном анализе химических веществ и лекарственных средств
- •Занятие № 6
- •1. Тема: Кислотно-основное титрование. Применение кислотно-основного титрования.
- •2. Цель: Научиться оценивать возможности методов кислотно-основного титрования и применять их в анализе химических соединений и лекарственных средств.
- •Учебные вопросы для самоподготовки студентов
- •5.4. Примеры решения задач:
- •Литература:
- •Определение массовой доли (в %) хлорида аммония в образце. Способ титрования – по замещению.
- •Ошибки в количественном анализе. Статистическая обработка и оценка результатов анализа
- •Занятие № 7
- •2. Цель: Сформировать знания по ошибкам количествен-ного анализа. Научиться оценивать результаты анализа. Проверить знания по темам 1-7 путем тестового контроля.
- •Учебные вопросы для самоподготовки студентов
- •5.4. Примеры решения задач:
- •Литература:
- •Определение массовой доли (в %) глицина (кислоты аминоуксусной) в образце и статистическая обработка результатов анализа. Способ титрования – по замещению.
- •Занятие № 8
- •Вопросы по изученному разделу количественного анализа
- •1. Титриметрические методы анализа
- •2. Кислотно-основное титрование
- •Литература:
- •Вопросы тестового контроля по методу кислотно-основного титрования
- •122. Для построения кривой титрования слабого основания сильной кислотой рН до начала титрования рассчитывают по формуле:
- •Тип вопросов на определение причинной зависимости (причинно-следственных взаимосвязей)
- •Содержание
5.4. Примеры решения задач:
Задача 1. Для определения содержания формальдегида в пробе навеску препарата массой 3,0170 г обработали 50,00 мл 1,000 М раствора NaOH (Кп = 0,9022) в присутствии пероксида водорода. При нагревании произошла реакция
НСОН + ОН- + Н2О2 ↔ НСОО- + 2Н2О
По охлаждении избыток щелочи оттитровали 20,12 мл раствора НСl с Т(НСl) = 0,03798. Вычислить массовую долю (в %) формальдегида в пробе.
Решение. Определение проведено по способу обратного титрования, методу отдельных навесок. Расчет результата проводят по формуле:
![]() .
.
М(НСОН) = 30,03 г/моль;
fэ(НСОН) = 1;
Мэ′(НСОН) = М(НСОН) · fэ(НСОН) : 1000 = 0,03003.
Поскольку в условии задачи приведен титр НСl, то предварительно вычисляем молярную концентрацию НСl:
СМ(НСl) = Т : Мэ′(HCl) = 0,03798 : 0,03646 = 1,042 М
Подставляем значения в формулу:
![]() .
.
Ответ: 24,04%.
Задача 2. Для определения бензальдегида навеску массой 0,4728 г обработали раствором солянокислого гидроксил-амина:
C6H5CHО + NH2OH ∙ HCl ↔ C6H5CHNOH + HCl + H2O
и выделившуюся хлороводородную кислоту оттитровали 19,45 мл 0,2500 М NaOH (Кп = 0,9845). На титрование солянокислого гидроксиламина в холостом опыте израсходовали 1,75 мл того же раствора NaOH. Вычислить массовую долю (в %) бензальдегида в исходном продукте.
Решение. При титровании по способу замещения расчетная формула имеет вид:
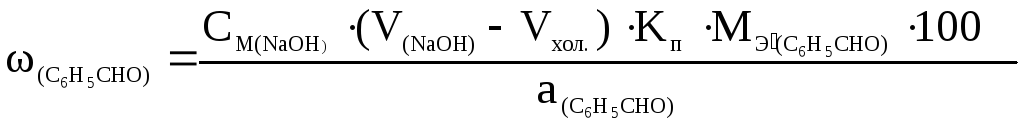 .
.
М(С6Н5СНО) = 106,1 г/моль;
fэ(С6Н5СНО) = 1;
Мэ′(С6Н5СНО) = М( С6Н5СНО) · fэ(С6Н5СНО) : 1000 = 0,1061.
Подставляя числовые значения в формулу, получаем:
![]() .
.
Ответ: 97,8%.
Литература:
1. Алексеев В.Н. Количественный анализ. – М.: Химия, 1972. – С. 282-287, 308-311.
2. Васильев В.П. Аналитическая химия. В 2 кн. Кн. 1. Титриметрические и гравиметрические методы анализа. – М.: Дрофа, 2002. – С. 156-165.
3. Государственная фармакопея СССР: Вып. 1. Общие методы анализа. – 11-е изд. – М.: Медицина, 1987. – Т.1. – 336 с.
4. Державна Фармакопея України. – 1-е вид. – Харків: РІРЕГ, 2001. – 556 с.
5. Лурье Ю.Ю. Справочник по аналитической химии. – 5-е изд. перераб. и доп. – М.: Химия, 1979. – 480 с.
6. Пономарев В.Д. Аналитическая химия. В 2 кн. Кн. 2. – М.: Высшая школа, 1982. – С. 75-77.
7. Практикум по аналитической химии. Под общ. ред. В.Д. Пономарева, Л.И. Ивановой. - М.: Высшая школа, 1983. – С. 161-167.
8. Харитонов Ю.Я. Аналитическая химия (аналитика). В 2 кн. Кн. 2. Количественный анализ. Физико-химические (инструментальные) методы анализа. – М.: Высшая школа, 2001. – С. 125-128.
6. ЛАБОРАТОРНАЯ РАБОТА
Определение массовой доли (в %) хлорида аммония в образце. Способ титрования – по замещению.
Метод титрования – отдельных навесок.
Химизм определения:
4NH4Cl + 6CH2O ↔ (CH2)6N4 + 4HCl + 6H2O
4NH4+ + 6CH2O ↔ (CH2)6N4 + 4H+ + 6H2O
HCl + NaOH ↔ NaCl + H2O
H+ + OH- ↔ H2O
Предварительные расчеты:
М(NH4Cl) = 53,49 г/моль;
fэ(NH4Cl) = 1;
Мэ(NH4Cl) = М(NH4Cl) ∙ fэ(NH4Cl) = 53,49 г/моль;
Мэ′(NH4Cl) = 0,05349;
Т(NaOH/NH4Cl) = СМ(NaOH) ∙ Мэ′(NH4Cl);
Т(NaOH/NH4Cl) = 0,1000 ∙ 0,05349 = 0,005349 г/моль;
а (NH4Cl) = СМ(NaOH) ∙ Мэ′(NH4Cl) ∙ V.
Методика определения. Точную навеску хлорида аммония, рассчитанную на 20 мл титранта, взятую на аналитических весах по разности, помещают в колбу для титрования, растворяют в 15 мл дистиллированной воды, добавляют 5 мл формалина (40% раствор формальдегида), предварительно нейтрализованного по фенолфталеину и 1-2 капли фенолфталеина. Смесь оставляют на 2 мин и титруют 0,1000 М раствором гидроксида натрия до бледно-розовой окраски, не исчезающей в течение 30 с. Определение проводят три раза. Для каждого определения рассчитывают массовую долю (в %) хлорида аммония по формуле:
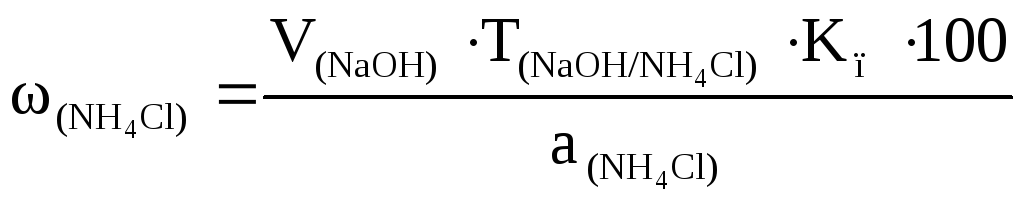 .
.
По полученным результатам рассчитывают среднее значение массовой доли хлорида аммония.
Вывод:
7. НАГЛЯДНЫЕ ПОСОБИЯ, ТС обучения и контроля
7.1. Табличный фонд по теме занятия.
7.2. Учебные пособия:
–справочник по аналитической химии;
–практикум по аналитической химии.
7.3. ТС обучения и контроля:
–карточки для выявления исходного уровня знаний-умений;
–контрольные вопросы.
