
- •Введение
- •Титриметрический (объемный) анализ
- •Классификация титриметрических методов анализа.
- •Закон эквивалентности.
- •Для проведения определения титриметрическим методом необходимо наличие:
- •Титрованные (стандартные) растворы. Титрованными (стандартным) растворами называются растворы с точно известной концентрацией (титром), предназначенные для целей титрования в объемном анализе.
- •Способы выражения концентрации титрованных растворов.
- •Выражение результатов измерений и вычислений в количественном анализе. Значащие цифры.
- •Занятие № 1
- •1. Тема: Введение в количественный анализ. Техника взвешивания. Титриметрические методы анализа. Кислотно-основное титрование.
- •Учебные вопросы для самоподготовки студентов
- •5.4. Пример решения задач:
- •Литература:
- •1. Проверка вместимости мерных пипеток.
- •2. Приготовление стандартных растворов метода кислотно-основного титрования.
- •Кислотно-основное титрование
- •Занятие № 2
- •1. Тема: Кислотно-основное титрование. Титрование сильных кислот сильными основаниями и наоборот.
- •2. Цель: Изучить теоретические основы метода кислотно-основного титрования и приобрести навыки титриметрического количественного определения сильных кислот и сильных оснований.
- •Учебные вопросы для самоподготовки студентов
- •5.4. Пример решения задач:
- •0,2 Ммоль hCl содержится в 38 мл
- •Литература:
- •Приготовление и стандартизация титрованных растворов метода кислотно-основного титрования.
- •Виды титрования, применяемые в титриметрическом анализе
- •Прямое и заместительное титрование.
- •Обратное титрование.
- •Кислотно-основное титрование слабых электролитов
- •Занятие № 3
- •1. Тема: Кислотно-основное титрование. Титрование слабых кислот щелочами и слабых оснований сильными кислотами.
- •2. Цель: Изучить теорию титрования слабых кислот щело-чами и слабых оснований сильными кислотами и приобрести навыки количественного определе-ния слабых кислот и слабых оснований.
- •Учебные вопросы для самоподготовки студентов
- •5.4. Пример решения задач:
- •Литература:
- •1. Определение массовой доли (в %) уксусной кислоты в растворе.
- •2. Определение граммового содержания аммиака в водном растворе аммиака.
- •По среднему значению объема титранта рассчитывают граммовое содержание аммиака в водном растворе аммиака по формуле:
- •Титрование многоосновных кислот, многокислотных оснований, смесей кислот или оснований
- •Занятие № 4
- •1. Тема: Кислотно-основное титрование. Титрование многоосновных кислот, многокислотных оснований, смесей кислот или оснований.
- •Учебные вопросы для самоподготовки студентов
- •5.4. Пример решения задач:
- •Литература:
- •Определение массовой доли (в %) гидрокарбоната натрия и карбоната натрия в смеси.
- •Титрование амфолитов
- •Определение гидрофосфата натрия Na2нро4.
- •Определение дигидрофосфата натрия NaН2ро4.
- •Индикаторные ошибки титрования
- •Занятие № 5
- •1. Тема: Кислотно-основное титрование. Титрование амфолитов.
- •2. Цель: Изучить общие положения титриметрического определения амфолитов. Изучить индикаторные ошибки кислотно-основного титрования.
- •Учебные вопросы для самоподготовки студентов
- •5.4. Пример решения задач:
- •Литература:
- •1.Определение массовой доли (в %) гидрофосфата натрия в образце.
- •2. Определение массовой доли (в %) дигидрофосфата натрия в образце.
- •Применение метода кислотно-основного титрования в количественном анализе химических веществ и лекарственных средств
- •Занятие № 6
- •1. Тема: Кислотно-основное титрование. Применение кислотно-основного титрования.
- •2. Цель: Научиться оценивать возможности методов кислотно-основного титрования и применять их в анализе химических соединений и лекарственных средств.
- •Учебные вопросы для самоподготовки студентов
- •5.4. Примеры решения задач:
- •Литература:
- •Определение массовой доли (в %) хлорида аммония в образце. Способ титрования – по замещению.
- •Ошибки в количественном анализе. Статистическая обработка и оценка результатов анализа
- •Занятие № 7
- •2. Цель: Сформировать знания по ошибкам количествен-ного анализа. Научиться оценивать результаты анализа. Проверить знания по темам 1-7 путем тестового контроля.
- •Учебные вопросы для самоподготовки студентов
- •5.4. Примеры решения задач:
- •Литература:
- •Определение массовой доли (в %) глицина (кислоты аминоуксусной) в образце и статистическая обработка результатов анализа. Способ титрования – по замещению.
- •Занятие № 8
- •Вопросы по изученному разделу количественного анализа
- •1. Титриметрические методы анализа
- •2. Кислотно-основное титрование
- •Литература:
- •Вопросы тестового контроля по методу кислотно-основного титрования
- •122. Для построения кривой титрования слабого основания сильной кислотой рН до начала титрования рассчитывают по формуле:
- •Тип вопросов на определение причинной зависимости (причинно-следственных взаимосвязей)
- •Содержание
Определение гидрофосфата натрия Na2нро4.
В водном растворе гидрофосфат натрия проявляет как кислотные, так и основные свойства.
Константа
кислотности
гидрофосфата натрия
![]() равна константе кислотности фосфорной
кислоты по третьей ступени:
равна константе кислотности фосфорной
кислоты по третьей ступени:
НРО42- + Н2О ↔ РО43- + Н3О+
а1 b2 b1 а2
![]()
Константа
основности
гидрофосфата натрия
![]() рассчитывается как отношение константы
воды к константе кислотности фосфорной
кислоты по второй ступени:
рассчитывается как отношение константы
воды к константе кислотности фосфорной
кислоты по второй ступени:
НРО42- + Н2О ↔ Н2РО4- + ОН-
b1 а2 а1 b2
![]()
![]() >>
>>![]() ,
значит, гидрофосфат натрия в большей
степени будет проявлятьосновные
свойства.
,
значит, гидрофосфат натрия в большей
степени будет проявлятьосновные
свойства.
Следовательно, титриметрическое определение гидро-фосфата натрия проводят методом ацидиметрии (титрант HCl) с индикатором метиловым оранжевым, т.к. значение рН в точке эквивалентности равно:
![]()
Химизм титрования:
НРО42- + Н3О+ ↔ Н2РО4- + H2O
Определение дигидрофосфата натрия NaН2ро4.
Дигидрофосфат натрия в водном растворе также проявляет как кислотные, так и основные свойства.
Константа
кислотности
дигидрофосфата натрия
![]() равна константе кислотности фосфорной
кислоты по второй ступени:
равна константе кислотности фосфорной
кислоты по второй ступени:
Н2РО4- + Н2О ↔ НРО42- + Н3О+
а1 b2 b1 а2
![]()
Константа
основности
дигидрофосфата натрия
![]() рассчитывается как отношение константы
воды к константе кислотности фосфорной
кислоты по первой ступени:
рассчитывается как отношение константы
воды к константе кислотности фосфорной
кислоты по первой ступени:
Н2РО4- + Н2О ↔ Н3РО4 + ОН-
b1 а2 а1 b2
![]()
![]() >>
>>![]() ,
значит, дигидрофосфат натрия в большей
степени будет проявлятькислотные
свойства.
,
значит, дигидрофосфат натрия в большей
степени будет проявлятькислотные
свойства.
Следовательно, титриметрическое определение гидрофосфата натрия проводят методом алкалиметрии (титрант NaОН) с индикатором фенолфталеином, т.к. значение рН в точке эквивалентности равно:
![]()
Химизм титрования:
Н2РО4- + ОН- ↔ НРО42- + H2O
Индикаторные ошибки титрования
Индикаторные ошибки обусловлены несовпадением значений рН титруемого раствора в точке эквивалентности (ТЭ) и рТ индикатора в конечной точке титрования (КТТ). Практически невозможно подобрать такой индикатор кислотно-основного титрования, значение рТ которого точно совпадало бы со значением рН в ТЭ. Поэтому индикатор меняет свою окраску в КТТ либо до ТЭ, либо после нее. Если изменение окраски индикатора происходит до ТЭ, то раствор недотитрован, в КТТ остается некоторое количество неоттитрованного определяемого вещества. Если же окраска индикатора изменяется после ТЭ, то раствор перетитрован, в КТТ имеется некоторое избыточное количество титранта. В связи с этим измеренный объем израсходованного титранта может быть либо меньше, либо больше стехиометрического объема в ТЭ. Величина индикаторной ошибки кислотно-основного титрования тем заметнее, чем больше разность между значениями рТ индикатора и рН титруемого раствора в ТЭ.
Обычно стремятся свести индикаторные ошибки к минимуму так, чтобы они, во всяком случае, не превышали бы 0,2%. Это достигается в основном путем выбора соответствующего индикатора.
В методе кислотно-основного титрования различают несколько типов индикаторных ошибок:
–протонная или водородная ошибка (Н+ош.) – обусловлена присутствием избытка ионов водорода Н+ в титруемом растворе; возникает при недотитровании сильной кислоты, либо при перетитровании основания раствором сильной кислоты. Протонная ошибка рассчитывается по формуле:
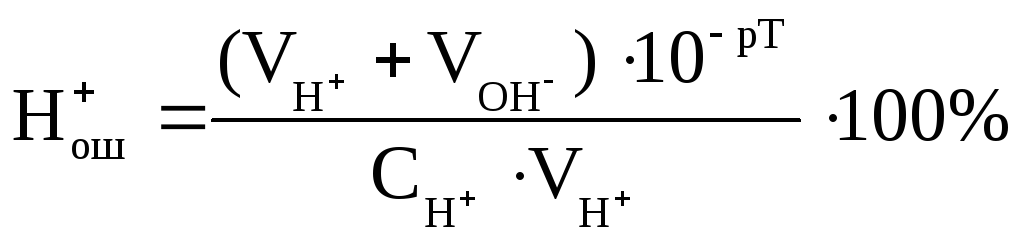
–гидроксидная ошибка (ОН-ош.) – обусловлена наличием в титруемом растворе избытка гидроксид-ионов сильного основания в КТТ либо в результате недотитровывания раствора сильного основания кислотой (отрицательная ошибка), либо в результате перетитровывания раствора кислоты сильным основанием (положительная ошибка). Гидроксидная ошибка рассчитывается по формуле:
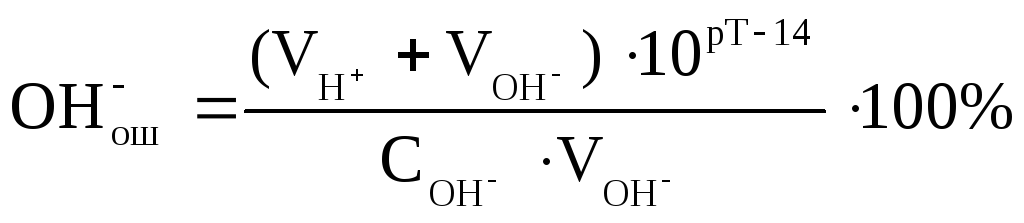
–кислотная ошибка (НАош.) – обусловлена наличием в титруемом растворе недотитрованных молекул слабой кислоты. Кислотная ошибка рассчитывается по формуле:
![]()
–основная ошибка (Вош.) – обусловлена наличием в титруемом растворе недотитрованных молекул слабого основания. Основная ошибка рассчитывается по формуле:
![]()
