
Тестовые задания по неорганической химии
.docA. –3
B.+3
C.+5
D.–5
E.+1
-
Среди приведенных соединений укажите эмпирическую формулу лекарственного препарата - буры.
A.Na2B4O7 10H2O
B.NaBO2
C.Na3B
D.B(OC2H5)3
E.B2H6
-
Лекарственный препарат пероксид водорода H2O2 cодержит атом кислорода в промежуточной степени окисления –1. Укажите какие свойства проявляет пероксид водорода в окислительно-восстановительных реакциях:
A.окислительно-восстановительную двойственность
B.только окислительные свойства
C.только восстановительные свойства
D.служит средой для протекания реакций
E.не принимает участия в ОВР
-
Какая запись электронной конфигурации валентных электронов отвечает элементу 4-ого периода VI группы главной подгруппы:
A.4s2 4p4
B.4s1 3d5
C.6s2 6p2
D.6s2 5d2
E.3s2 3p4
-
Ионная связь образована:
A.Электростатическим взаимодействием противоположно заряженных ионов.
B.Обобщенными валентными электронами.
C.Электростатическим взаимодействием молекулярных диполей.
D.Общей парой электронов.
E.Взаимодействием атома водорода с более электроотрицательными атомами.
-
Чем отличаются большие периоды элементов от малых?
A.Наличием d и f –элементов.
B.Наличием s –элементов.
C.Наличием инертных газов.
D.Наличием металлов.
E.Наличием неметаллов.
-
Укажите какая константа диссоциации многоосновной кислоты всегда больше других:
A.Первая
B.Вторая
C.Третья
D.Четвертая
E.Последняя
-
Укажите концентрацию гидроксид-ионов (в моль/л) в растворе, рОН которого равен 9:
A.10-9
B.10-3
C.10-1
D.10-5
E.10-7
-
Фторид натрия входит в состав препаратов, которые применяют при лечении кариеса зубов. С каким из приведенных соединений реагирует NaF?
A. H2SO4
B.CO2
C.NaCl
D.KI
E.CH3COOH
-
Хлорид кальция применяют при различных патологических состояниях в качестве средства, которое уменьшает проницаемость сосудов и обладает кровоостанавливающими свойствами. С каким из приведенных соединений может реагировать CaCl2?
A.AgNO3
B.KNO3
C.HNO3
D.NaCl
E.CH3COOH
-
Укажите математическое выражение закона действия масс для процесса:
2SO2(г)+O2(г)=2SO3(г):
A.k [SO2]2 · [O2].
B.[2SO2] · [O2].
C.k [SO2] · [O2].
D.k [SO2] + [O2].
E.[SO2]2++[O2].
-
Укажите условие, при котором Cl2 взаимодействует с раствором KOH с образованием хлората калия KClО3:
A.Нагревание
B.Присутствие катализатора
C. Повышенное давление
D.Охлаждение
E.Освещение
-
В окислительно-восстановительных реакциях перманганат калия KMnО4 является только окислителем. При протекании реакции в кислой среде малиновый раствор обесцвечивается. Укажите продукт восстановления
A.Mn2+
B.MnO2
C.MnO42-
D.Mn(OH)2
E.Mn(OH)4
-
Изменение кислотно-щелочных свойств в соединениях MnО - MnО2 - Mn2O7 отвечает закономерности:
A. кислотные свойства усиливаются
B.основные свойства усиливаются
C.кислотно-основные свойства не изменяются
D.кислотные свойства уменьшаются
E.- -
-
Водородный показатель 0,05 М раствора H2SO4 равняется:
A. 1
B.2
C.5
D.4
E.3
-
Водородный показатель 0,01 М раствора HCl равняется:
A. 2
B.3
C.5
D.4
E.6
-
Укажите, какая из приведенных солей подлежит полному необратимому гидролизу:
A. Cr2S3
B.Al2(SO4)3
C.Cr(NO3)3
D.KNO3
E.Na3PO4
-
Присутствие которого из ионов d-элементов в растворах можно установить с помощью K4[Fe(CN)6]
A. Fe3+
B.Fe2+
C.Zn2+
D.Cr3+
E.Cu2+
-
При взаимодействии избытка раствора щелочи с амфотерными металлами образуются:
A.гидроксокомплексы
B.оксиды
C.гидроксиды
D.средние соли
E.основные соли
-
Укажите, какая из приведенных солей подвергаеся лишь частичному гидролизу:
A. K2S
B.NaBr
C.Ca(NO3)2
D.Al2S3
E.BaSO4
-
Укажите, какая из приведенных солей не подвергается гидролизу:
A. KI
B.KNO2
C.CrCl3
D.Al2(SO4)3
E.FeSO4
-
Укажите, какую соль нельзя получить в водном растворе:
A. Cr2S3
B.K3PO4
C.NaNO3
D.FeCl3
E.NH4Cl
-
Водородный показатель 0,001 М раствора KOH равняется:
A. 11
B.13
C.10
D.12
E.9
-
Укажите, какую из приведенных солей надо растворить в воде, чтобы увеличить в растворе концентрацию ионов водорода?
A. ZnCl2
B.Na2CO3
C.NaCl
D.K3PO4
E.K2SO4
-
Сульфат меди(II) используют как антисептическое и вяжущее средство в офтальмологии, гинекологии, урологии, а также как противоядие при отравлении белым фосфором. При взаимодействии с избытком водного раствора аммиака CuSO4 образует соединение, которое содержит ион:
A.[Cu(NH3)4]2+
B.CuOH+
C.[Cu(NH3)2] +
D.[Cu(OH)NH3]+
E.[Cu(H2O)4]2+
-
Ацетат калия при пероральном употреблении проявляет мочегонные свойства. Укажите, с какими из приведенных соединений взаимодействует CH3COOK
A.HCl
B.KOH
C.K2SO4
D.BaSO4
E.NaCl
-
К р-елементам IV группы периодической системы относятся: углерод, кремний, германий, олово и свинец. Укажите, как изменяются металлические свойства элементов в ряду C–Si–Ge–Sn–Pb?
A. увеличиваются
B.уменьшаются
C.не изменяются
D.сначала уменьшаются, а потом увеличиваются
E.сначала увеличиваются, а потом уменьшаются
-
Укажите, какой из металлов не взаимодействует с хлороводородной кислотой?
A. Cu
B.Al
C.Mg
D.Zn
E.Sn
-
Гидрокарбонат натрия применяют в медицине при разных заболеваниях, которые сопровождаются ацидозом. Если на гидрокарбонат натрия подействовать раствором хлороводородной кислоты, образуется газ:
A. CO2
B.CO
C.H2
D.Cl2
E.CH4
-
Среди приведенных соединений укажите эмпирическую формулу минеральной кислоты, раствор которой является лекарственным препаратом:
A.HCl
B.H2SO4
C.HNO3
D.H3PO4
E.H2SO3
-
Аномально низкую способность к диссоциации фтороводородной кислоты объясняют ассоциацией ее молекул за счет:
A. Водородных связей
B.Йонных связей
C.Ковалентных неполярных связей
D.Ковалентных полярных связей
E.Вандерваальсового взаимодействия
-
Хлорофилл – зеленый пигмент растений - является комплексным
соединением. Укажите ион – комплексообразователь в хлорофилле:
A.Mg2+
B.Fe3+
C.Mn2+
D.Fe2+
E.Ni2+
-
Если расположить в порядке уменьшения рН водные растворы с одинаковой молярной концентрацией соединений то выйдет такой ряд:
A.NaOH, NH3, CH3COOH, HCl, H2SO4
B.H2SO4, HCl, NaOH, CH3COOH, NH3
C.CH3COOH, HCl, NaOH, NH3, H2SO4
D.HCl, H2SO4, NH3, CH3COOH, NaOH
E.NH3, CH3COOH, NaOH, HCl, H2SO4
-
Укажите, к какому типу солей относится дигидроксоацетат алюминия, раствор которого под названием “жидкость Бурова” применяется в медицине как вяжущее, противовоспалительное средство:
A. Основные
B.Двойные
C.Смешанные
D.Кислые
E.Средние
-
Проба газа содержит озон. Укажите раствор какого вещества изменит окраску при пропускании через него озона:
A.KI
B.Na2SO4
C.Mg(NO3)2
D. HgCl2
E.H3PO4
-
Тиосульфат натрия используют в медицине как антитоксическое, противовоспалительное и десенсибилизирующий способ. Какая из приведенных формул соединений является формулой тиосульфата натрия?
-
Na2S2O3
-
Na2S2O5
-
Na2SO3
-
Na2S2O4
-
NaHSO4
-
Хлорид кальция применяется при различных патологических состояниях как способ, который уменьшает проницаемость сосудов, как кровоостанавливающий способ. С каким из приведенных соединений может реагировать CaCl2?
-
AgNO3
-
KNO3
-
HNO3
-
NaCl
-
CH3COOH
-
ГФУ рекомендует для исследования фармпрепаратов реактив Na2[Fe(CN)5NO]. Какую степень окисления имеет центральный ион в этом соединении?
-
+3
-
0
-
+1
-
+2
-
+6
-
Карбонат и гидрокарбонат натрия ГФУ рекомендует для исследования фармпрепаратов. Добавляя какой из приведенных реактивов можно отличить раствор Na2CO3 от раствора NaHCO3 ?
-
CaCl2
-
NaCl
-
HCl
-
CH3COOH
-
KCl
-
Какое из приведенных соединений является катионным комплексом?
-
[Cr(H2O)4Cl2]Cl
-
H2[PbCl6]
-
Na3[Co(NO2)6]
-
K3[Fe(CN)6]
-
Na2[Fe(CN)5NO]
-
Сульфат железа (ІІ) входит как составная часть в соединения, которые применяются при лечении железодефицитных анемий. С каким из приведенных соединений реагирует FeSO4?
-
KMnO4
-
HCl
-
CO2
-
FeCl2
-
NaCl
-
Карбонат лития применяют в медицине для профилактики и лечения психозов различного происхождения. С каким из приведенных соединений реагирует Li2CO3?
-
HCl
-
NaCl
-
LiNO3
-
KNO3
-
KCl
-
Ртуть способна образовывать соединения в которых проявляет степень окисления +1 или +2. В какой из приведенных формул соединений, которые ГФУ рекомендует для исследования фармпрепаратов, ртуть проявляет степень окисления +2?
-
K2[HgI4]
-
Hg2Cl2
-
Hg2O
-
Hg2(NO3)2∙H2O
-
Hg2SO4
-
Одним из видов окислительно-восстановительных реакций является реакция диспропорционирования. В какой из приведенных реакций галоген в оксиде при взаимодействии с водой диспропорционирует?
-
СlO2+H2O→HClO2+HClO3
-
Сl2O+H2O→2HClO
-
Сl2O7+H2O→2HClO4
-
I2O5+H2O→2HIO3
-
Br2O+H2O→2HBrO
-
Среди реактивов, которые ГФУ рекомендует для исследования фармпрепаратов есть [Cr(H2O)4Cl2]Cl. Какую степень окисления имеет центральный ион в этом соединении?
-
+3
-
0
-
+2
-
+4
-
+6
-
Оксид серы (IV) является составной частью одного из сильнейших экологических загрязнителей, который называется токсический смог. Какая кислота образуется при растворении оксида серы (IV) в воде?
-
Сернистая (Сульфитная)
-
Серная (Сульфатная)
-
Сероводородная (Сульфидная)
-
Тиосерная (Тиосульфатная)
-
Тетратионовая
-
Для обозначения показателя среды водных растворов пользуются водородным показателем. Во сколько раз молярная концентрация ионов водорода в растворе с рН=4 больше чем молярная концентрация ионов гидроксида?
-
10-6
-
10-10
-
10-4
-
10-12
-
10-2
-
Современные методы исследования дают возможность экспериментально определить пространственную конфигурацию молекулы. Молекула воды имеет строение:
-
Угловую
-
Линейную
-
Тетраэдрическую
-
Треугольную
-
Октаэдрическую
-
Вода, как растворитель, применяется при изготовлении большинства фармпрепаратов и растворов для их анализа. Какие из простых веществ реагируют с водой при комнатной температуре?
-
Хлор
-
Азот
-
Силиций
-
Медь
-
Золото
-
Химические реакции сопровождаются тепловыми эффектами, которые подчиняются такому закону: «Тепловой эффект реакции зависит от исходных веществ и продуктов реакции и не зависит от пути по которому проходит процесс», это:
-
Закон Гесса
-
Закон Генри
-
Закон действующих масс
-
Закон Нернста
-
Закон Авогадро
-
Во время промывания ран пероксидом водорода из раствора выделяются пузырьки газа, что это за газ?
-
Кислород
-
Водород
-
Озон
-
Углекислый газ
-
Азот
-
Исходя из значений произведения растворимости [ПР] укажите, в какой из реакций можно осадить катионы кальция из раствора?
-
Ca2++2F-→CaF2 ПР[CaF2]=4.0∙10-11
-
Ca2++SO42–→CaSO4 ПР[CaSO4]= 9.1∙10-8
-
Ca2++CO32–→CaCO3 ПР[CaCO3]= 4.8∙10-9
-
Ca2++C2O42–→CaC2O4 ПР[CaC2O4]= 3.8∙10-9
-
Ca2++CrO42–→ CaCrO4 ПР[CaCrO4]= 2.3∙10-2
-
Молярная концентрация эквивалента водного раствора соли составляет 0,01 моль/л. Укажите раствор с максимальной величиной ионной силы.
-
Na3PO4
-
CaCl2
-
KNO3
-
NiCl2
-
Mg(HCO3)2
-
Укажите редокс-пару, к какой I2/2I– является восстановителем Е0 (I2/2I–) =0,54В:
-
Сl2/2Cl– Е0=1,36В
-
SO42–/SO Е0=0,45В
-
Sn2+/Sn4+ Е0=0,15В
-
2S2O32–/S4O62– Е0=0,09В
-
2H+/H2 Е0=0В
-
Какая из приведенных солей не подвергается гидролизу
-
K2SO4
-
K2SO3
-
AlBr3
-
CuSO4
-
MnCl2
-
Определить комплексное соединение, заряд центрального атома комплексообразователя которого равен +3:
-
K3[Fe(CN)6]
-
[Pt(NH3)2Cl2]
-
K2[Mn(CN)4]
-
K2[PtCl4]
-
[Ag(NH3)2]NO3
-
Укажите, какие из приведенных частичек являются основаниями Льюиса:
-
F–
-
Ca2+
-
CH4
-
CO2
-
H+
-
Укажите, какие из приведенных частичек являются кислотами Льюиса:
-
BF3
-
NH3
-
CL–
-
CN-
-
SO42–
-
Какой вид изомерии имеет место для комплексного соединения [Pt(NH3)2Cl2]
-
Геометрическая
-
Оптическая
-
Гидратная
-
Ионизационная
-
Координационная
-
К коллигативным свойствам растворов относят:
-
Осмос и осмотическое давление
-
Седиментационную стойкость
-
Кинетическую стойкость
-
Эффект Тиндаля
-
Синенрезис
-
Какой из лигандов является бидентатным?
-
Сульфат ион
-
Роданид ион
-
Цианид ион
-
Пиридин
-
Гидроксид ион
-
Для каких веществ стандартная теплота образования равна нулю
-
O2
-
H2O
-
C6H12O6
-
CO2
-
Ничего из перечисленного
-
Какой соли соответствует выражение для константы гидролиза

-
CuSO4
-
KCN
-
CH3COONa
-
(NH4)2S
-
Ничего из перечисленного
-
Какой соли соответствует выражение для константы гидролиза
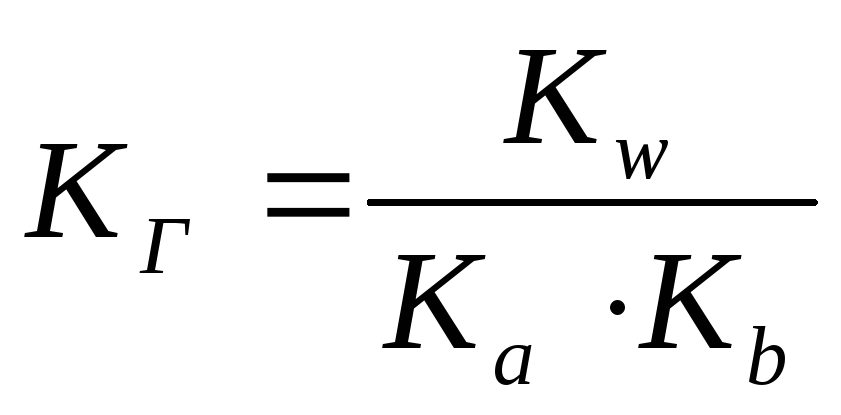
-
(NH4)2S
-
NaCN
-
Fe(NO3)3
-
Li2S
-
NH4Cl
-
На основании величин констант нестойкости определите наиболее нестойкий комплексный ион.
-
[Fe(CN)6]3– Kn=1∙10–31
-
[Ag(CN)2]– Kn=1∙10–21
-
[Ag(CN)2]+ Kn=5,89∙10–8
-
[Ni(CN)4]2– Kn=1∙10–22
-
[Co(CN)6]2+ Kn=4,07∙10–5
-
Гидролиз каких солей происходит в одну стадию без обратимого процесса
-
Cu2S3
-
Na2S
-
CuS
-
AlCl3
-
Ничего из перечисленного
-
Какие ионы могут одновременно находиться в растворе?
-
Fe3+, Cl–
-
Fe2+, OH–
-
Ag+, Cl–
-
Fe3+, OH–
-
Ba2+, SO42–
-
Какая из приведенных формул соответствует электронному строению Fe3+?
-
3d54s0
-
3d54s14p1
-
3d34s2
-
3d34s14p1
-
3d44s1
-
Что представляет собой преобразование Cr3+/CrO42–?
-
Окисление в щелочной среде
-
Окисление в кислой среде
-
Восстановление в кислой среде
-
Восстановление в нейтральной среде
-
Восстановление в щелочной среде
-
Что представляет собой преобразование MnO4–/MnO2?
-
Восстановление в нейтральной среде
-
Окисление в кислой среде
-
Восстановление в кислой среде
-
Окисление в щелочной среде
-
Восстановление в щелочной среде
-
Какая из приведенных формул соответствует электронной конфигурации атома 29 Cu?
-
3d104s1
-
3d94s2
-
3d64s2
-
3d84s2
-
3d74s2
-
На основании значений окислительно-восстановительных потенциалов некоторых реакций марганца, найдите реакцию, где марганец является окислителем.
-
MnO4–+8H++2e→ Mn2++4H2O; E0=1,51B
-
MnO4–+4H2O+3e→ Mn(OH)4+4OH–; E0=0,57B
-
MnO4–+e→ MnO42–; (щелочная среда) E0=0,54B
-
MnO42–+4H2O+2e→ Mn(OH)4+4OH–; E0=0,71B
-
MnO2+4H++2e→ Mn2++2H2O; E0=1,28B
-
На основании значений окислительно-восстановительных потенциалов полуреакций восстановления, определите полуреакцию, где соединение хлора является сильным окислителем.
-
HClO+H++2e→ Cl–+H2O; E0=1,49B
-
Cl2+2e→ 2Cl–; E0=1,36B
-
ClO–+H2O+2e→ Cl–+2 OH–; E0=0,94B
-
ClO3–+6H++4e→ Cl–+3H2O; E0=1,38B
-
ClO4–+8H++8e→ Cl–+4H2O; E0=1,38B
-
Присутствие какого из ионов d-элементов в растворах можно установить с помощью K4[Fe(CN)6]?
-
Fe3+
-
Fe2+
-
Zn2+
-
Cu+
-
Cu2+
-
Комплексная соль имеет состав PtCl4·4NH3. AgNO3 осаждает из раствора этого комплекса половину ионов хлора. Какая из приведенных формул соответствует данному комплексу?
-
[Pt(NH3)4Cl2]Cl2
-
[Pt(NH3)4Cl4]
-
[Pt(NH3)4]Cl4
-
[Pt(NH3)4Cl]Cl3
-
Ничего из перечисленных
-
Изменение кислотно-основных свойств в соединениях MnO→MnO2→Mn2O7соответствует закономерности:
-
Кислотные свойства усиливаются
-
Основные свойства усиливаются
-
Кислотно-основные свойства не изменяются
-
Кислотные свойства уменьшаются
-
Ничего из перечисленного
-
Перекись водорода может принимать участие во всех перечисленных реакциях, за исключением:
-
Получение водорода
-
Получение кислорода
-
Выступать в роли окислителя
-
Выступать в роли восстановителя
-
Реакция диспропорционирования
-
На какой металл не действует концентрированная азотная кислота?
-
Cr
-
Na
-
Mg
-
Cu
-
Zn
-
Какой газ образуется в результате действия концентрированной азотной кислоты на серу?
-
NO2
-
NO
-
N2
-
N2O
-
NH3
-
Какие соединения алюминия используются в качестве кровоостанавливающего средства?
-
KAl(SO4)2∙12H2O
-
Al(NO3)3∙9H2O
-
AlCl3∙6H2O
-
Al2(SO4)3∙18H2O
-
Ничего из перечисленного
-
Какое соединение железа не может быть выделено в свободном состоянии:
-
H2FeO4
-
KFe[Fe(CN)6]
-
K2FeO4
-
FeCl3
-
FeO
-
Высокую энергию термической диссоциации молекулы СО (энергия связи 1075 кДж) обуславливает:
-
Тройная связь между атомами кислорода и углерода
-
Ковалентная связь
-
Донорно-акцепторная связь
-
Высокая полярность молекулы
-
Ничего из перечисленного
-
Какая из приведенных формул соответствует фосфорноватистой (гипофосфитной) кислоте.
-
H3PO2
-
H3PO3
-
H3PO4
-
H4P2O7
-
Ничего из перечисленного
-
При обычных условиях кислород не взаимодействует с перечисленными элементами, за исключением:
-
Cu
-
Au
-
Ne
-
N2
-
Cl2
-
Временная жесткость воды обусловлена наличием в природной воде следующих солей кальция и магния:
-
Гидрокарбонатов
-
Сульфатов
-
Хлоридов
-
Нитратов
-
Ничего из перечисленного
-
Концентрированная серная кислота при взаимодействии с малоактивными металлами восстанавливается до соединения:
-
SO2
-
S
-
H2S
-
H2S2O3
-
Ничего из перечисленного
-
При растворении золота, платины, палладия в «царской водке» образуются соли металлов:
-
Хлориды
-
Сульфаты
-
Нитраты
-
Нитриты
-
Ничего из перечисленного
-
Укажите максимально возможное число электронов на четвертом энергетическом уровне.
-
32
-
16
-
8
-
25
-
40
-
На основе электронной структуры атома хлора укажите суммарное число р-электронов в этом атоме:
-
11
-
12
-
10
-
17
-
15
-
Какая запись соответствует элементу 4-го периода IV группы главной подгруппы:
-
4s24p4
-
4s13d5
-
6s26p2
-
6s25d2
-
3s23p4
-
Какие утверждения характеризует метод молекулярных орбиталей?
-
Заполнение молекулярных орбиталей происходит по тем же принципам, что и заполнение атомных орбиталей
-
Состояние электрона в атоме и молекуле описывается подобными волновыми функциями
-
Число молекулярных орбиталей не зависит от числа атомных орбиталей
-
При добавлении и отнимании атомных орбиталей происходит выделение энергии
-
Электроны заполняют сначала молекулярные орбитали с высшим, а потом с меньшим значением энергии
